A sarcoidose pode ocorrer em qualquer idade e afecta normalmente os pulmões, mas vários outros órgãos podem também estar envolvidos. O diagnóstico consiste em várias etapas, não existem análises ao sangue específicas que confirmem ou excluam a sarcoidose. Histologicamente, a sarcoidose é caracterizada por granulomas celulares epitelioides, não necrosantes. Uma vez identificada a sarcoidose pulmonar, é importante procurar envolvimento extratorácico relevante; as manifestações dos órgãos cardíacos, em particular, podem ser potencialmente fatais.
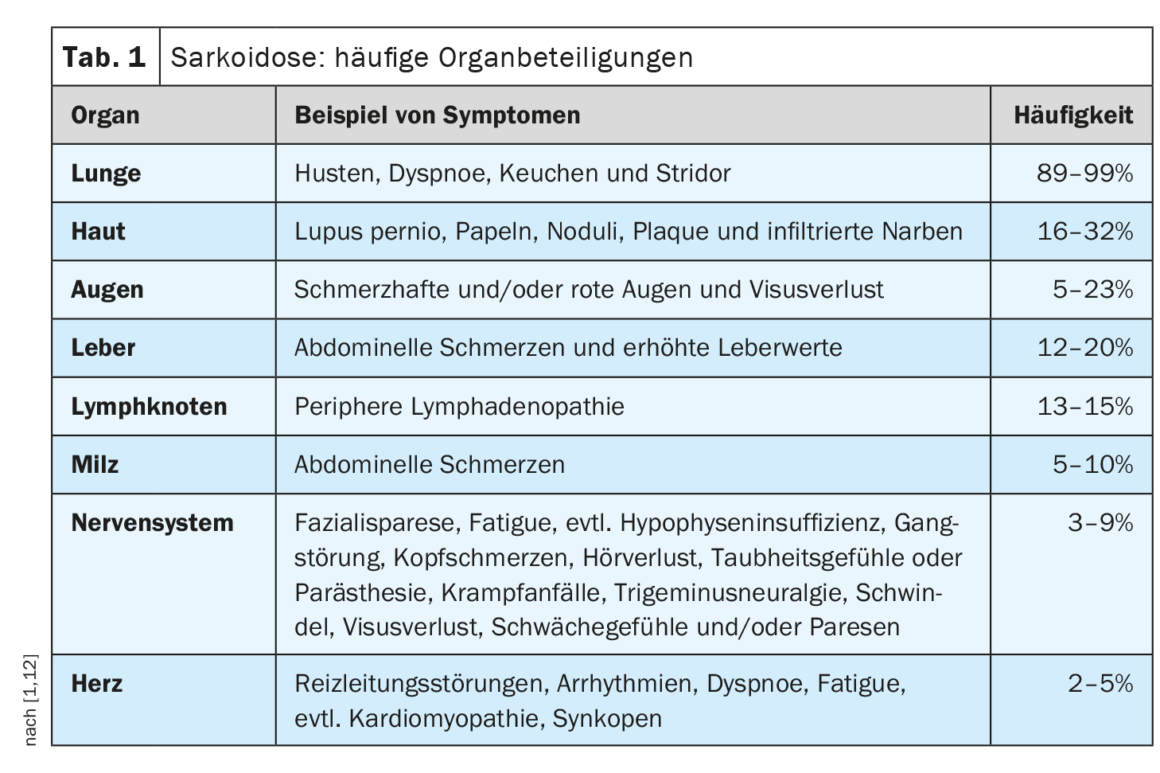
A evolução clínica e o prognóstico da sarcoidose são muito heterogéneos e dependem do envolvimento dos respectivos órgãos, explicou o Prof. Dr. Jörg D. Seebach, médico chefe do Service d’immunologie et allergologie, Hôpitaux universitaires de Genève [1]. Os pulmões, os gânglios linfáticos, a pele e os olhos são os mais frequentemente afectados, enquanto as manifestações cardíacas, renais e neurológicas são menos comuns, mas estão associadas a uma maior morbilidade [2]. O quadro 1 apresenta uma visão geral das manifestações orgânicas mais comuns. [1,3]O diagnóstico da sarcoidose baseia-se principalmente nas características clínicas e radiológicas, na identificação de granulomas não necrosantes numa ou mais amostras de tecido e na exclusão de outras causas de doença granulomatosa . Por vezes, a sarcoidose é autolimitada – cerca de metade dos doentes com sarcoidose sofrem uma remissão espontânea no prazo de dois anos e muitos outros no prazo de cinco anos após o início dos sintomas [4]. No entanto, existem também formas graves de progressão. As causas mais comuns de morte nos doentes com sarcoidose são a insuficiência respiratória na fibrose pulmonar avançada e o envolvimento cardíaco ou neurológico grave [3]. O Quadro 2 resume as recomendações relativas à anamnese e às medidas de rastreio e o Quadro 3 esclarece as dúvidas em caso de suspeita de envolvimento de órgãos.
Os procedimentos broncoscópicos são minimamente invasivos
Se houver suspeita de sarcoidose com base nos sintomas clínicos e nos achados radiológicos, o orador recomenda a realização de uma biopsia [1]. Em princípio, as amostras histológicas devem ser colhidas no local que ofereça a exposição menos invasiva e as melhores possibilidades de diagnóstico. Uma vez que os pulmões são afectados na maioria dos casos, a broncoscopia é um procedimento seguro e minimamente invasivo [2]. Existem vários procedimentos broncoscópicos de diagnóstico, incluindo a biópsia endobrônquica (mucosa), a biópsia pulmonar transbrônquica (TBLB) ou a aspiração transbrônquica com agulha (TBNA) de gânglios linfáticos hilares/mediastínicos e a lavagem broncoalveolar (BAL). As bioespécimes extrapulmonares, por exemplo, da pele, glândulas parótidas ou lacrimais, gânglios linfáticos palpáveis ou lesões conjuntivais, são também possíveis, mas menos específicas. Em qualquer caso, a histologia deve ser acompanhada de manifestações clínicas e radiológicas compatíveis e da exclusão de outras doenças. Se houver confirmação histológica em locais extrapulmonares e envolvimento pulmonar concomitante com suspeita de infecção, como doença pulmonar cavitária, pode ser necessária uma broncoscopia para excluir causas infecciosas, como micobactérias e fungos [2].
A manifestação pulmonar é o envolvimento de órgão mais comum
O envolvimento dos pulmões e/ou dos gânglios linfáticos mediastínicos/hilares é o envolvimento de órgão mais comum, ocorrendo em cerca de 80-90% dos doentes com sarcoidose. A manifestação pulmonar está associada ao envolvimento do parênquima e a granulomas perivasculares. Os sintomas mais comuns são uma sensação de pressão no peito, uma tosse seca e dispneia. Na evolução tardia, pode desenvolver-se fibrose com insuficiência respiratória [5]. Uma vez que a sarcoidose pulmonar pode apresentar-se com padrões obstrutivos, restritivos, mistos ou normais, os resultados dos testes de função pulmonar são muito inespecíficos, mas importantes para avaliar a gravidade, a indicação e a resposta ao tratamento. A doença pulmonar intersticial (DPI) é um achado típico nos estádios 2, 3 e 4, variando desde manifestações subclínicas até à fibrose pulmonar em fase terminal (estádio 4). Esta última é uma lesão irreversível dos órgãos, enquanto a DPI ligeira a moderada relacionada com a sarcoidose é um sintoma tratável.
A manifestação cardíaca é menos frequente, mas o prognóstico é desfavorável
Enquanto cerca de 90% de todos os doentes com sarcoidose têm envolvimento pulmonar, a ocorrência de sarcoidose cardíaca é bastante rara, com uma prevalência de 2-7% [6]. No entanto, em doentes com sarcoidose extracardíaca confirmada, recomenda-se a pesquisa de envolvimento cardíaco através de um ECG [7]. Isto porque a sarcoidose cardíaca é uma manifestação potencialmente ameaçadora da vida [2]. As modernas técnicas de imagiologia podem ser úteis para a detecção precoce. Estes incluem uma RM cardíaca com técnica de realce tardio com gadolínio (LGE) e FDG-PET [8]. O envolvimento cardíaco pode manifestar-se por arritmias ventriculares, bloqueio cardíaco de alto grau ou insuficiência cardíaca crónica devido à infiltração granulomatosa do miocárdio e/ou, em fases mais avançadas da doença, fibrose [2]. Os sintomas possíveis incluem dores no peito, palpitações, tonturas e síncope. A morte cardíaca súbita ocorre em até 25%. [2,9]Em resumo, o diagnóstico e o tratamento precoces do envolvimento cardíaco são essenciais. [13]As manifestações típicas da sarcoidose cardíaca são perturbações da condução, arritmias ventriculares e insuficiência cardíaca. Em cerca de um quarto dos casos, a sarcoidose cardíaca ocorre de forma isolada e sem envolvimento pulmonar, segundo o Prof. Seebach [1]. Isto está frequentemente associado a um pior prognóstico em comparação com a sarcoidose sistémica com envolvimento cardíaco. Os diagnósticos diferenciais importantes são: miocardite linfocítica, algumas cardiomiopatias genéticas, aumento fisiológico da captação de FDG na insuficiência cardíaca [1].
Diagnóstico diferencial: o que deve ser considerado?
“O diagnóstico diferencial é muito importante”, sublinhou o orador [1]. Os achados histopatológicos são de grande importância neste contexto. A sarcoidose caracteriza-se por granulomas compactos, não necrosantes, com uma distribuição perilinfática ao longo dos feixes broncovasculares, paraseptal e pleural [2]. Em biópsias pulmonares abertas, a sarcoidose está frequentemente associada a vasculite granulomatosa sem destruição das paredes dos vasos. No decurso da progressão da doença, predomina a fibrose hialinizada com restos de granulomas. A beriliose crónica é um diagnóstico diferencial essencial da sarcoidose, especialmente em doentes com exposição a metais. A doença granulomatosa induzida por infliximab também deve ser considerada. Estas entidades podem ser bem diferenciadas histologicamente da sarcoidose. Outros diagnósticos diferenciais incluem doenças malignas (linfomas, carcinomas), colagenoses vasculares (lúpus eritematoso sistémico, síndrome de Sjögren, cirrose biliar primária, artrite granulomatosa familiar), infecções (VIH, [2,10,11] tuberculose), vasculite (granulomatose com poliangiite, arterite de Takayasu, arterite de células gigantes), pneumonite de hipersensibilidade, pneumoconiose, doença relacionada com a IgG4 e várias doenças de imunodeficiência). A morfologia e o padrão de distribuição dos granulomas relacionados diferem da sarcoidose.
Doenças infecciosas como a tuberculose, myobacterium avium, histoplasmose, coccidiomicose e doença de Whipple) apresentam uma distribuição peribronquial ou aleatória de granulomas e estão frequentemente associadas a necrose. A utilização de colorações especiais (colorações de Ziehl-Neelsen, auramina e prata) ou de testes PCR para o complexo Mycobacterium tuberculosis e miobactérias atípicas pode ser informativa para a detecção de agentes patogénicos. Em contraste com a sarcoidose, a pneumonite de hipersensibilidade é caracterizada por acumulações soltas de histiócitos perto dos bronquíolos. A granulomatose com poliangiite (anteriormente também designada por granulomatose de Wegener) caracteriza-se por necrose basófila rodeada por um infiltrado celular que contém células gigantes. A granulomatose sarcoide nodular é por vezes considerada uma variante da sarcoidose e caracteriza-se igualmente por uma necrose extensa que, ao contrário da granulomatose com poliangiite, é eosinofílica e demarcada por numerosos granulomas compactos acompanhados por uma vasculite granulomatosa sem destruição das paredes dos vasos.
O diagnóstico diferencial em caso de manifestações neurológicas deve basear-se nos achados da RM (especialmente lesões focais periventriculares versus lesões parenquimatosas ou lesões meníngeas). As novas técnicas de RM optimizaram a sensibilidade, mas devido à falta de especificidade, a contenção do diagnóstico continua a ser um desafio. [2]. O espectro de diagnósticos diferenciais vai desde doenças auto-imunológicas, inflamatórias ou idiopáticas (por exemplo, EM, doença do espectro da neuromielite óptica, LES, síndrome de Sjögren, doença de Behçet, vasculite primária do SNC) a entidades infecciosas (por exemplo, tuberculose, doença de Lyme, neurossífilis, taxoplasmose) e neoplasias (neoplasias primárias do SNC, linfomas e outras) [2].
Literatura:
- «Sarcoidosis: Beyond the Lungs and Lymph Nodes», Prof. Dr. med. Jörg D. Seebach, Allergy and Immunology Update, Grindelwald, 27.–29.1.2023.
- Franzen DP, et al.: Sarcoidosis – a multisystem disease. Swiss Med Wkly. 2022;152: w 30049.
- Graf L, Geiser T: Das Chamäleon unter den Systemerkrankungen: «Die Sarkoidose». Swiss Med Forum 2018; 18(35): 695–701.
- Valeyre D, et al.: Sarcoidosis. Lancet (London, England) 2014; 383(9923): 1155–1167.
- Lichtenberger N: Diagnostik und Therapie der Kardialen und pulmonalen Sarkoidose. https://opus.bibliothek.uni-wuerzburg.de, (letzter Abruf 23.02.2023)
- Costabel U, et al. [Cardiac sarcoidosis: diagnostic and therapeutic algorithms]. Pneumologie (Stuttgart, Germany) 2014; 68(2): 124–132.
- Birnie DH, et al.: HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart rhythm 2014; 11(7): 1305–1323.
- Giblin GT, et al.: Cardiac Sarcoidosis: When and How to Treat Inflammation. Card Fail Rev 2021;7:e17. doi: 10.15420/cfr.2021.16.
- Hamzeh N, et al.: Pathophysiology and clinical management of cardiac sarcoidosis. Nat Rev Cardiol 2015; 12(5): 278–288.
- Valeyre D, et al.: Clinical presentation of sarcoidosis and diagnostic work-up. Semin Respir Crit Care Med 2014; 35(3): 336–351.
- Spagnolo P, et al.: Pulmonary sarcoidosis. Lancet Respir Med 2018; 6(5): 389–402.
- Grunewald J, et al.: Sarcoidosis. Nat Rev Dis Primers 2019; 5(1): 45.
- Birnie D, et al.: Cardiac Sarcoidosis. Clinics in chest medicine 2015; 36(4): 657–668.
HAUSARZT PRAXIS 2023; 18(5): 40–42
Foto da capa: Hellerhoff, wikimedia