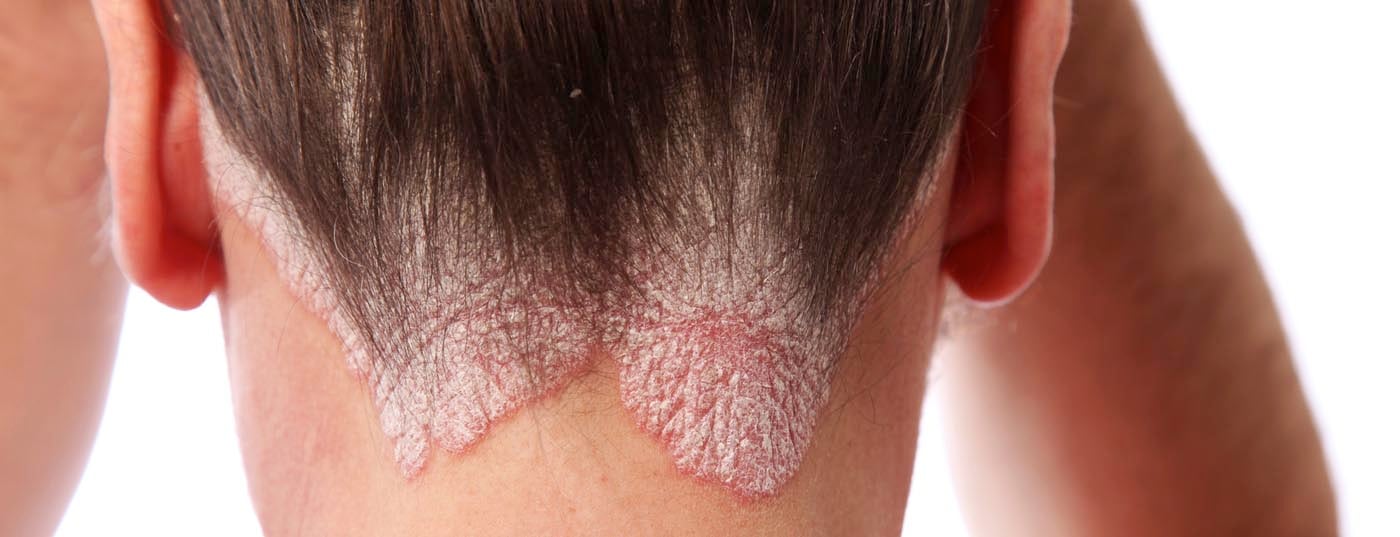
Recentemente, um estudo multinacional de grande escala investigou o impacto da psoríase e da artrite psoriásica (PsA) na vida das pessoas com a condição. Isto mostrou que várias áreas da situação da doença requerem uma atenção intensificada e uma maior necessidade de acção. Por exemplo, encontraram um elevado número de doentes subtratados e diferentes avaliações da doença por parte do médico e da pessoa afectada. Assim, espera-se novas opções terapêuticas. Neste contexto, são interessantes os resultados de um ensaio em grande escala da fase III apresentado no Congresso da AAD em Denver.
(ag) O estudo MAPP (“The Multinational Assessment of Psoriasis and Psoriatic Arthritis”) [1] examinou a qualidade de vida relacionada com a doença (QoL), a relação médico-paciente, as necessidades de tratamento não satisfeitas e a satisfação do paciente com as opções actuais de psoríase e artrite psoriásica (PsA). O objectivo era descobrir até que ponto os sucessos terapêuticos actualmente alcançáveis diferem da experiência do paciente individual, o que de facto ainda parece ser um grande problema: a maioria dos pacientes (85%) gostaria de ter melhores opções de tratamento. Quase 60% dos doentes com PsA declararam não ter recebido qualquer terapia. Além disso, a maioria das pessoas com psoríase com 4% ou mais da superfície corporal afectada não receberam nenhuma terapia ou receberam apenas terapia tópica. Isto não se deve menos ao facto de muitos pacientes terem sido submetidos a medicação oral ou biológica tradicional numa altura ou outra, mas muitas vezes tiveram de parar isto de novo (57% com medicação oral tradicional e 45% com biologia). As razões para isto foram principalmente encontradas em problemas de segurança, tolerabilidade e eficácia. Aproximadamente 50% dos doentes com psoríase e PsA relataram que achavam que tanto os medicamentos orais tradicionais como os biológicos eram onerosos.
Como esperado, o estudo também mostrou um impacto notavelmente negativo da psoríase e da PsA na QoL. O factor decisivo aqui é que os médicos e os pacientes avaliam obviamente a gravidade das condições de forma diferente. Por exemplo, a comichão foi descrita como o sintoma mais perturbador pela maioria das pessoas afectadas, mas, segundo os autores, este ponto é negligenciado na avaliação médica. Para o fazer, concentram-se frequentemente em elementos da doença facilmente mensuráveis, tais como a área lesionada e o número de articulações afectadas. Contudo, isto não reflecte adequadamente o peso da doença, uma vez que os pacientes com pequenas lesões nas mãos e pés, por exemplo, são também severamente limitados em termos da vida quotidiana.
Nova opção terapêutica no horizonte?
Carle Paul, MD, Toulouse, apresentou os resultados das 16 semanas do ensaio aleatório e controlado da fase III ESTEEM 2 no Congresso da AAD deste ano em Denver [2]. O estudo investigou o apremilast (APR), um inibidor oral de fosfodiesterase 4 (PDE4), em 413 doentes com psoríase moderada a grave (“psoriasis area and severity index” PASI ≥12, “body surface area” BSA ≥10% e “static physician global assessment” sPGA ≥3). Após a aleatorização, 138 pacientes receberam placebo e 275 pacientes receberam APR 30 mg duas vezes por dia. Isto foi feito ao longo de um período de 16 semanas. Seguiu-se uma fase em que todos os pacientes foram tratados com RPA até à semana 32 e uma fase de descontinuação aleatória até à semana 52.
Resultados da semana 16: Mais doentes altamente significativos alcançaram PASI-75 (28,8%) e PASI-50 (55,5%) com APR em comparação com placebo (5,8 e 19,7%, respectivamente, p<0,0001). As alterações mediana/meios em relação aos respectivos PASI de base foram -15,8/-18,0% para placebo e -50,9/-56,0% para APR. Um número significativamente maior de pacientes alcançou uma pontuação sPGA de 0 ou 1 com APR (20,4%) em comparação com placebo (4,4%, p<0,0001). Ou seja, APR permitiu uma decomposição completa (0) ou quase completa (1) significativamente mais frequente.
APR também mostrou taxas de resposta significativamente mais elevadas (p<0,0001) para áreas difíceis de tratar em comparação com placebo: A psoríase em unhas, couro cabeludo e também, mas menos significativamente (p=0,0315), em áreas palmo-plantares respondeu bem à RPA. Isto é encorajador, segundo o Dr. Paul, uma vez que a psoríase afecta gravemente os doentes crónicos nestas áreas. Em termos do estudo da MAPP, isto mostra um benefício melhorado da terapia da psoríase.
A maioria dos eventos adversos observados, como náuseas, diarreia, nasofaringite, dores de cabeça de tensão e vómitos foram leves a moderados e raramente levaram à interrupção do tratamento (por semana 16 a 5,5%, o que é comparável aos 5,1% no placebo). Uma crise ou recaída de psoríase foi medida com mais frequência durante as dezasseis semanas em placebo (5,1%) do que em RPA (1,5%). A diarreia e as náuseas sob RPA tiveram a maior incidência na primeira semana e geralmente recuaram completamente no espaço de um mês. Efeitos secundários graves tais como infecções graves, malignidades e eventos cardiovasculares eram consistentes com os ensaios APR anteriores.
Uma análise separada do ESTEEM 1 sobre a segurança e tolerabilidade do apremilast [3], também apresentada no congresso da AAD, não tinha já mostrado quaisquer efeitos secundários novos ou inesperados em comparação com os dos ensaios da semana 16 ou anteriores da fase II.
Fonte: Academia Americana de Dermatologia (AAD) Reunião Anual , 21-25 de Março de 2014, Denver
Literatura:
- Lebwohl MG, et al: Patient perspectives in the management of psoriasis: Results from the population-based Multinational Assessment of Psoriasis and Psoriatic Arthritis Survey. Journal of the American Academy of Dermatology 2014; 70(5): 871-881.e30.
- Paul C, et al: Apremilast, um inibidor da fosfodiesterase 4 oral, em doentes com psoríase moderada a grave: Resultados de 16 semanas de um ensaio de fase 3, aleatório e controlado (ESTEEM 2). Cartaz AAD 2014 #8412.
- Reich K, et al: Segurança a longo prazo e tolerabilidade do Apremilast, um inibidor da fosfodiesterase 4 oral, em doentes com psoríase moderada a grave: Resultados de um ensaio de Fase III, aleatório e controlado (ESTEEM 1). Cartaz AAD 2014 #8296.
ESPECIAL DO CONGRESSO 2014; 5(2): 9-10