A pontuação focal (FS) em biópsias das glândulas salivares menores labiais é um dos dois critérios mais importantes (com positividade anti-SSA) para o diagnóstico da síndrome de Sjögren primária (pSS). A fim de reduzir as taxas de erro nos diagnósticos, os algoritmos de aprendizagem profunda que utilizam redes neuronais artificiais poderão ser utilizados para apoiar os patologistas no futuro.
De acordo com os critérios ACR/EULAR para o pSS, a classificação da pontuação de foco (FS) é um dos três critérios de classificação, mas requer conhecimentos especializados que nem sempre estão disponíveis na prática. 53% dos casos conduzem a uma revisão do diagnóstico quando avaliados por peritos.
A aprendizagem automática envolve famílias de algoritmos que podem receber uma grande quantidade de dados e utilizá-los para prever algo, por exemplo. A aprendizagem profunda é um subconjunto deste domínio que se centra apenas numa família de algoritmos e que se designa por “redes neuronais profundas”, explicou Louis Basseto, Scienta Lab, Departamento de Investigação, Paris, a título de introdução [1].
A aprendizagem profunda já está a ser utilizada na patologia médica, por exemplo, no cancro da mama, onde já utiliza algoritmos para reconhecer metástases em amostras de tecido dos gânglios linfáticos com grande precisão e com melhor desempenho do que os patologistas. “O nosso grupo também demonstrou que a aprendizagem automática pode ser utilizada na artrite reumatoide para prever a resposta ao metotrexato e aos inibidores do TNF”. Agora, os investigadores propuseram-se aplicar a aprendizagem profunda à síndrome de Sjögren e descobrir se pode ajudar na categorização da pontuação de foco e no diagnóstico da pSS?
Aprendizagem profunda baseada em biopsias de glândulas salivares
Para o efeito, desenvolveram duas redes de aprendizagem profunda utilizando biópsias digitalizadas de glândulas salivares labiais de doentes para prever a pontuação focal (FS ≥1 ou FS <1) e o diagnóstico da síndrome de Sjögren primária com base apenas na histologia (pSS+ ou pSS-). O estudo incluiu 325 doentes (145 da Universidade de Paris-Saclay, Hospital Bicêtre, 71 da Universidade Queen Mary de Londres e 109 da Universidade de Birmingham), utilizando biópsias obtidas na prática clínica de rotina. Os participantes foram divididos em três grupos:
- pSS e FS <1 (32%, sintomas de sicca)
- pSS+ e FS ≥1 (47%)
- pSS+ e FS <1 (21%)
Todos os FS foram previamente confirmados por patologistas e os diagnósticos de pSS por especialistas.
Uma ou mais imagens da biopsia são utilizadas para fazer uma previsão. Cada imagem é dividida em mosaicos e o algoritmo atribui uma pontuação de risco a cada um desses mosaicos de forma independente. Todas estas informações são depois combinadas para fazer uma previsão da pontuação do foco ou do diagnóstico, dependendo do algoritmo utilizado.
“Utilizamos dois conjuntos de dados diferentes”, explicou Basseto: um conjunto de treino (70% dos doentes) e um conjunto de validação (30% dos doentes). Os dois conjuntos contêm a mesma proporção de classes positivas e negativas (pSS+/pSS- ou FS ≥1/FS <1) und die verschiedenen Zentren, aus denen sich die Teilnehmer zusammensetzen, sind im Training und in der Validierung gemischt. Diese beiden Aufgaben nennt man «semi-supervised learning», also halbüberwachtes Lernen. «Das ist der Schlüssel zum Verständnis der Arbeit: Halbüberwachtes Lernen bedeutet, dass wir dem Modell im Training zwar Informationen geben – z.B. sagen wir ihm, wenn ein Patient einen FS>1. No entanto, não dizemos quais as partes da imagem que levariam um patologista a acreditar nisto. O modelo determina-o a partir dos próprios dados.”
Potenciais novos biomarcadores
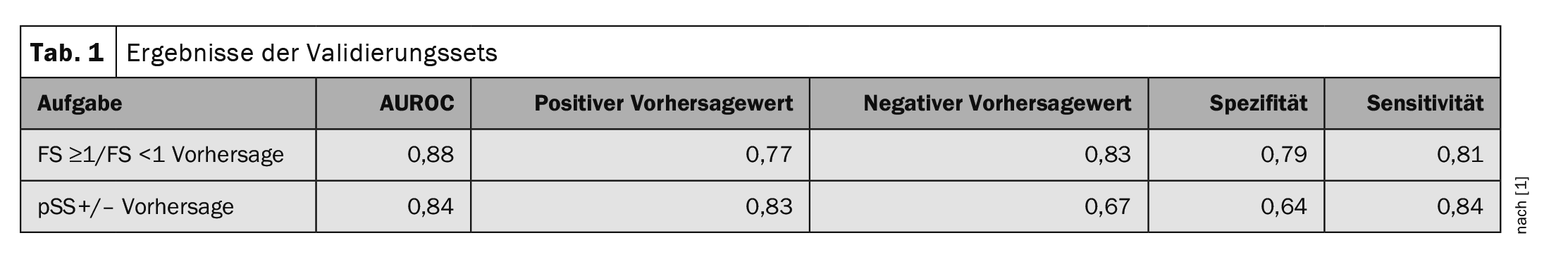
O desempenho do algoritmo foi medido utilizando a área sob a curva ROC (AUROC). No que respeita à pontuação do foco (FS ≥1/FS <1), o algoritmo alcançou um AUROC de 0,88. 77% das previsões positivas eram efetivamente pacientes com uma pontuação de foco ≥1. No caso do valor de previsão negativo, 83 por cento dos dados indicaram corretamente que se tratava de um FS<1. No caso da previsão do diagnóstico, o AUROC foi de 0,84. 83% dos doentes com uma previsão positiva do algoritmo eram de facto Sjögren positivos (pSS+) e 67% dos doentes com uma previsão negativa eram de facto Sjögren negativos (pSS-) (Tabela 1).
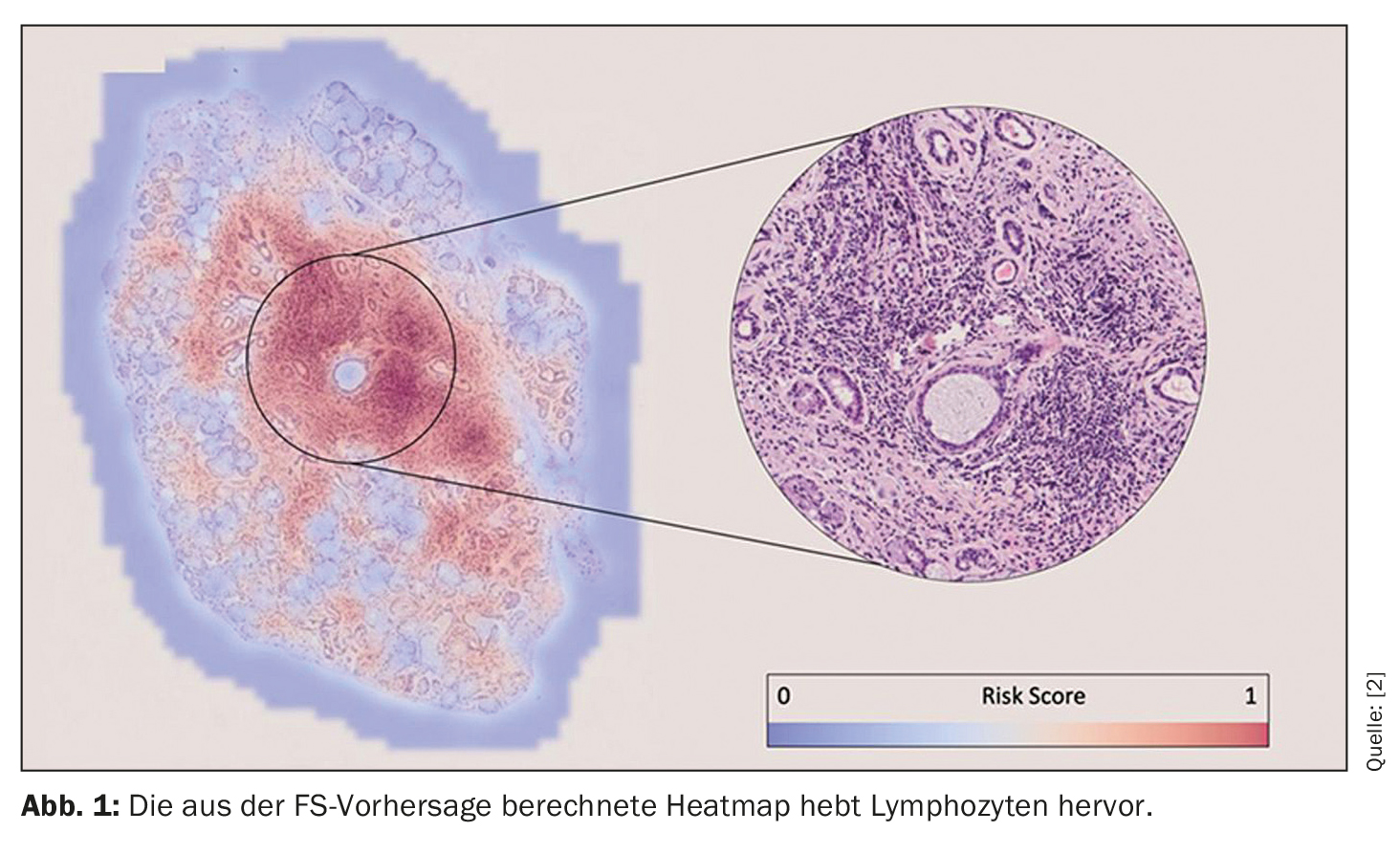
“Estas previsões foram feitas apenas com base nas imagens. Não dissemos ao algoritmo onde procurar para tomar a sua decisão – mas após o treino, podemos rever os algoritmos para ver em que base fizeram as suas previsões”. A conclusão dos investigadores foi que o algoritmo para a pontuação do foco identificou focos de linfócitos para fazer uma previsão (Fig. 1). Isto assegura a explicabilidade e permite ao patologista confirmar visualmente os resultados da previsão. Isto é, portanto, tranquilizador para a FS, diz Basseto, “mas o que é tranquilizador para a FS é muito excitante para o diagnóstico, uma vez que pode levar à potencial identificação de novos biomarcadores histológicos que só têm interesse para a população pSS+ e FS<1)”. Este aspeto é de particular interesse para o trabalho futuro do grupo de investigação.
Mensagens para levar para casa
- A aprendizagem profunda prevê com precisão a pontuação de foco e o diagnóstico da síndrome de Sjögren primária com base em biópsias de glândulas salivares labiais.
- A aprendizagem profunda pode potencialmente reduzir a taxa de erro no diagnóstico em cerca de 2,5 vezes. A taxa de erro devido à aprendizagem profunda é de 19,7% contra 53% para centros não especializados.
Perspectivas:
- São necessárias mais avaliações clínicas para validar os algoritmos na prática clínica real.
- Validação adicional numa coorte maior.
- O trabalho em curso visa identificar novos biomarcadores histológicos associados ao diagnóstico da ESP.
Congresso: EULAR 2023
Fonte:
- Basseto L: Vortrag «Deep Learning Accurately Predicts Focus Score and Diagnosis of Primary Sjögren Syndrome using Labial Salivary Gland Biopsies»; EULAR 2023, Mailand, 2.6.2023 (online).
- Basseto L: Scientific Abstract OP0232, EULAR 2023; doi: 10.1136/annrheumdis-2023-eular.418.
InFo RHEUMATOLOGIE 2023: 5(2): 20–21