A anemia é um problema comum na prática geral. Com base na história médica e em alguns parâmetros laboratoriais, cerca de 90% das anemias podem ser esclarecidas na prática do médico de clínica geral e a causa explicada [1]. O Dr. med. Christoph Merlo, Lucerna, apresentou um algoritmo de clarificação correspondente e simples num workshop
A anemia é definida por uma diminuição da concentração de hemoglobina, sendo o limite inferior de hemoglobina definidora de anemia dependente da população de referência e, por vezes, do analisador. Os valores padrão de hemoglobina utilizados pelos diferentes laboratórios podem, portanto, desviar-se dos valores padrão definidos pela OMS(Tab. 1). A definição da OMS também não tem em conta que a hemoglobina diminui fisiologicamente em média nos homens a partir dos 65 anos de idade, mas não nas mulheres. “A decisão de fazer ou não um teste de anemia é tomada individualmente na prática de qualquer forma. Muito mais importante do que o valor absoluto da hemoglobina é a história, sintomas e co-morbilidades do paciente”, explicou Christoph Merlo, MD, Lucerne. Para além dos sintomas clássicos de fadiga, dispneia ao esforço, intolerância ao desempenho, palpitações/tachicardia, anemia também pode causar dores de cabeça.

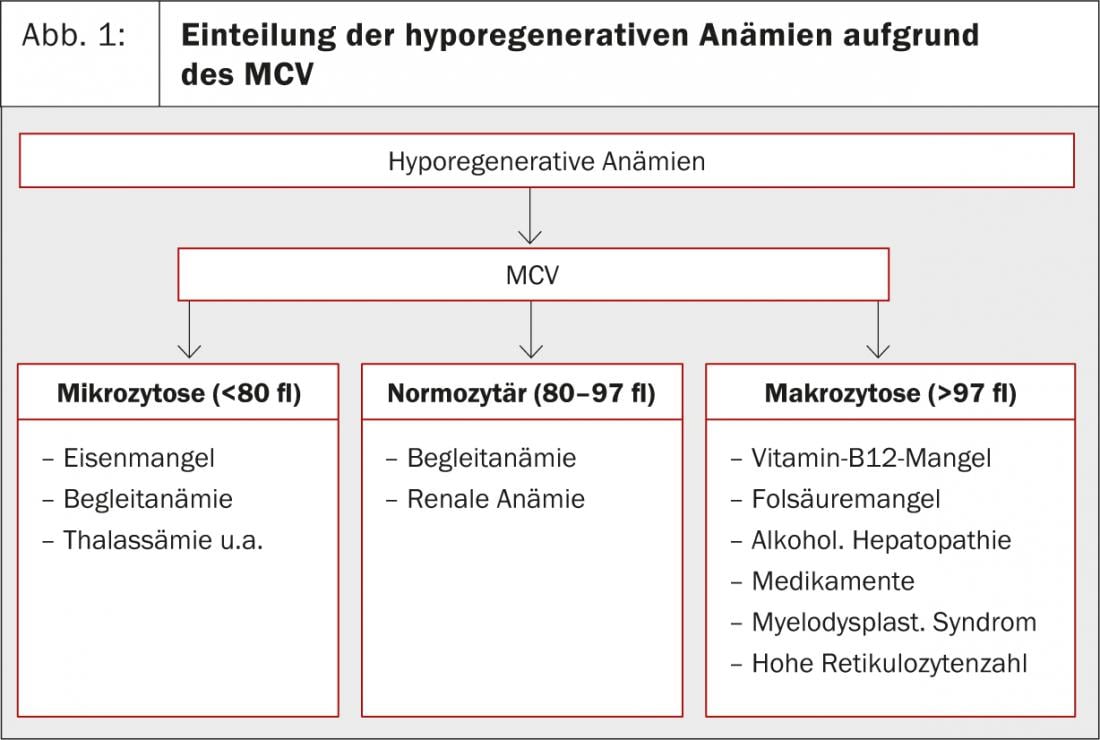
As anemias são classificadas com base na contagem de reticulócitos e no MCV (volume corpuscular médio). Se o número de reticulócitos for inferior a 100 G/l, trata-se de uma anemia hiporegenerativa. Se for superior a 100 G/l, trata-se de uma anemia hiperregenerativa. Para esta última, existem apenas duas causas possíveis: hemorragia subaguda e hemólise. “Um aumento passivo dos reticulócitos também pode ser observado quando um paciente com deficiência de ferro ou de vitamina B12 é recentemente substituído”, acrescentou o Dr. Merlo. As anemias hiporegenerativas são ainda subdivididas em anemias microcíticas, normocíticas e macrocíticas baseadas no MCV(Fig. 1).
Em alguns casos, a causa da anemia, que é principalmente registada com um hematograma composto por hemoglobina, hematócrito, contagem de eritrócitos, índices e contagem de leucócitos, já pode ser esclarecida com base na anamnese (por exemplo, anemia sob quimioterapia). Se o MCV também corresponder, podem ser dispensados esclarecimentos adicionais nestes casos. Contudo, um simples laboratório básico que consiste na contagem de reticulócitos, ferritina incluindo CRP e ALAT (GPT), vitamina B12, ácido fólico eritrócito e creatinina (para determinar a depuração da creatinina) é normalmente necessário para esclarecer a causa da anemia. Este algoritmo simples, com o qual cerca de 90% das anemias podem ser conclusivamente esclarecidas na prática do clínico geral [1], é mostrado na figura 2. Se houver suspeita de doença da medula óssea ou se for necessário esclarecer anemias hemolíticas especiais, o doente deve ser encaminhado para um hematologista para mais esclarecimentos (Quadro 2).

Deficiência de ferro, insuficiência renal crónica e outras doenças crónicas (tumores, inflamações) estão entre as causas mais frequentes de anemia numa prática de cuidados primários [1]. “No nosso próprio inquérito, cerca de um terço dos doentes tinha mais do que uma causa de anemia”, acrescenta o Dr. Merlo.
O valor de ferritina mostra deficiência de ferro
O melhor parâmetro para detectar a deficiência de ferro é a ferritina. O ferro de soro não é adequado para isto, uma vez que está sujeito a fortes flutuações diurnas. A única causa da diminuição da ferritina é a deficiência de ferro. “Para fins práticos, a seguinte regra de ouro prova o seu valor: se o valor de ferritina do soro for inferior a 50 μg/l, é possível uma deficiência de ferro, inferior a 30 μg/l muito provável e inferior a 15 μg/l comprovada”, explica o Dr. Merlo. Uma vez que a ferritina reage como uma proteína de fase aguda, ou seja, é elevada na inflamação, e também pode ser elevada na doença hepática crónica, a PCR e a alanina-aminotransferase (ALAT) devem ser sempre determinadas ao mesmo tempo que a ferritina. Em condições inflamatórias crónicas com CRP elevado, a deficiência de ferro pode ser detectada com a ajuda do elevado receptor de transferrina solúvel, para além de outros testes especiais.
Naturalmente, a substituição do ferro só deve ser feita em casos de deficiência comprovada. As necessidades de ferro podem ser calculadas utilizando a hemoglobina e os défices de ferritina com uma fórmula simples (Tab. 3).

Deve-se também notar que com a substituição oral, apenas 10% do ferro fornecido é absorvido. Com uma necessidade de ferro de 2000 mg, um total de 20 000 mg deve, portanto, ser dado. As preparações de ferroivalente devem ser administradas em jejum, caso contrário a absorção é ainda pior. O ferro trivalente (Maltofer®) é primeiro convertido em ferro bivalente no intestino e pode ser tomado com as refeições, o que pode melhorar a tolerância. Se a adesão for fraca, por exemplo, em doentes multimórbidos com polifarmácia, anemia renal ou pouca tolerância, a substituição do ferro oferece uma alternativa. Para monitorizar o sucesso da terapia, pode ser observado um aumento de reticulócitos após 5-10 dias e um aumento da hemoglobina após duas semanas. O ferro intravenoso estimula a ferritina, razão pela qual, neste caso, é necessário esperar pelo menos quatro semanas até este valor ser verificado.
Fonte: “Anämieabklärung in der Praxis”, workshop na 81ª Reunião Anual do SGIM, 29-31 de Maio de 2013, Basileia.
Literatura:
- Merlo CM, Wuillemin WA: Prevalência e causas de anemia numa prática familiar urbana. Prática 2008; 97: 713-718.
- Merlo CM, Wuillemin WA: Diagnóstico e terapia da anemia na prática. Prática 2009; 98: 191-199.