As feridas colonizadas com biofilmes são um dos maiores desafios no tratamento de feridas crónicas. Estima-se que 2% da população da Europa Central sofre de feridas crónicas, com o risco a aumentar com a idade. Diagnosticar e tratar a doença subjacente, geralmente doença oclusiva arterial periférica (DAC), insuficiência venosa (IVC), diabetes mellitus tipo I ou II ou uma doença imunológica, é sempre o primeiro passo para um tratamento bem sucedido. As infecções recorrentes (locais) e o biofilme persistente da ferida prolongam o processo de cicatrização.
As feridas colonizadas com biofilmes são um dos maiores desafios no tratamento de feridas crónicas. Estima-se que 2% da população da Europa Central sofre de feridas crónicas, com o risco a aumentar com a idade. Diagnosticar e tratar a doença subjacente, geralmente doença oclusiva arterial periférica (DAC), insuficiência venosa (IVC), diabetes mellitus tipo I ou II ou uma doença imunológica, é sempre o primeiro passo para um tratamento bem sucedido. As infecções recorrentes (locais) e o biofilme persistente da ferida prolongam o processo de cicatrização.
As feridas colonizadas com biofilmes são um dos maiores desafios no tratamento de feridas crónicas [1,2]. Estima-se que 2% da população da Europa Central sofre de feridas crónicas, com o risco a aumentar com a idade [3]. O diagnóstico e tratamento da doença subjacente, geralmente doença arterial periférica (DAC), insuficiência venosa (IVC), diabetes mellitus tipo I ou II ou uma doença imunológica, é sempre o primeiro passo para um tratamento bem sucedido [4]. As infecções recorrentes (locais) e o biofilme persistente da ferida prolongam o processo de cicatrização. Isto geralmente leva meses e também requer tratamento intersectorial (hospital, ambulatório, clínica geral ou especialista, enfermagem) [5]. Além disso, uma vez fechada uma ferida, não há garantia de que esta permanecerá fechada. Consequentemente, o termo “remissão de feridas” é mais apropriado do que “cicatrização de feridas” para pacientes com distúrbios crónicos de cicatrização de feridas.
Biofilme da ferida – definição e patogénese
Segundo uma meta-análise, cerca de 78% de todas as feridas crónicas são colonizadas com microrganismos patogénicos sob a forma de biofilmes [6]. Estes são responsáveis pela cronicidade de uma ferida, dada a melhor terapia possível para a doença subjacente [2]. O biofilme da ferida é definido da seguinte forma:
“O biofilme é uma comunidade estruturada de micróbios com diversidade genética e expressão genética variável (fenótipo) que cria comportamentos e mecanismos de defesa que levam à produção de infecções únicas (crónicas) com tolerância significativa a antibióticos e antimicrobianos, ao mesmo tempo que é protegida da imunidade do hospedeiro”. [Processo Consenso Delphi, IWII 05/2016].
Qualquer ferida, mesmo uma ferida aguda, é colonizada em poucas horas com microrganismos do microbioma da pele, que também pode conter espécies patogénicas. O leito da ferida é um bom local de reprodução para eles. Nesta fase, fala-se de “contaminação de feridas”. Com o passar do tempo, as bactérias multiplicam-se dentro e sobre a ferida; formam-se colónias bacterianas. A limpeza externa (anti-séptica) de feridas pode reduzir a colonização bacteriana e o sistema imunitário também funciona contra a propagação de bactérias na ferida. Se estes processos não ocorrerem ou se as células imunitárias locais não forem suficientemente eficientes, cada vez mais bactérias colonizam a ferida. É referida como “colonizada”, ou “criticamente colonizada”, se a carga bacteriana aumentar com uma reacção local de acompanhamento.
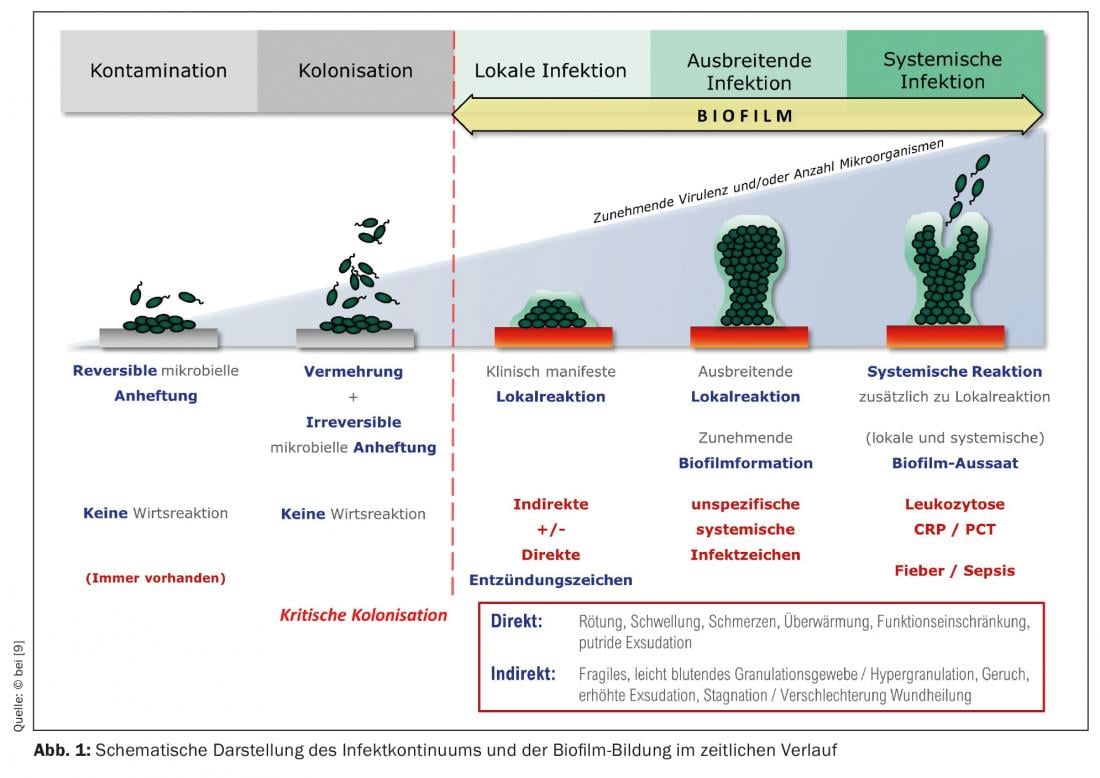
Os chamados biofilmes imaturos podem formar-se a partir destas colónias bacterianas em apenas 24 horas (Fig. 1). Na maioria dos casos, estes biofilmes não consistem apenas numa espécie bacteriana (como é o caso dos biofilmes de implantes em cirurgia ortopédica), mas contêm muitas espécies bacterianas diferentes, ou seja, um biofilme multiespecífico. As principais espécies bacterianas em biofilmes de feridas, aqui usando o exemplo de úlceras de perna, são Staphylococcus aureus (47,6%), a sua variante resistente à meticilina (MRSA) (8,6%), Pseudomonas aeruginosa (31,1%) e enterobactérias (28,6%) [7]. Estes microrganismos – mais raramente, os fungos também estão envolvidos – começam a rodear-se da chamada substância extrapolimérica (EPS), quase se “muralhando”. O EPS consiste principalmente em polissacarídeos (por exemplo, alginato, celulose, dextrano) e uma variedade de proteínas, lípidos, glicoproteínas, glicolípidos [8], ou seja, açúcares e proteínas, o que o faz aderir firmemente ao leito da ferida. Após 2-4 dias, fala-se de “biofilme maduro”. Pode tornar-se até 2 mm de espessura, ou seja, plástico e visível (Fig. 2A/B). Nesta fase, o biofilme é capaz de libertar bactérias planctónicas (suspensas no fluido) com o exsudado da ferida, que é produzido abundantemente devido à inflamação. (Fig. 1), que pode colonizar o ambiente da ferida ou outras feridas [9]. Aqui começa de novo o ciclo de formação do biofilme.
Reconhecer o biofilme da ferida
O primeiro e mais importante passo é o diagnóstico clínico, ou seja, considerar mesmo a possibilidade de colonização do biofilme da ferida (crónica) como um factor interferente na cicatrização. O biofilme maduro pode ser facilmente identificado e verificado clinicamente através da exploração da ferida (borda) usando fórceps ou curetas (Fig. 2A/B) . O biofilme da ferida em si proporciona uma resposta imunitária mais ou menos pronunciada e duradoura ou inflamação local. Pode ser a base de uma infecção de ferida, mas também pode persistir durante semanas e meses sem a induzir.
Nas feridas com persistência do biofilme nu, normalmente não há danos (tecidos) pronunciados, para além da falta de cicatrização, porque as várias espécies microbianas no biofilme existem simbioticamente com metabolismo reduzido e proliferação reduzida e alimentam-se do exsudado (humano) da ferida. Por outro lado, existem também biofilmes altamente agressivos de feridas, por exemplo, os dominados por P. aeruginosa , que levam a uma exsudação severa e dermatite ambiental, o que consequentemente causa o alargamento da ferida. Um forte odor a ferida é comum.
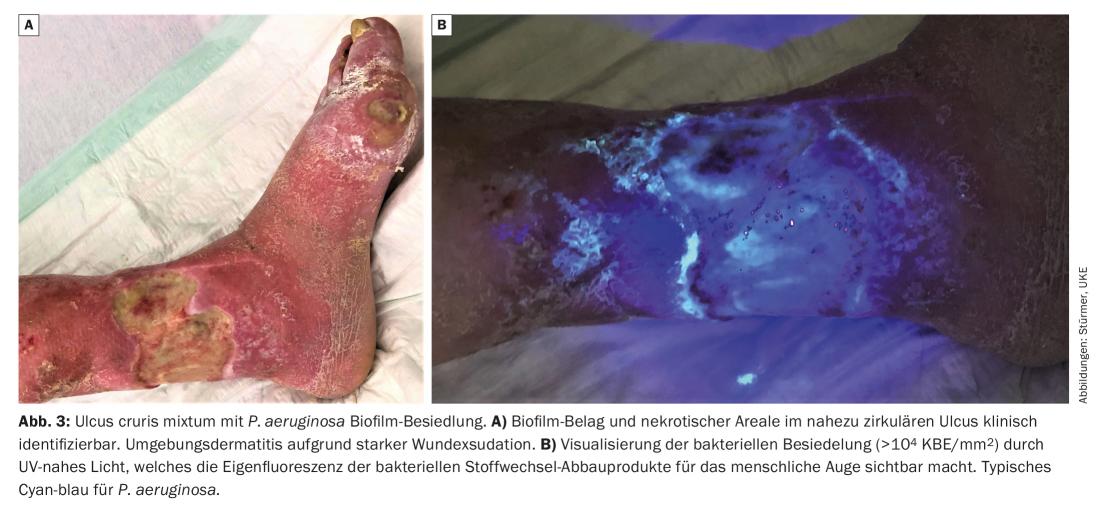
Um biofilme da ferida ou uma forte colonização bacteriana da ferida (>104 CFU/mm2) podem ser tornados visíveis ao olho humano utilizando luz UV (por exemplo MolecuLight®, MolecuLight Corp., Toronto, Canadá) (Fig. 3) : Usando luz de comprimento de onda de 450 nm, as áreas de alta actividade metabólica bacteriana podem ser visualizadas pela fluorescência vermelha dos produtos metabólicos bacterianos depositados, tais como as porfirinas (de, por exemplo Staphylococcus Spp. e Enterobacteriaceae) ou pela fluorescência azul-cianada de pyoverdin segregada por Pseudomonas Spp. [10]. Também poderia ser detectado a partir de muitas feridas que P. aeruginosa coloniza predominantemente e infiltra-se na margem da ferida, enquanto que S. aureus é mais provável de ser encontrado na base da ferida.
A terapia do biofilme da ferida
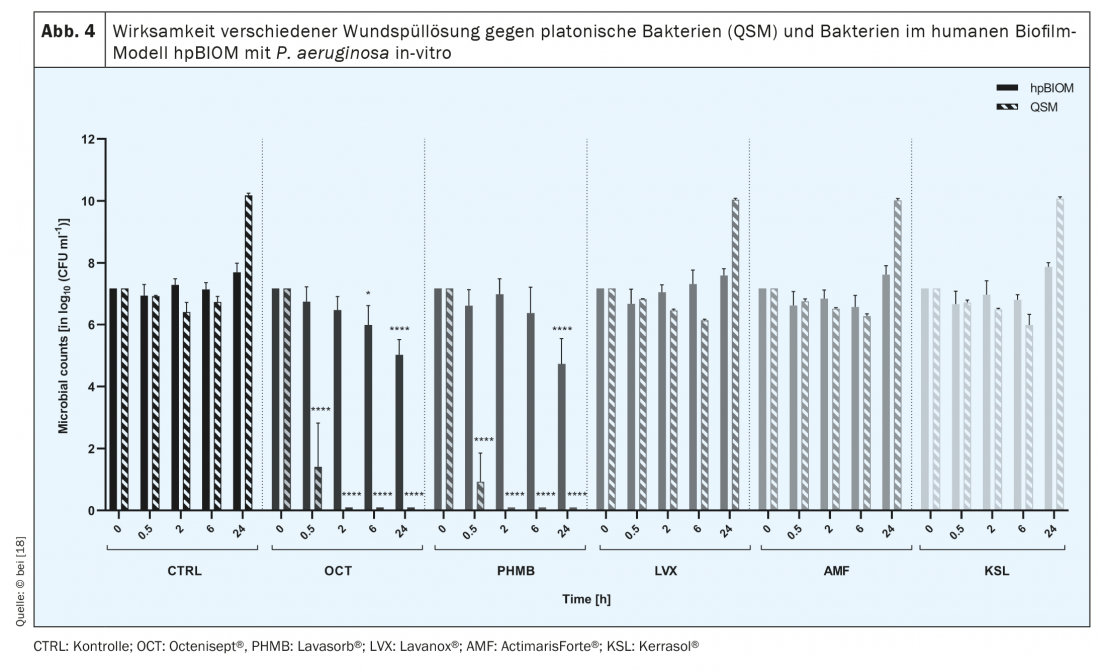
A comunidade simbiótica e interespécies de microrganismos a partir dos quais se formam os biofilmes produz uma substância protectora, a chamada substância extrapolimérica (EPS), que funciona como uma barreira bioquímica contra o sistema imunitário do hospedeiro e, em particular, contra agentes antimicrobianos [11,12]. Por conseguinte, estes últimos falham frequentemente na erradicação do biofilme [13–15] (Fig. 4) . Através de moléculas de sinalização, os microrganismos também podem comunicar entre si, por exemplo, para alterar a sua actividade metabólica [13,15]. Uma menor actividade metabólica de bactérias específicas, as chamadas células persister na profundidade do biofilme, bem como a interacção de diferentes microrganismos, por exemplo através da transferência de genes de resistência lateral, são outros aspectos que contribuem para a elevada resiliência dos biofilmes [17]. A sua “tolerância” a substâncias antimicrobianas, soluções e pensos é elevada, pois estes levam à indução da morte celular de bactérias e fungos, mas não à destruição do EPS. Desta forma, os agentes antimicrobianos não podem desdobrar a sua eficácia contra os microorganismos, uma vez que – devido ao “escudo protector” do EPS – nem sequer penetram neles [15]. O mesmo se aplica aos antibióticos sistematicamente aplicados, que, devido ao EPS, não conseguem penetrar suficientemente fundo no biofilme da ferida por dentro, ou seja, do leito da ferida, para eliminar completamente os germes patogénicos. Não só por esta razão, mas em geral, a prescrição de antibióticos na terapia de feridas crónicas deve ser considerada criticamente, a fim de evitar o desenvolvimento de resistência no longo processo de cicatrização de feridas crónicas.
Biofilme de feridas e soluções (antimicrobianas) de irrigação de feridas
Existem várias abordagens para eliminar a colonização de biofilme de feridas [17]. Por exemplo, são recomendadas soluções antimicrobianas comercialmente disponíveis que demonstraram ser eficazes nas análises in vitro. No entanto, a observação clínica por vezes contradiz o desempenho antimicrobiano declarado [18] (Fig. 4).
Existem diferentes tipos de solução de irrigação de feridas: com alguns, como a solução fisiológica salina ou NaCl, o foco é o efeito de limpeza, diluição; com os outros grupos, a eficácia antimicrobiana mais ou menos pronunciada. Sabe-se que algumas soluções de irrigação de feridas perdem o seu potencial antimicrobiano quando entram em contacto com ambientes ricos em proteínas, tais como os do exsudado da ferida [19]. Consequentemente, a eficácia das diferentes soluções de irrigação de feridas contra biofilmes bacterianos também varia, com o EPS também a actuar como um “escudo protector”. As soluções antimicrobianas de irrigação de feridas abordam e destroem as paredes bacterianas, membranas e proteínas de transporte bacteriano ou inibem a sua função. Se não conseguirem quebrar o EPS, que consiste principalmente em polissacarídeos e proteínas, não podem funcionar eficazmente.
Não existem estudos clínicos comparativos com soluções (antimicrobianas) de irrigação de feridas, que poderiam ser a base para recomendações terapêuticas diferenciadas. Contudo, testes sistemáticos de translação usando o modelo de biofilme humano hpBIOM mostram que Octenisept® é capaz de clivar biofilmes e matar as bactérias neles presentes dentro de 72 h (!). [15,18] (Fig. 5). PHMB tem um sucesso limitado no mesmo período, mas a erradicação completa não é alcançada mesmo após 72 horas. As soluções de irrigação de feridas hipoclorosas e a clorexidina não conseguem eliminar eficazmente as bactérias do biofilme [18].
Biofilme de feridas e pensos antimicrobianos
As feridas colonizadas com biofilme podem ser basicamente divididas em dois tipos: Feridas com biofilme residente e menos agressivo. Estes caracterizam-se por um ambiente de ferida silencioso com exsudação ligeira a moderada (Fig. 2) . O outro tipo de biofilme de ferida mostra uma exsudação pesada que requer mudanças diárias de penso. É obrigatório acompanhar inchaço, vermelhidão, uma elevada sensibilidade de toda a região da ferida e muitas vezes até uma dermatite circundante (Fig. 3). Portanto, nestes doentes, deve ser dada especial atenção à pele circundante da ferida e esta também deve ser tratada (por exemplo, ureia, zinco ou pomadas de cortisona de baixa dose).
Estudos clínicos comparativos com pensos (antimicrobianos) para feridas são raros [20]. É difícil obter recomendações terapêuticas diferenciadas a partir disto, pois não só as substâncias activas (iões de prata, prata nanocristalina, PHMB, derivados de iodo, etc.) e as suas concentrações variam, mas também a respectiva base dos pensos (espuma de PU, alginatos, fibras, etc.). Vários testes in vitro utilizando um modelo de biofilme humano mostraram que um produto combinado de iodo e amido (iodo cardexómero) foi capaz de erradicar completamente as bactérias do biofilme no prazo de 6 (!) dias (Fig. 5). Outros pensos para feridas contendo PHMB ou prata (classe MP 2B) apenas reduziram a carga bacteriana [21]. No entanto, os pensos antimicrobianos foram analisados durante 6 dias sem alterações; uma maior eficácia deve ser alcançada por todos os pensos testados com mudanças de penso diárias ou de 2 dias.
Biofilme da ferida e desbridamento (aguçado)
O desbridamento cirúrgico ou afiado consistente é actualmente a única terapia eficaz e sustentável para o biofilme de feridas recomendada por consenso de especialistas [6]; contudo, nem sempre é uma opção viável no contexto dos cuidados domiciliários (por exemplo, higiene limitada, pacientes anticoagulados por medicamentos). A aplicação desta terapia local comparativamente agressiva mesmo em feridas “calmas” com colonização por biofilme (Fig. 2) requer por vezes algum esforço por parte do praticante: Após a remoção do penso, a ferida deve ser inspeccionada visualmente ou com a ajuda da luz UV acima mencionada, para a remover com uma cureta e/ou bisturi, se necessário. Só após a sua remoção é que as substâncias antimicrobianas em soluções e pensos para feridas podem actuar eficazmente contra os restantes microrganismos patogénicos.
O desbridamento cirúrgico é frequentemente indicado quando é necessário remover tecido necrótico, para além do biofilme da ferida [22]. É realizado sob anestesia por condução ou intubação. Em comparação com o desbridamento afiado, é mais invasivo e também remove partes da margem da ferida e do leito da ferida usando um bisturi e uma máquina de barbear. O tamanho da ferida aumenta em conformidade no início. Outra opção para remover o biofilme da ferida é o desbridamento químico (por exemplo, Debrichem®), que elimina eficazmente as bactérias mas também se infiltra no leito da ferida e na margem da ferida. Aqui são mortas bactérias profundas, mas também estão envolvidas células humanas, de modo que também aqui o efeito primário é o alargamento da ferida [23,24].
Conclusão
O biofilme (bacteriano) da ferida requer uma terapia complexa localmente porque consiste em vários “componentes”. É importante perceber que se encontra em mais de 75% de todas as feridas crónicas e pode, portanto, ser removida. A limpeza de feridas por meio de solução de irrigação e compressão por si só não é suficiente. A persistência da colonização do biofilme causa a estagnação da cicatrização das feridas. Contudo, independentemente da terapia local, a doença subjacente que levou à cronificação da ferida deve ser sempre tratada de forma causal. Consequentemente, uma ferida com biofilme altamente exsudativa não é uma contra-indicação para a terapia de compressão medicamente indicada (por exemplo, em IVC, linfedema ou lipoedema).
Mensagens Take-Home
- Diagnosticar e tratar a condição subjacente é sempre essencial em doentes com feridas crónicas.
- Cerca de 78% de todas as feridas crónicas são colonizadas com microrganismos patogénicos sob a forma de biofilmes.
- As principais espécies bacterianas nos biofilmes de feridas são S. aureus e P. aeruginosa.
- Soluções antimicrobianas de irrigação de feridas e curativos tratam e matam bactérias. No entanto, muitas vezes não penetram no EPS do biofilme, que consiste principalmente em polissacáridos e proteínas, e por isso não podem agir eficazmente.
- O desbridamento cirúrgico ou afiado consistente é actualmente o único tratamento eficaz e sustentável do biofilme da ferida recomendado por consenso de especialistas.
Literatura:
- Noskin GA, Rubin RJ, Schentag JJ, et al: National trends in Staphylococcus aureus infection rates: impact on economic burden and mortality over a 6-year period (1998-2003). Clin Infect Dis 2007; 45(9): 1132-1140.
- James GA, Swogger E, Wolcott R, et al: Biofilmes em feridas crónicas. Wound Repair Regen 2008; 16(1): 3-44.
- Heyer K, Herberger K, Protz K, et al: Epidemiologia das feridas crónicas na Alemanha: Análise dos dados estatutários do seguro de saúde. Wound Repair Regen 2016; 24(2): 434-442.
- Hachenberg T, Senturk M, Jannasch O, Lippert H: [Infecções de feridas pós-operatórias. Fisiopatologia, factores de risco e conceitos preventivos]. Anestesista 2010; 59(9): 851-866; quiz 867-858.
- Augustin M SrE, Dissemond J, Gerber V, et al.: Recomendações para melhorar a estrutura de cuidados a pessoas com feridas crónicas na Alemanha. Wound Management 2020; 14: 357-365.
- Malone M, Bjarnsholt T, McBain AJ, et al: The prevalence of biofilms in chronic wounds: a systematic review and meta-analysis of published data. J Wound Care 2017; 26(1): 20-25.
- Jockenhofer F, Gollnick H, Herberger K, et al.: Bacteriological pathogen spectrum of chronic leg ulcers: Resultados de um ensaio multicêntrico em centros de tratamento dermatológico de feridas diferenciados por regiões. J Dtsch Dermatol Ges 2013; 11(11): 1057-1063.
- Flemming HC, Wingender J.: A matriz do biofilme. Nat Rev Microbiol 2010; 8(9): 623-633.
- Rembe JD, Stuermer EK: Modern wound antisepsis – indicações e limitações, entre conhecimento, desejo e incerteza. Cirurgia Vascular 2020; 25: 272-276.
- Stuermer EK, Besser M, Debus ES, et al: Infiltração bacteriana em feridas colonizadas por biofilme: Análises no modelo de ferida ex vivo hpBIOM e possível impacto no esfregaço e desbridamento. Int Wound J 2022 (em revisão).
- Thurlow LR, Hanke ML, Fritz T, et al: Os biofilmes de Staphylococcus aureus previnem a fagocitose de macrófagos e atenuam a inflamação in vivo. J Immunol 2011; 186(11): 6585-6596.
- Cowan T: Biofilmes e sua gestão: do conceito à realidade clínica. J Wound Care 2011; 20(5): 220, 222-226.
- Larsen T, Fiehn NE.: Resistência dos biofilmes de Streptococcus sanguis aos agentes antimicrobianos. APMIS 1996; 104(4): 280-284.
- Percival SL, Salisbury AM, Chen R: Prata, biofilmes e feridas: resistência revisitada. Critério Rev Microbiol 2019; 45(2): 223-237.
- Besser M, Dietrich M, Weber L, et al.: Eficácia dos anti-sépticos num novo modelo tridimensional de biofilme de plasma humano (hpBIOM). Rep. Sci 2020; 10(1): 4792.
- Williams P, Winzer K, Chan WC, Camara M: Olha quem fala: comunicação e detecção do quórum no mundo bacteriano. Philos Trans R Soc Lond B Biol Sci 2007; 362(1483): 1119-1134.
- Johani K, Malone M, Jensen SO, et al: Avaliação de curtos períodos de exposição de soluções de feridas antimicrobianas contra biofilmes microbianos: de in vitro a in vivo. J Antimicrob Chemother 2018; 73(2): 494-502.
- Rembe JD, Huelsboemer L, Plattfaut I, et al: Antimicrobianos Antimicrobianos Hipoclorosos Soluções de Rega Demonstram Menor Eficácia Anti-biofilme Contra Biofilme Bacteriano num Modelo de Biofilme de Plasma Humano Complexo in-vitro (hpBIOM) do que os Antimicrobianos Antimicrobianos Comuns. Microbiol frontal 2020; 11: 564513.
- Rembe JD, Fromm-Dornieden C, Stuermer EK: A influência do fluido humano de feridas agudas (AWF) na eficácia antibacteriana de diferentes pensos anti-sépticos de espuma poliuretano: uma análise in-vitro. Wound Repair Regen 2018; 26: 27-35.
- Schwarzer S, James GA, Goeres D, et al: A eficácia dos agentes tópicos utilizados em feridas para gerir infecções crónicas de biofilme: Uma revisão sistemática. J Infect 2020; 80(3): 261-270.
- Stuermer EK, Plattfaut I, Dietrich M, et al: Actividade in vitro de curativos antimicrobianos de feridas em biofilme de P. aeruginosa. Microbiol frontal 2021; 12: 664030.
- Dissemond J, Bültemann A, Gerber V, et al.: Position paper of the Initiative Chronische Wunde (ICW) e.V. on the nomenclature of debridement of chronic wounds. Hautarzt 2022; 24 [Online ahead of print].
- Schwarzer S, Radzieta M, Jensen SO, Malone M: Eficácia de um agente de ferida tópica ácido metanossulfónico e dimetilsulfóxido em Biofilmes In Vitro. Int J Mol Sci 2021; 22: 9471.
- Cogo A, Quint BJ, Bignozzi CA: Reiniciar o processo de cura de feridas crónicas usando um novo dessecante: Uma série de casos prospectivos. Feridas 2021; 33: 1-8.
PRÁTICA DO GP 2022, 17(7): 12-17