A realização de citometria de fluxo a partir de amostras de LCR de alta qualidade permitiu a identificação de assinaturas específicas de células imunitárias em diferentes doenças neurológicas. Desta forma, a diferenciação de várias doenças neurológicas, por exemplo, neuropatias imunitárias e doenças auto-imunes do sistema nervoso central, poderia ser melhorada e o conhecimento adquirido sobre as possíveis populações celulares envolvidas nas diferentes doenças.
No Departamento de Neurologia com o Instituto de Neurologia Translacional do Hospital Universitário de Münster, a citometria de fluxo a partir de amostras de LCR de alta qualidade foi realizada a uma escala anteriormente inatingível e foi estabelecida uma base de dados única e abrangente que permitiu a identificação de assinaturas específicas de células imunitárias em diferentes doenças neurológicas. Isto melhorou a diferenciação de várias doenças neurológicas, por exemplo, neuropatias imunitárias e doenças auto-imunes do sistema nervoso central, e forneceu uma visão das possíveis populações celulares envolvidas nas diferentes doenças. O artigo seguinte permite uma visão geral do trabalho científico baseado na citometria de fluxo do líquido cefalorraquidiano e dá uma breve visão geral de certas composições de células imunitárias em doenças neurológicas importantes.
O LCR como janela de diagnóstico para o sistema nervoso central
O líquido cefalorraquidiano (LCR para abreviar) é um líquido claro que circula à volta do sistema nervoso central (SNC) e envolve o cérebro e a medula espinal. Neste contexto, o LCR não só fornece protecção mecânica, mas também provavelmente fornece nutrientes às células do sistema nervoso central [1], serve como meio de transporte para as células imunitárias [2] e medeia o transporte de antigénios entre o SNC e os compartimentos periféricos, tais como o sangue [3]. A fracção não celular do LCR é produzida como um ultrafiltrado do soro no plexo coróide nos ventrículos cerebrais, em que os solutos passam do soro para o LCR, dependendo do seu tamanho. A drenagem do LCR (reabsorção na circulação) tem lugar através dos sistemas venoso e linfático [3,4]. As células do LCR são leucócitos, que são chamados leucócitos do LCR ou células do LCR. A concentração de células no QCA é cerca de mil vezes inferior à do sangue periférico. Em condições fisiológicas, o CSF contém ≤4 CSF leucócitos/µl (ou <5/liquor-leucócitos/µl). O perfil celular no LCR é linfocítico e monocítico e caracteriza-se por uma dominância de linfócitos CD4+ T. Em comparação com o sangue periférico, os linfócitos de memória e linfócitos T reguladores e as células assassinas naturais (NK) são aumentados no LCR, enquanto os linfócitos B são reduzidos e os plasmócitos não estão presentes em condições fisiológicas [5,6]. Isto sugere que a composição celular do QCA forma o seu próprio compartimento, que está sujeito a regulação e controlo rigorosos e deve ser regulado independentemente do sangue periférico. Uma vez que o LCR rodeia o sistema nervoso central, é o compartimento mais próximo do SNC que é acessível na prática clínica para a análise diagnóstica por punção lombar. É bem conhecido que o LCR pode fornecer informações sobre os mecanismos celulares das doenças do SNC. A imunofenotipagem de células do LCR – como apresentamos neste artigo – pode ajudar a obter novos conhecimentos sobre a fisiopatologia, tornar as análises de diagnóstico mais precisas e avaliar melhor os prognósticos individuais. No futuro, isto poderá ajudar a desenvolver novas abordagens terapêuticas para várias doenças do sistema nervoso [7,8].
Citometria de fluxo de células do LCR numa escala sem precedentes
A citometria de fluxo é um método para a detecção quantitativa e caracterização molecular de células. Orientado para as propriedades celulares, este procedimento permite a classificação em diferentes classes celulares (por exemplo, linfócitos, monócitos). Na citometria de fluxo, as células de uma suspensão são registadas num chamado citómetro de fluxo. Cada célula individual passa por um raio laser, de cujo “perfil de resposta” é possível a detecção do tamanho da célula, da granularidade da célula e da expressão dos marcadores celulares de cada célula individual. As combinações específicas de marcadores determinam que população celular está envolvida (Tab. 1) [5,14].
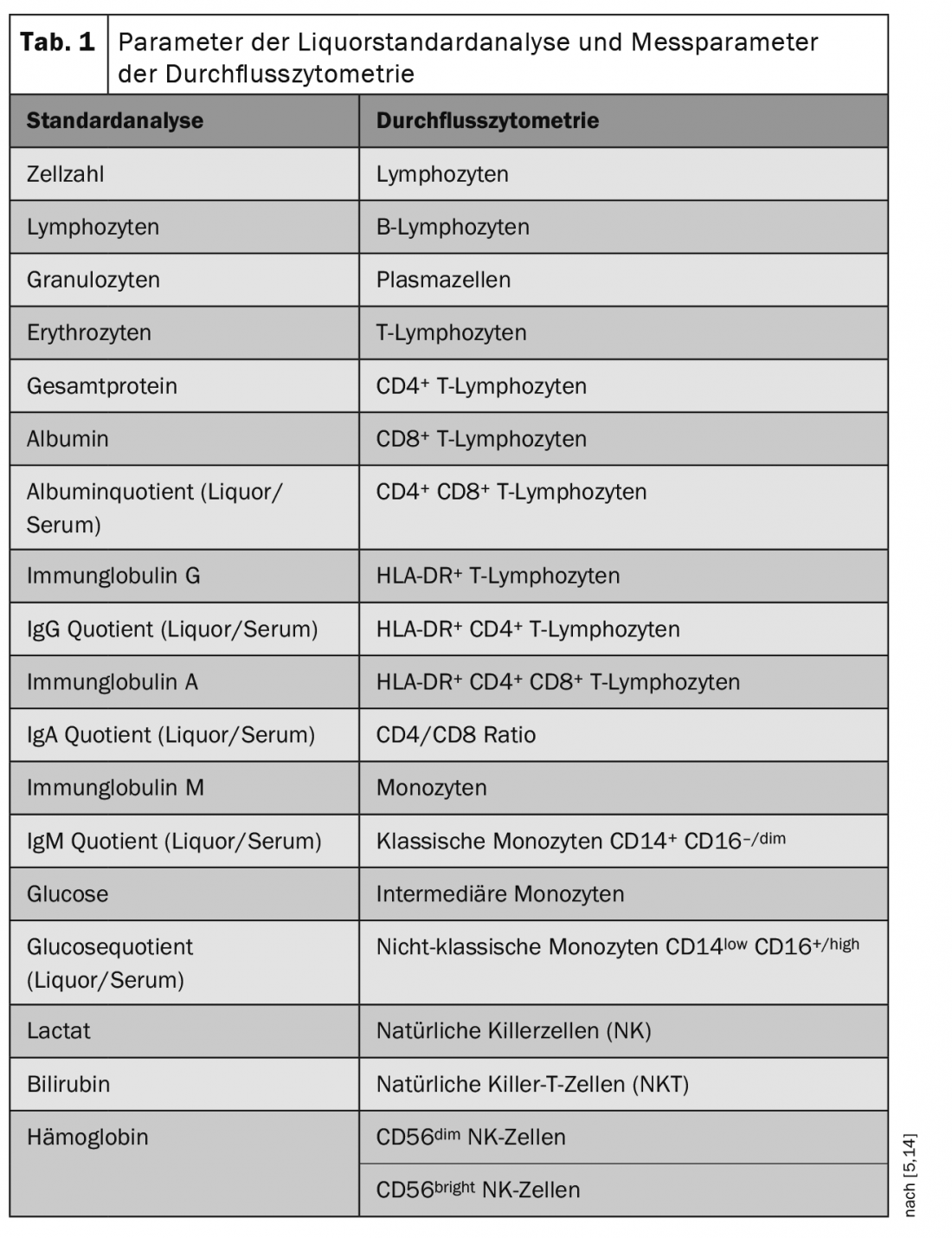
No laboratório do CSF do Departamento de Neurologia com o Instituto de Neurologia Translacional do Hospital Universitário de Münster, foram realizados nos últimos anos exames citométricos de fluxo muito extensos a partir de sangue e, em particular, também de amostras de alta qualidade de LCR de pacientes com várias doenças neurológicas. Todos os anos, cerca de mil amostras de QCA foram analisadas utilizando citometria de fluxo normalizada e os conjuntos de dados foram recolhidos num biobanco. Estes dados atingiram assim uma escala sem precedentes e estão disponíveis para numerosas redes de investigação tanto a nível nacional como internacional.
No primeiro trabalho científico resultante, as células imunitárias foram comparadas no líquido cefalorraquidiano e no sangue de doentes com doenças auto-imunes do sistema nervoso central e periférico [5,9]. A análise citométrica de fluxo também tem sido utilizada em doentes com doenças neurodegenerativas como a demência de Alzheimer e a demência frontotemporal [7,10]. Em cooperação com o Departamento de Psiquiatria do Hospital Universitário de Münster, os leucócitos de amostras de sangue e líquido cefalorraquidiano de doentes com perturbações psicóticas primárias foram examinados e comparados com os perfis imunológicos de doenças neurológicas.
A base de dados do Departamento de Neurologia com o Instituto de Neurologia Translacional do Hospital Universitário de Münster continuará a ser expandida com novos conjuntos de dados no futuro e servirá como fonte de informação para análises mais profundas e diagnósticos diferenciais especificados de várias doenças.
Neuropathies
As neuropatias – doenças do sistema nervoso periférico – são muito comuns e podem afectar as fibras nervosas motoras, sensoriais e autonómicas. Clinicamente, as neuropatias são diferenciadas em função do seu padrão de distribuição, curso clínico e génese. Dependendo da localização dos nervos afectados, é feita uma distinção entre mononeuropatias e polineuropatias (PNP). Existe um vasto espectro de causas possíveis de neuropatias, incluindo doenças metabólicas, tóxicas, hereditárias, infecciosas, auto-imunes, vasculíticas, paraproteémicas e malignas. A causa mais comum de polineuropatia no mundo ocidental é a diabetes mellitus, seguida da génese etilotóxica. Até 10% das neuropatias são causadas por processos auto-imunes e são, portanto, também referidas como neuropatias imunitárias [11].
O diagnóstico é baseado principalmente na anamnese, bem como no exame físico e neurológico. É dada especial atenção a infecções anteriores, por exemplo, gastroenterite e infecções do tracto respiratório superior, doenças pré-existentes e sintomas de outros sistemas orgânicos, por exemplo, sintomas autonómicos. O primeiro teste laboratorial é um teste de diagnóstico padrão. Com a ajuda do diagnóstico alargado de certos anticorpos gangliosídeos (GM1, GM2, GQ1b, etc.), o diagnóstico de uma neuropatia imunitária auto-imune mediada pode ser apoiado em caso de suspeita clínica. Parâmetros inflamatórios, imunoelectroforese, anticorpos reumáticos (ANA, AN-CA) ou anticorpos antineuronais (anti-Hu, anti-CV2/CRMP5, anti-amfisina, anti-Ma2) podem ser indicativos de doença sistémica ou maligna como causa de polineuropatias inflamatórias. Para excluir infecções virais ou bacterianas, pode ser acrescentado um historial médico abrangente e um diagnóstico serológico de patogénios virais (EBV, CMV, HSV, VZV, FSME, HBV, VIH, poliomielite) ou bacterianos (Borrelia, Treponema pallidum). As medições electrofisiológicas podem detectar com maior precisão os padrões de distribuição e de danos e permitir a classificação em diferentes subtipos. A electromiografia pode ser utilizada para detectar outros padrões de danos miogénicos, tais como denervação, atrofia muscular e actividade espontânea. Técnicas de imagem como a sonografia e a ressonância magnética podem visualizar padrões de danos e ajudar no diagnóstico de exclusão de outras causas de neuropatias, por exemplo, tumores neuronais como os schwannomas.
Neuropatias imunes
As neuropatias imunes são particularmente relevantes porque podem ser tratadas se diagnosticadas precocemente e a terapia for iniciada adequadamente. Principalmente, as neuropatias imunitárias são divididas num tipo de curso agudo (≤four semanas), subagudo (quatro a oito) ou crónico (≥eight semanas). A polineuropatia inflamatória desmielinizante aguda (AIDP) é chamada síndrome de Guillain-Barré (GBS) e é a forma mais comum de neuropatias imunitárias agudas, enquanto a polineuropatia inflamatória desmielinizante crónica (CIDP) é o protótipo de neuropatias imunitárias crónicas. O diagnóstico diferencial de polineuropatias inflamatórias é ainda hoje um grande desafio. Para além das neuropatias auto-imunes, várias outras causas devem ser consideradas para o diagnóstico diferencial (Fig. 1).
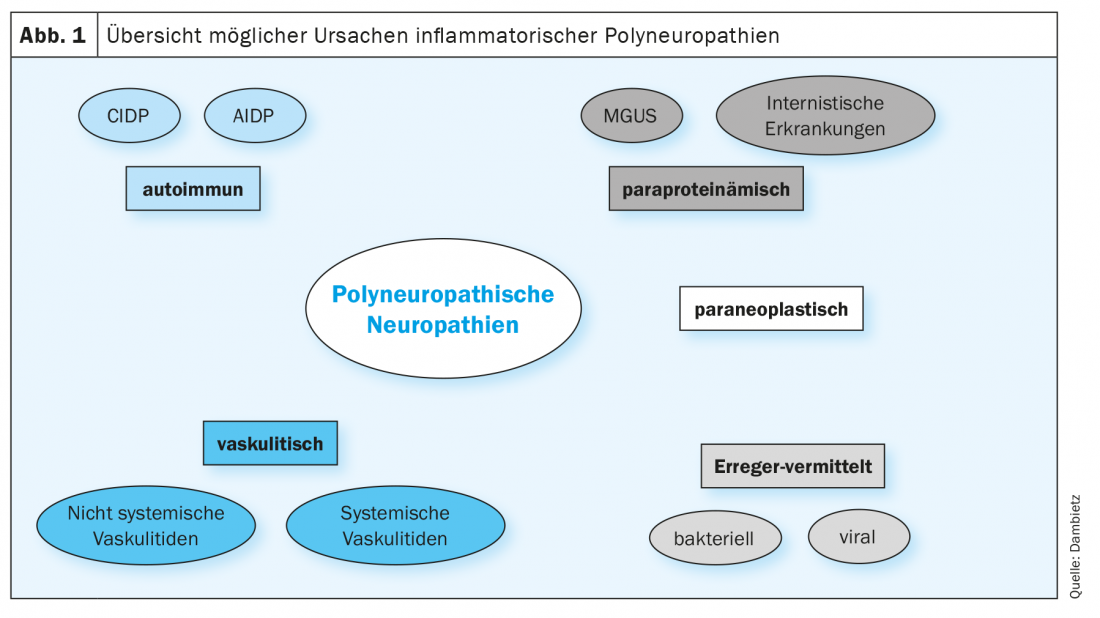
Diferenciação de neuropatias imunitárias utilizando perfis de células imunitárias
A classificação em neuropatias imunitárias agudas e crónicas é parcialmente artificial e existem muitas sobreposições e transições fluidas entre as duas formas. Assim, o CIDP mostra um início agudo do tipo GBS em até 10% dos casos. Em contrapartida, foi descrito um curso subagudo de mais de quatro semanas em casos inicialmente classificados como GBS [12]. Até agora, não existem parâmetros prognósticos que permitam a previsão de um curso agudo vs. crónico no momento da primeira manifestação clínica. Como as opções terapêuticas e a resposta a diferentes terapias imunomoduladoras diferem em GBS e CIDP, a diferenciação precoce das entidades é importante e pode ter um impacto positivo no curso e no prognóstico das doenças.
Nas medições padrão do LCR em neuropatias inflamatórias, pode ser detectada uma chamada “disseminação cialbuminosa” com aumento da proteína total no LCR com uma contagem normal de células e frequentemente uma desordem da barreira hemato-encefálica.
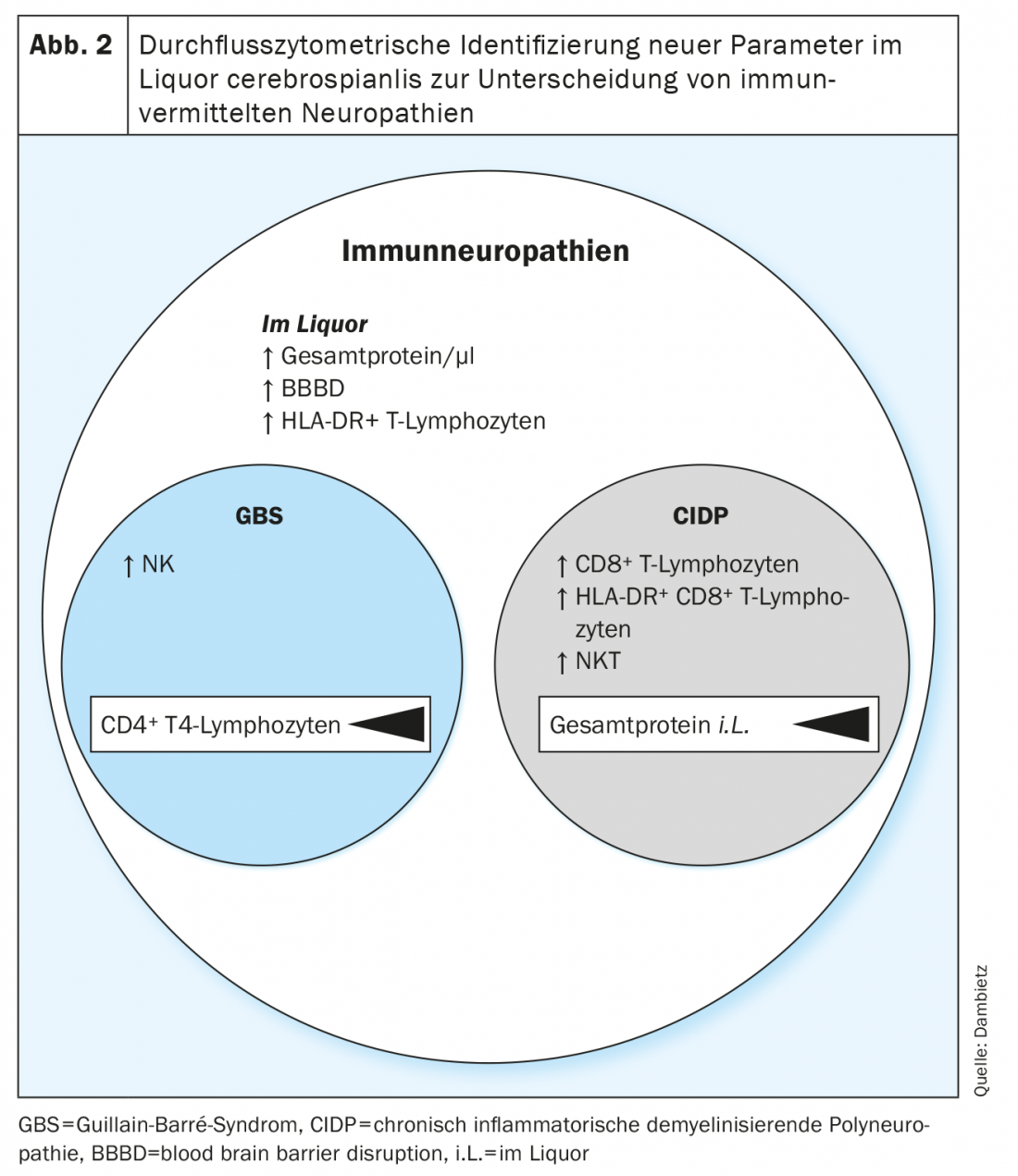
Agora, pela primeira vez, utilizando a citometria de fluxo, as composições de células imunitárias no LCR de doentes com GBS e CIDP foram analisadas e comparadas retrospectivamente [13]. Os perfis heterogéneos indicavam o envolvimento de diferentes populações celulares na fisiopatologia das neuropatias imunitárias agudas vs. crónicas.
Na citometria de fluxo, um número crescente de linfócitos T activados e não activados (HLA-DR+ vs. HLA-DR-) foram registados no LCR de doentes com neuropatias inflamatórias. No entanto, a activação das células T, bem como o aumento da proteína do LCR e a perturbação da barreira hemato-encefálica são parâmetros não específicos para as neuropatias e são apenas pouco adequados para distinguir entre GBS e CIDP, uma vez que uma activação de linfócitos T é frequentemente encontrada em formas agudas e crónicas de neuropatias e também pode ser detectada noutras doenças neurológicas. [14,15].
Mais especificamente, uma proporção crescente de células assassinas naturais (NK) foi detectada no LCR da síndrome de Guillain-Barré, enquanto que na polineuropatia inflamatória crónica desmielinizante o número de células assassinas naturais em T (NKT) e de células CD8 foi aumentado.+ Os linfócitos T foram aumentados (Fig. 2). Numa comparação directa da síndrome de Guillain-Barré e da polineuropatia inflamatória crónica desmielinizante, a detecção de células T assassinas naturais seguidas pelos monócitos clássicos e intermediários foi definida como o parâmetro com a maior confiança para diferenciar as duas entidades neuropáticas. A imunoprofilação com as diferentes proporções de células NK, NKT e CD8+ T revela padrões de células imunitárias específicas de doenças e subtipos no LCR e fornece uma indicação do envolvimento de diferentes tipos de células citotóxicas na fisiopatologia das neuropatias imunitárias agudas vs. crónicas. Além disso, com a ajuda dos perfis celulares individuais, uma avaliação prospectiva entre curso agudo e crónico poderia ser feita no momento da primeira manifestação clínica, facilitando assim a escolha da terapia.
O tratamento de escolha para a síndrome de Guillain-Barré é a plasmaférese. Além disso, as imunoglobulinas intravenosas estão também disponíveis como uma opção terapêutica equivalente. Actualmente, devido a uma deficiência omnipresente de imunoglobulina, estas são normalmente utilizadas apenas secundariamente na prática clínica diária e são aplicadas em particular para a escalada terapêutica após a plasmaférese com uma melhoria insuficiente dos sintomas clínicos. Enquanto os corticosteróides não mostraram qualquer efeito no GBS [16], foi demonstrada uma boa eficácia na polineuropatia crónica desmielinizante inflamatória, razão pela qual são utilizados como padrão no tratamento do CIDP [17–19].
Os pacientes com GBS e CIDP terapeuticamente ingénuos não mostraram diferenças significativas nos seus perfis de células imunes líquor-químicas em comparação com os pacientes que já recebem terapia. Em última análise, isto significa que a diferenciação citométrica de fluxo das neuropatias inflamatórias também pode ter lugar durante a terapia e os perfis de células imunitárias específicos do subtipo no LCR não são distorcidos pela utilização de imunoglobulinas ou corticosteróides, por exemplo.
Para realçar a relevância clínica das composições de células imunitárias específicas do subtipo, foram detectados parâmetros que reflectem a manifestação clínica das neruopatias. A gravidade das doenças foi baseada na pontuação de incapacidade de Hughes e na Escala de Rankin modificada (mRS). Na síndrome de Guillain-Barré, houve uma correlação entre o número de linfócitos CD4+ T e monócitos não clássicos e a gravidade clínica da doença. No CIDP, o nível de proteína total no LCR correlacionou-se com a gravidade da doença. A citometria de fluxo do LCR estabeleceu uma nova abordagem de diagnóstico para identificar alterações específicas de doenças e subtipos em neuropatias inflamatórias auto-imunes, facilitando a diferenciação do CIDP do GBS. No futuro, esta poderia ser a base para a avaliação do prognóstico e o desenvolvimento de novas terapêuticas, e a análise celular imunológica poderia ser alargada a outras variantes neuropáticas.
Imunofenótipos no espectro das doenças neurológicas
Com base no aumento da informação através da utilização da citometria de fluxo em diferentes compartimentos (sangue e LCR), a recolha de dados foi alargada a um espectro mais vasto de doenças neurológicas. Num estudo transversal retrospectivo, as composições celulares imunitárias foram investigadas em doentes com doenças auto-imunes, neurodegenerativas e vasculares. Tal como com as neuropatias imunitárias, as doenças auto-imunes do sistema nervoso central representam um grupo heterogéneo de patologias neuroinflamatórias que ainda hoje requerem uma classificação mais específica e um diagnóstico diferencial mais preciso e cujos patomecanismos subjacentes ainda não foram totalmente decifrados.
Os parâmetros individuais foram detectados por citometria de fluxo e as características que melhor diferenciam as doenças neuroinflamatórias das patologias neurodegenerativas e vasculares foram extraídas utilizando análises multidimensionais [5].
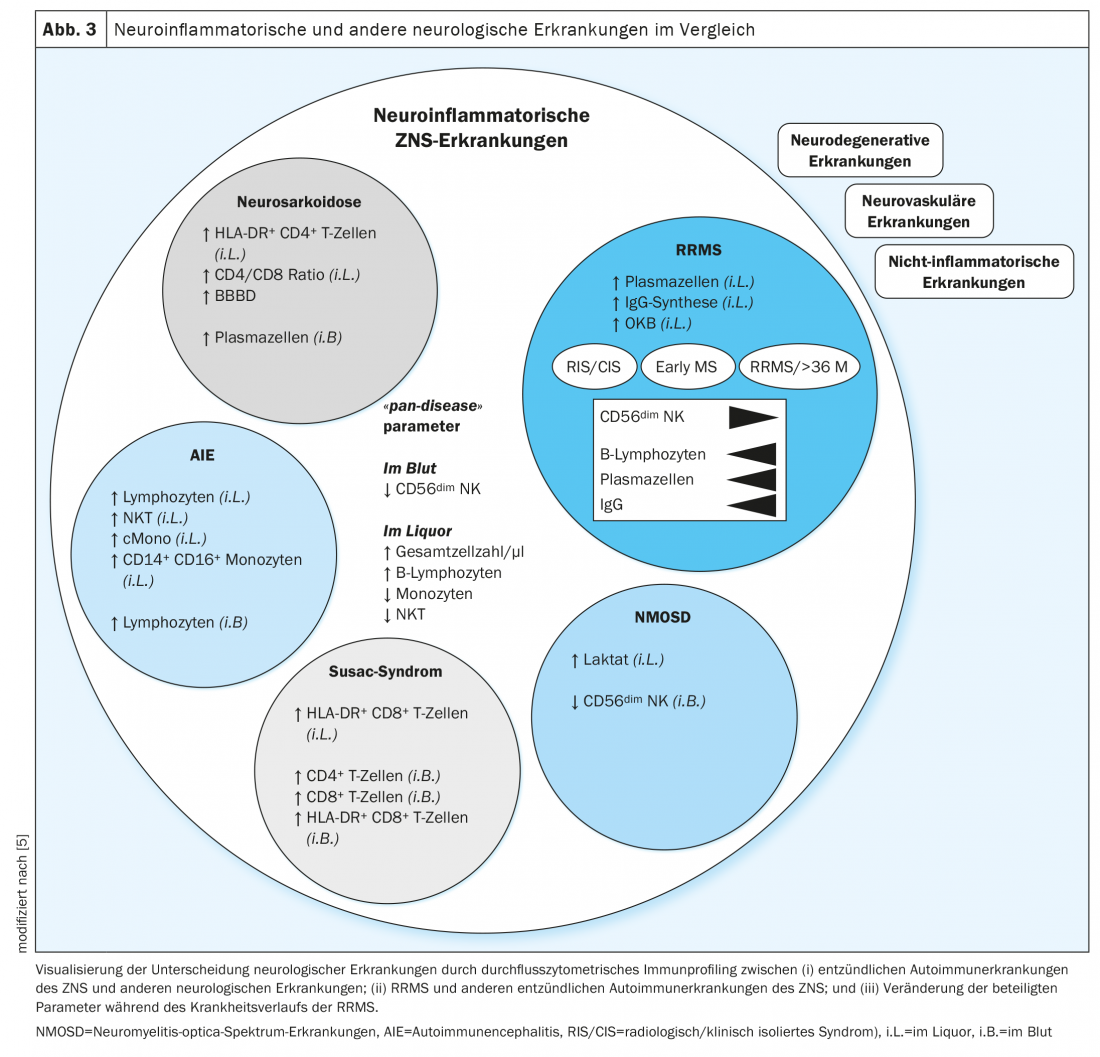
Os perfis celulares imunitários das doenças neuroinflamatórias auto-imunes mostraram semelhanças entre si e diferenças em relação às doenças neurodegenerativas, vasculares e não-inflamatórias (Fig. 3). Nos perfis celulares imunitários de todas as doenças neuroinflamatórias, a contagem de células e a proporção de linfócitos B no LCR foi aumentada, enquanto os monócitos, as células naturais assassinas e as células T assassinas naturais foram reduzidas. Além disso, verificou-se que um número reduzido de células CD56dim NK no sangue era indicativo da presença de uma doença inflamatória do SNC. Estas características foram definidas como parâmetros “pan-disease” para patologias auto-imunes do sistema nervoso central e assim indicavam alterações através de doenças (Fig. 3) . Na esclerose múltipla, o aumento do número de células do QCA e uma expansão significativa das células da linhagem de células B são conhecidos há muitos anos [20,21]. Curiosamente, estes parâmetros eram modificáveis por imunoterapias e poderiam ser utilizados no futuro como biomarcadores para responder a terapias imunomoduladoras e melhorar a avaliação prognóstica e a gestão da terapia.
Composições celulares imunitárias em doenças neuroinflamatórias auto-imunes
As assinaturas de células imunitárias específicas de doenças no LCR também foram estudadas em várias outras doenças neurológicas.
Num estudo retroperspectivo, as composições celulares imunitárias foram comparadas em esclerose múltipla recorrente (RRMS) e neurosarcoidose. A sarcoidose é uma doença auto-imune multisistémica que se manifesta com granulomas epitelioides em vários órgãos, onde provoca reacções inflamatórias locais através da infiltração de macrófagos [22]. Em cerca de 25% dos doentes, o sistema nervoso central é também afectado [23]. Isto manifesta-se frequentemente com sintomas neurológicos que podem ser semelhantes aos de uma recaída de EM. O diagnóstico de sarcoidose inclui uma análise ao sangue com determinação de parâmetros inflamatórios, imunoglobulina G, ACE, receptor IL-2 solúvel (sIL-2R) e neopterina, bem como um teste de função pulmonar, broncoscopia com lavagem broncoalveolar e biopsia transbrônquica, uma radiografia do tórax e, dependendo da manifestação clínica, outras imagens e exames interdisciplinares [24,25]. No que respeita à diferenciação de outras doenças inflamatórias, os parâmetros químicos laboratoriais (ACE, sIL-2R) provaram ser não específicos e insuficientemente sensíveis [26,27]. A distinção entre neurosarcoidose e esclerose múltipla também nem sempre é clara na imagem, uma vez que as lesões da EM (lesões da matéria branca) e as alterações granulomatosas na neurosarcoidose se assemelham frequentemente na imagem por ressonância magnética [28]. A análise padrão “simples” do QCA também mostra desvios semelhantes, tais como uma ligeira pleocitose [29]. O diagnóstico final da neurosarcoidose só pode, por vezes, ser feito por biopsia a partir de lesões granulomaisuspectadas no sistema nervoso central [30]. No entanto, tal biópsia é um procedimento invasivo e arriscado e só deve ser realizada após uma cuidadosa avaliação de risco-benefício. Para evitar uma medida tão invasiva, é essencial o estabelecimento de novas ferramentas de diagnóstico. A citometria de fluxo do LCR e sangue de doentes com neurosarcoidose e esclerose múltipla foi avaliada retrospectivamente sob este aspecto.
Na citometria de fluxo, a neurosarcoidose foi surpreendentemente bem distinguida da esclerose múltipla por uma maior proporção de plasmócitos, monócitos intermédios e não clássicos no sangue, enquanto o número de linfócitos T no sangue foi reduzido na neurosarcoidose. O LCR mostrou parâmetros parcialmente sobrepostos em ambas as doenças, pelo que a proporção de linfócitos T CD4 positivos foi especificamente aumentada na neuroarcoidose. A diferenciação das duas doenças foi optimizada pela integração multidimensional das composições celulares imunológicas do LCR e do sangue (Fig. 3). A predominância de linfócitos T CD4 positivos activados e uma relação CD4/CD8 aumentada no LCR, bem como um aumento da proporção de plasmócitos no sangue, foram definidos como características da neurosarcoidose [14]. A detecção de plasmócitos no líquido cefalorraquidiano, bem como a síntese intratecal de IgG e bandas oligoclonais foi pioneira para a esclerose múltipla.
As composições celulares imunitárias individuais no LCR permitem assim uma melhor diferenciação entre estas duas doenças inflamatórias do sistema nervoso central e podem permitir dispensar confirmações de diagnóstico bióptico na prática clínica diária e simplificar a escolha da terapia (imunossupressores clássicos vs. terapias de MS-moduladores).
Além disso, o foco foi colocado na diferenciação de doenças auto-imunes distintas do sistema nervoso central e os perfis das células imunitárias foram comparados em esclerose múltipla, neuromielite óptica (NMOSD), encefalite auto-imune (AIE) e síndrome de Susac. NMOSD caracteriza-se por neurite óptica recorrente e mielite com lesões inflamatórias de longa duração [31]. A encefalite auto-imune pode manifestar-se clinicamente com dores de cabeça, febre, vigilância reduzida, crises epilépticas, mas também com défices cognitivos. Na encefalite receptora NMDA (NMDARE), ocorrem frequentemente défices cognitivos, perturbações mnésticas e sintomas psicóticos [32, 33]. A síndrome de Susac é uma endotelipatia mediada por células CD8+ T dos pequenos vasos sanguíneos do SNC e é clinicamente caracterizada por uma tríade de encefalopatia, perda auditiva e visual [34,35].
Enquanto estas doenças mostram alterações semelhantes entre si nas análises padrão do LCR [36], a citometria de fluxo revelou alterações subtipo específicas na composição das células imunitárias.
Para além da síntese de IgG intratecal anteriormente conhecida, a síntese de IgA e IgM intratecal também foram identificadas como características do RRMS. Nas doenças de neuromielite do espectro óptico, um número reduzido de células CD56bright NK no sangue e um aumento da concentração de lactato no líquido cefalorraquidiano eram particularmente evidentes. A síndrome de Susac foi caracterizada pela detecção de linfócitos CD4+ e CD8+ T no sangue e por um aumento da proporção de linfócitos CD8+ T activados (HLA-DR+) no líquido cefalorraquidiano e no sangue. Característica da encefalite auto-imune foi a detecção de aumento da contagem de linfócitos no LCR e no sangue, bem como um aumento do número de células T naturais, monócitos clássicos e monócitos CD14+ CD16+ no LCR.
Com a ajuda da análise citométrica de células imunitárias de fluxo a partir do líquido cefalorraquidiano, o RRMS pode assim ser diferenciado das outras entidades com um elevado grau de confiança. Numa análise multidimensional, os plasmócitos no LCR e na síntese intratecal de IgG foram definidos como os melhores parâmetros para diferenciar o RRMS de outras doenças auto-imunes do SNC.
Os perfis celulares imunitários dos doentes com esclerose múltipla recorrente em diferentes fases da doença foram examinados com mais detalhe. Independentemente da fase da doença, os parâmetros ‘pan-doença’ foram alterados na mesma medida. Em contraste, com a progressão da doença, houve uma redução adicional em CD56dim Células NK no sangue e um aumento de linfócitos intratecais B, células plasmáticas e síntese de IgG intratecais. (Fig. 3). Com a ajuda de parâmetros específicos de células imunitárias que se correlacionam com a gravidade e progressão da doença, novos marcadores poderiam ser definidos através de monitorização contínua que facilitam a avaliação da actividade da doença e permitem a modulação da terapia precoce para influenciar positivamente o curso da doença. Dados adicionais de estudos longitudinais ao longo de várias décadas poderiam identificar parâmetros que facilitem a detecção da transição de EM recorrente-remitente para EM progressiva secundária. Por conseguinte, são ainda necessários estudos confirmatórios prospectivos.
A análise precisa dos perfis de células imunitárias variáveis em diferentes entidades da doença deverá ajudar a novos conhecimentos sobre patomecanismos comuns e distintos em doenças individuais no futuro, mas a identificação de outros parâmetros discriminatórios requer coortes maiores, especialmente de doentes com doenças raras como a NMOSD ou a síndrome de Susac. No futuro, a citometria de fluxo não se limitará ao campo da neurologia, mas será alargada a outras disciplinas médicas.
Análises de células imunes no campo interdisciplinar
Numerosas doenças neuroinflamatórias podem também manifestar-se com sintomas psiquiátricos, por exemplo, encefalites auto-imunes, como a encefalite receptora de NMDA (NMDARE). Os erros de diagnóstico que classificam a AIE como uma perturbação primária do grupo de perturbações psiquiátricas ocorrem uma e outra vez. As consequências resultantes podem ser graves. Mesmo actualmente, o diagnóstico diferencial entre doenças auto-imunes psiquiátricas e neuroinflamatórias é um desafio na rotina clínica da neurologia e psiquiatria. Além disso, o espectro das perturbações psiquiátricas inclui também numerosas entidades cuja patogénese ainda não é totalmente compreendida [37]. Nos últimos anos, foram também discutidos mecanismos imunológicos e auto-imunes, que podem também contribuir para o desenvolvimento de doenças psiquiátricas [38–41]. Por esta razão, analisámos dados citométricos de fluxo no contexto de perturbações psiquiátricas. No diagnóstico de doenças psiquiátricas, a análise do líquido cefalorraquidiano tem sido utilizada até agora principalmente para excluir doenças orgânicas.
Num estudo retrospectivo, foram recolhidos dados sobre a composição das células imunitárias em doenças do espectro primário da psicose (incluindo esquizofrenia, distúrbios delirantes, distúrbios psicóticos agudos e transitórios e distúrbios esquizoafectivos) e comparados com as assinaturas de células imunitárias de doenças neuroinflamatórias, em particular NMDARE – um subtipo comum de AIE.
Com a ajuda da citometria de fluxo, foram detectados parâmetros e foram criadas pontuações multidimensionais, que não só servem o diagnóstico de exclusão, mas também apoiam e facilitam o diagnóstico de perturbações psicóticas primárias. Além disso, a composição de células imunitárias específicas fornece provas do envolvimento de certas subpopulações na génese e nos mecanismos patológicos das doenças psiquiátricas. Pesquisas anteriores mostraram evidências de aumento da contagem de leucócitos no sangue de doentes com perturbações psicóticas [42]. As análises padrão do LCR mostraram um aumento da proteína do LCR em psicoses primárias e frequentemente a presença de uma desordem da barreira hemato-encefálica. No entanto, não existem parâmetros laboratoriais e liquorquímicos específicos e não tem sido possível até agora uma diferenciação fiável de doenças neurológicas através de testes padrão de sangue e licor.
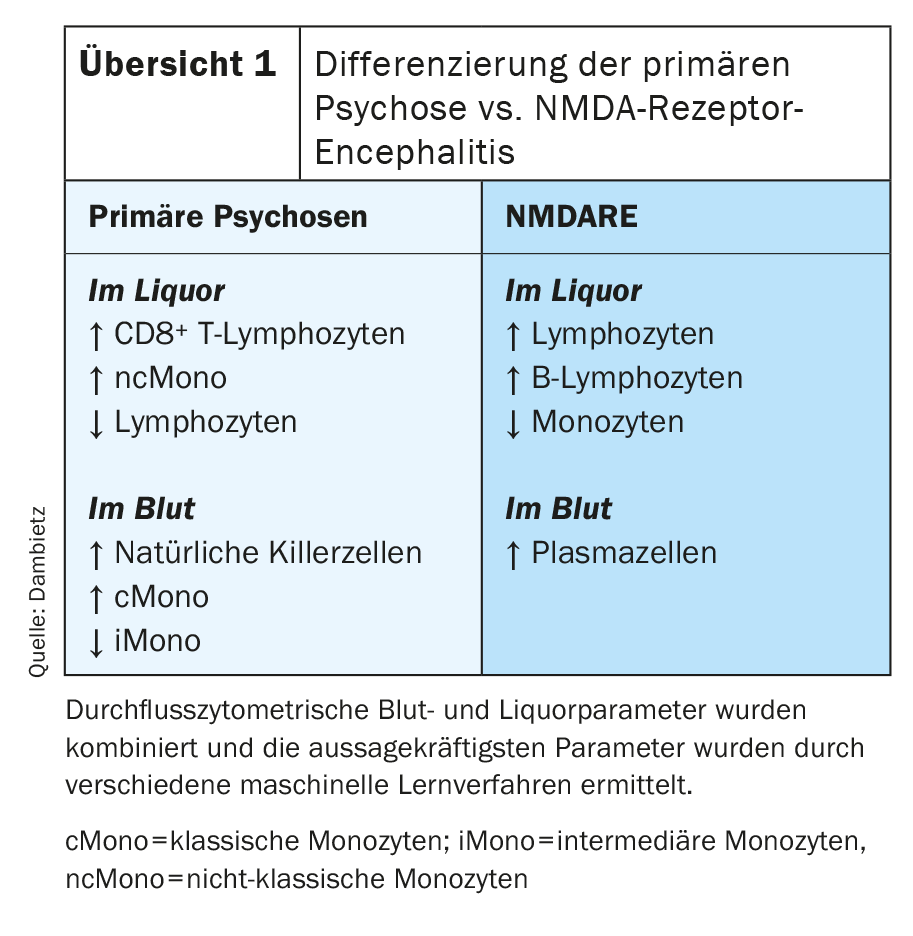
A citometria de fluxo mostrou alterações específicas do compartimento no LCR e no sangue em doentes com psicoses primárias [43]. A composição específica das células imunitárias no LCR em perturbações psicóticas primárias caracterizou-se por um aumento dos linfócitos T positivos CD8 e monócitos, especialmente monócitos não clássicos. Por outro lado, o número de linfócitos no líquido cefalorraquidiano foi reduzido (visão geral 1) . O sangue mostrou um número crescente de células assassinas naturais e monócitos. Especificamente, o número de monócitos clássicos foi aumentado, enquanto que a proporção de monócitos intermediários no sangue foi diminuída. A encefalite receptora NMDA (NMDARE) é frequentemente acompanhada por sintomas psicóticos e pode ser difícil de distinguir clinicamente das psicoses primárias. Apesar da possibilidade de determinar os anticorpos receptores específicos anti-NMDA, são possíveis diagnósticos incorrectos, uma vez que também existem variantes de encefalite auto-imune anti-corpos-negativa [44]. Por esta razão, as duas doenças foram comparadas em particular. O perfil citométrico de células imunitárias de fluxo mostrou que o NMADRE pode ser bem diferenciado das perturbações psicóticas primárias por uma maior proporção de linfócitos, células B e monócitos no LCR e a detecção de plasmócitos no sangue (Resumo 1). Além disso, a citometria de fluxo detectou um aumento da proporção de células assassinas naturais no sangue de doentes com sintomas psicóticos positivos.
As perturbações psicóticas primárias são um grupo heterogéneo cuja complexa fisiopatologia ainda não é compreendida e inexplorada em muitos aspectos em pormenor. A investigação anterior indica desregulação do sistema imunitário e componentes inflamatórios no sistema nervoso central em doentes com perturbações psicóticas primárias. Os resultados citrométricos de fluxo mostram alterações na composição das células imunitárias no líquido cefalorraquidiano e sugerem que os mecanismos imunológicos, especialmente a imunidade inata, juntamente com uma função de barreira perturbada da barreira hemato-encefálica contribuem para o desenvolvimento de perturbações psicóticas primárias. A citometria de fluxo identificou alterações típicas da composição das células imunitárias no LCR e no sangue, que estão na base do diagnóstico de psicose primária e apoiam a hipótese imunológica de psicose primária.
Resumo
Com a ajuda da citometria de fluxo do líquido cefalorraquidiano, foi estabelecida a possibilidade de novas análises de células imunitárias específicas de doenças e subtipos. Os exames citométricos de fluxo do LCR permitiram uma classificação específica das doenças neuroinflamatórias do sistema nervoso central e periférico. As composições celulares imunitárias no QCA de pacientes com GBS vs. CIDP podem distinguir as duas entidades com maior confiança. Além disso, pode ser feita uma avaliação precoce do curso da doença (aguda-monofásica vs. crónica-recorrente) no momento do diagnóstico inicial de neuropatia inflamatória.
Além disso, as doenças inflamatórias auto-imunes do sistema nervoso central mostram alterações individuais nas subpopulações celulares no sangue, bem como no líquido cefalorraquidiano. Estas variações específicas da doença deverão melhorar a classificação em entidades individuais no futuro e, assim, facilitar o diagnóstico diferencial. Especialmente no caso de resultados pouco claros noutros exames, por exemplo, em imagens ou no caso de alterações químicas laboratoriais não específicas, a análise citométrica de fluxo do líquido cefalorraquidiano pode ser pioneira. Por exemplo, ao detectar lesões não específicas em ressonância magnética, por exemplo, lesões isquémicas vs. lesões de matéria branca (em EM, NMOSD ou síndrome de Susac), ou granulomas no sistema nervoso central vs. lesões de EM, o diagnóstico pode ser suplementado com análise de células imunitárias.
Além disso, um diagnóstico precoce pode preparar o caminho para decisões terapêuticas, tais como o uso de medicamentos imunomoduladores, e a influência sobre o curso da doença pode ser optimizada através de uma escolha determinada de terapia. O objectivo das análises citométricas de fluxo futuro do LCR poderia ser a detecção de variáveis celulares imunes que reflictam os efeitos terapêuticos e permitam uma melhor avaliação da progressão da doença.
Além disso, o reconhecimento de assinaturas de células imunitárias específicas de doenças aponta o caminho para o envolvimento de certas populações celulares no desenvolvimento de doenças neurológicas e em mecanismos auto-imunes no sistema nervoso central e periférico. Constitui assim a base para análises mais profundas dos processos fisiopatológicos.
Em resumo, a citometria de fluxo do LCR representa uma nova opção de diagnóstico para a análise de perfis específicos de células imunitárias. A citometria de fluxo de pacientes com neuropatias imunológicas, doenças neuroinflamatórias auto-imunes do SNC ou distúrbios psicóticos mostrou alterações imuno-celulares específicas da doença em compartimentos periféricos e intratecais, sugerindo o envolvimento do sistema imunitário inato e mecanismos imunológicos na etiologia das doenças. Em particular, foi demonstrado que não só os componentes celulares no sangue mas também as células imunitárias específicas no LCR desempenham um papel decisivo na fisiopatologia das doenças neurológicas.
Com a criação de uma base de dados única de dados citométricos de fluxo de amostras de fluidos cefalorraquidianos de alta qualidade, foi criada a base para projectos de investigação mais aprofundados no Departamento de Neurologia do Hospital Universitário de Münster.
Identificando parâmetros singulares e estabelecendo pontuações multifactoriais, poderão ser gerados no futuro perfis de células imunitárias específicos de doenças e subclasses, que poderão ser utilizados como novos instrumentos de diagnóstico na prática clínica diária e revolucionar o diagnóstico, bem como a terapia de neuropatias imunitárias e outras doenças.
Mensagens Take-Home
- A citometria de fluxo de células do líquido cefalorraquidiano permite a identificação de perfis de células imunitárias específicas de doenças.
- Determinadas populações de leucócitos foram identificadas como marcadores de doenças individuais e podem estar envolvidas nos patomecanismos individuais, por exemplo células T assassinas naturais para diferenciar as neuropatias imunitárias agudas das crónicas. Os monócitos no líquido cefalorraquidiano poderiam distinguir a psicose primária da encefalite receptora de NDMA.
- As análises celulares prospectivas do LCR poderiam melhorar a selecção e o acompanhamento das terapias na prática clínica diária.
- A citometria de fluxo das células do LCR pode melhorar o diagnóstico de doenças com manifestações clínicas não específicas e sintomas sobrepostos, facilitando assim as decisões de tratamento.
Literatura:
- Iliff JJ, et al: Uma via paravascular facilita o fluxo do LCR através do parênquima cerebral e a eliminação de solutos intersticiais, incluindo a beta amilóide. Sci Transl Med 2012; 4(147): 147ra111.
- Schlager C, et al.: Tráfico de células T de efeito entre as leptomeninges e o líquido cefalorraquidiano. Natureza 2016; 530(7590): 349-353.
- Engelhardt B, Vajkoczy P, Weller RO: Os movedores e formadores em privilégio imunitário do SNC. Nat Immunol 2017; 18(2): 123-131.
- Louveau A, et al.: Características estruturais e funcionais dos vasos linfáticos do sistema nervoso central. Natureza 2015; 523(7560): 337-341.
- Gross CC, et al.: Classificação de doenças neurológicas utilizando análise multi-dimensional do QCA. Brain, 2021. 144(9): 2625-2634.
- Han S, et al: Imunofenotipagem exaustiva de células do líquido cefalorraquidiano em doentes com doenças neuroimunológicas. J Immunol 2014; 192(6): 2551-2563.
- Pawlowski M, et al.: Relevância dos níveis elevados de monócitos de fluido cerebrospinal em doentes com demência frontotemporal. Envelhecimento do Neurobiol 2018; 62: 45-52.
- Alvermann S, et al.: Immunophenotyping of cerebrospinal fluid cells in multiple sclerosis: in search of biomarkers. JAMA Neurol 2014; 71(7): 905-912.
- Gross CC, et al: A regulação da actividade das células T em esclerose múltipla mediada por NK é reconstituída pela modulação do receptor IL-2. Proc Natl Acad Sci USA 2016; 113(21): E2973-2982.
- Lueg G, et al.: Relevância clínica da activação específica de células T no sangue e líquido cefalorraquidiano de doentes com doença de Alzheimer ligeira. Envelhecimento do Neurobiol 2015; 36(1): 81-89.
- Wiendl HK, Kieseier B, Meuth S: Perguntas e respostas sobre neuroimunologia 2015: 191-215.
- van Doorn PA: Diagnóstico, tratamento e prognóstico da síndrome de Guillain-Barre (GBS). Imprensa Med 2013; 42(6 Pt 2): e193-201.
- Heming M, et al: Immune Cell Profiling of the Cerebrospinal Fluid Provides Pathogenetic Insights Into Inflammatory Neuropathies. Immunol frontal 2019; 10: 515.
- Heming M, et al: Os perfis de leucócitos no sangue e no LCR distinguem a neurosarcoidose da esclerose múltipla. J Neuroimmunol 2020; 341: 577171.
- Li S, et al: IL-17 e IL-22 em fluido cerebrospinal e plasma são elevados na síndrome de Guillain-Barré. Mediadores Inflamm 2012; 2012: 260473.
- Ensaio duplo-cego de metilprednisolona intravenosa na síndrome de Guillain-Barré. Guillain-Barre Syndrome de Steroid Trial GrouLancet, 1993. 341(8845): 586-590.
- Kieseier BC, et al: Neuropatias imunizadas. Nat Rev Dis Primers 2018; 4(1): 31.
- Nobile-Orazio E, Gallia F: Actualização sobre o tratamento da poliradiculoneuropatia desmielinizante crónica inflamatória. Curr Opinião Neurol 2015; 28(5): 480-485.
- Nobile-Orazio E, et al: Imunoglobulina intravenosa versus metilprednisolona intravenosa para poliradiculoneuropatia desmielinizante crónica: um ensaio controlado aleatório. Lancet Neurol 2012; 11(6): 493-502.
- Kraus J, et al: Linfócitos CD45RA+ ICAM-3+ em líquido cefalorraquidiano e sangue como marcadores da actividade da doença em doentes com esclerose múltipla. Acta Neurol Scand 2000; 102(5): 326-332.
- Cepok S, et al: Padrões de patologia do líquido cerebrospinal correlacionam-se com a progressão da doença na esclerose múltipla. Cérebro 2001; 124(Pt 11): 2169-2176.
- Chen ES, Moller DR: Sarcoidose – progresso científico e desafios clínicos. Nat Rev Rheumatol 2011; 7(8): 457-467.
- Iannuzzi MC, Rybicki BA, Teirstein AS: Sarcoidose. N Engl J Med 2007; 357(21): 2153-2165.
- Bradshaw MJ, et al: Neurosarcoidose: Patofisiologia, Diagnóstico, e Tratamento. Neurol Neuroimmunol Neuroinflamm, 2021. 8(6).
- Seve P, et al: Sarcoidose: A Clinical Overview from Symptoms to Diagnosis, Cells 2021; 10(4).
- Bharwani KD, et al: Elevated Plasma Levels of sIL-2R in Complex Regional Pain Syndrome: A Pathogenic Role for T-Lymphocytes? Mediadores Inflamm 2017: 2764261.
- Cai B, et al.: Micro-inflamação caracterizada por perturbações do equilíbrio Treg/Teff com aumento do sIL-2R em doentes com diabetes tipo 2. Exp Clin Endocrinol Diabetes 2013; 121(4): 214-219.
- Spencer TS, et al: Manifestações de imagem de ressonância clínica e magnética de neurosarcoidose. Semin Arthritis Rheum 2005; 34(4): 649-661.
- Pawate S, Moses H, Sriram S: Apresentações e resultados da neurosarcoidose: um estudo de 54 casos. QJM 2009; 102(7): 449-460.
- Wegener S, et al: Neurosarcoidose clinicamente isolada: uma via de diagnóstico recomendada. Eur Neurol 2015; 73(1-2): 71-77.
- Jarius S, Wildemann B, Paul F: Neuromyelitis optica: características clínicas, imunopatogenia e tratamento. Clin Exp Immunol 2014; 176(2): 149-164.
- Dalmau J, Graus F: Encefalite mediada por anticorpos. N Engl J Med 2018; 378(9): 840-851.
- Dalmau J, et al: Uma actualização sobre a encefalite receptora anti-NMDA para neurologistas e psiquiatras: mecanismos e modelos. Lancet Neurol 2019; 18(11): 1045-1057.
- Vishnevskia-Dai V, et al: Síndrome de Susac: características clínicas, classificação clínica, e prognóstico a longo prazo. Medicina (Baltimore), 2016; 95(43): e5223.
- Gross CC, et al: CD8(+) A endoteliopatia mediada por células T é um mecanismo de neuro-inflamação de grande amplitude na síndrome de Susac. Nat Commun 2019; 10(1): 5779.
- Toledano M, Weinshenker BG, Solomon AJ: A Clinical Approach to the Differential Diagnosis of Multiple Sclerosis (Uma Abordagem Clínica ao Diagnóstico Diferencial da Esclerose Múltipla). Curr Neurol Neurosci Rep 2015; 15(8): 57.
- Fritz B: Sobre o diagnóstico serológico da esquizofrenia a partir do líquido cefalorraquidiano de acordo com o método de Lehmann-Facius. 1939/12. 165: 462-467.
- van Kesteren CF, et al: Envolvimento imunitário na patogénese da esquizofrenia: uma meta-análise em estudos pós-morte do cérebro. Transl Psychiatry 2017; 7(3): e1075.
- Mazza MG, et al: Relação neutrófilo-linfócitos, relação monócito-linfócitos e relação plaquetas-linfócitos em psicose não afectiva: Uma meta-análise e revisão sistemática. Mundo J Biol Psiquiatria 2020; 21(5): 326-338.
- Fernandez-Egea E, et al: Peripheral Immune Cell Populations Associated with Cognitive Deficits and Negative Symptoms of Treatment-Resistant Schizophrenia. PLoS One 2016; 11(5): e0155631.
- Doorduin J, et al: Neuroinflammation in schizophrenia related psychosis: a PET study. J Nucl Med 2009; 50(11): 1801-1807.
- Steiner J, et al: Innate Immune Cells and C-Reactive Protein in Acute First-Episode Psychosis and Schizophrenia: Relationship to Psychopathology and Treatment. Schizophr Bull 2020; 46(2): 363-373.
- Rauber S, et al.: A citometria de fluxo de fluidos cerebrais distingue as perturbações do espectro da psicose dos diagnósticos diferenciais. Mol Psychiatry 2021; 26(12): 7661-7670.
- Dalmau J, et al: Anti-NMDA-receptor encephalitis: série de casos e análise dos efeitos dos anticorpos. Lancet Neurol 2008; 7(12): 1091-1098.
InFo NEUROLOGIA & PSYCHIATRY 2022; 20(3): 6-14