Hidradenite suppurativa (SH) tem uma etiopatogenia multifactorial e está associada a uma elevada deterioração da qualidade de vida. Descobertas empíricas de expressão crescente de citocinas inflamatórias sugerem uma génese imunológica desta doença cutânea inflamatória recorrente. A gama de tratamentos medicamentosos disponíveis até à data é limitada. Paralelamente à continuação da investigação sobre a base imunopatológica, várias substâncias activas estão a ser testadas em ensaios clínicos.
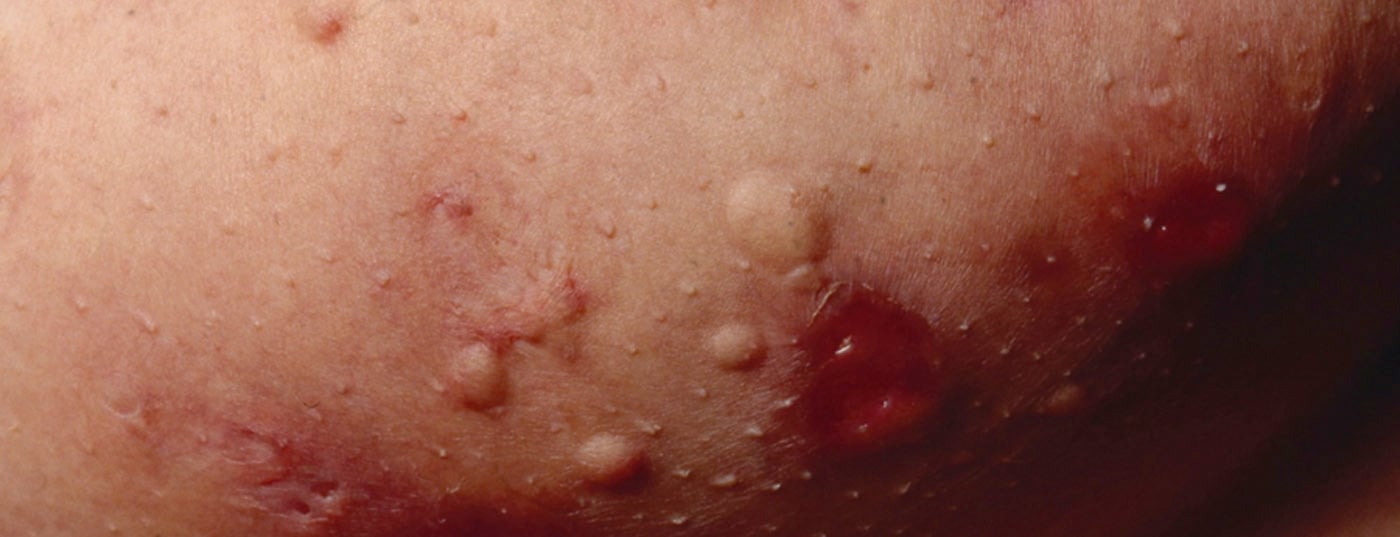
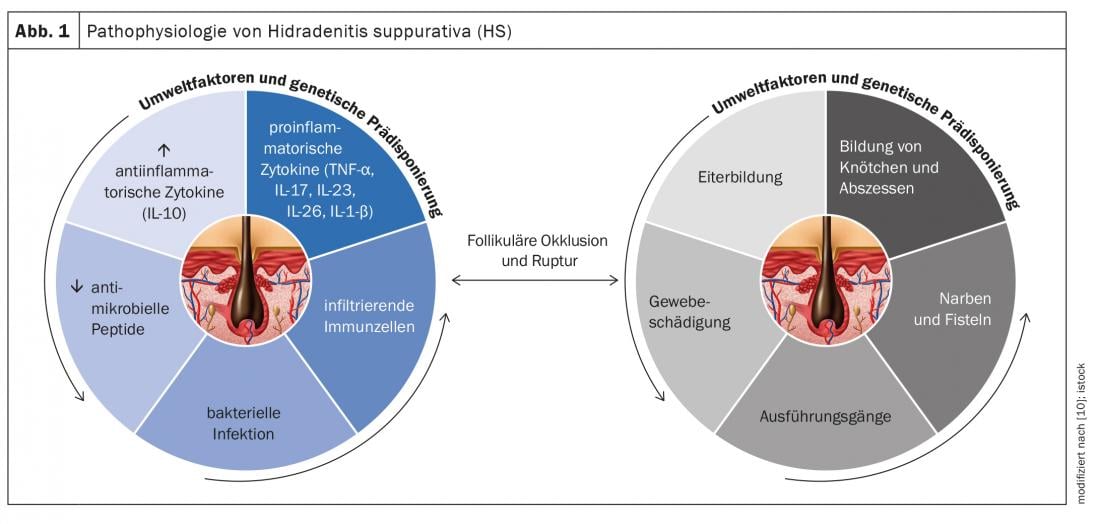
Hidradenite suppurativa (SH) – também chamada “acne inversa” – é uma doença inflamatória crónica dos folículos capilares que leva a fístulas crónicas, abcessos e cicatrizes nas regiões axilares, inguinais e perianais [1]. Assume-se uma patogénese multifactorial, embora ainda haja muitas questões em aberto [2]. De acordo com os conhecimentos actuais, a SH começa com a oclusão e dilatação do folículo capilar, o que leva à ruptura e a uma reacção inflamatória, resultando numa inflamação crónica com tractos de fístulas [3,4]. Numerosas citocinas estão envolvidas na reacção inflamatória multifactorial. Para além dos factores predisponentes genéticos, o tabagismo e a obesidade contribuem para o desenvolvimento da doença (Fig. 1) [11]. Consoante a manifestação clínica, distinguem-se diferentes graus de gravidade. Para além da classificação segundo Hurley [5], Zouboulis et al. Em 2017, foi publicado o International Hidradenitis Suppurativa Severity Score System (IHS4 score) – uma ferramenta validada que pode ser utilizada na prática clínica diária para avaliar a gravidade da SH(Tab. 1) [6,9].
Necessidade de mais opções de terapia medicamentosa
As opções de tratamento para a SH são limitadas. Existem diferentes abordagens para controlar a inflamação e reduzir a gravidade das manifestações. Os cremes e soluções anti-sépticos e antibióticos, bem como os antibióticos em comprimidos, podem reduzir os germes na pele e assim contribuir para uma melhoria na qualidade de vida do paciente. O adalimumab biológico (Humira®), um factor de necrose tumoral (TNF)-α bloqueador, foi aprovado na Suíça desde 2016 para o tratamento de HS de fase intermédia e avançada [7]. Além disso, são utilizadas várias terapias farmacológicas não rotuladas. Outras opções de tratamento incluem procedimentos médicos a laser e a excisão cirúrgica das fístulas com ou sem cobertura de defeitos plásticos.

Fisiopatologia da SH: resultados imunopatológicos num relance
A fim de expandir a gama de tratamentos medicinais, a investigação sobre a base fisiopatológica da SH tornou-se cada vez mais o foco da atenção científica nos últimos anos. O papel de várias citocinas pró-inflamatórias é analisado a nível molecular [2]. Seguem-se os resultados de uma análise secundária publicada no International Journal of Molecular Sciences em 2020 com uma integração de resultados imunopatológicos em doentes com SH [2]:
TNF-α e IFN-γ: Os níveis de TNF-α actualizados mostram uma correlação positiva com a gravidade da SH. TNF-α aumenta a proporção de Th17:Treg*, resultando numa produção excessiva de células Th17 e correspondentemente as citocinas IL-17 e IL-22. TNF-α induz a expressão das quimiocinas CXCL8, CXCL11, CCL20, e CCL2 em queratinócitos. Estes são responsáveis pelo recrutamento de neutrófilos, células T, e monócitos para a pele. Globalmente, estes sinais levam a uma infiltração maciça de células imunitárias em tecido danificado. Portanto, as lesões HS caracterizam-se por granulócitos, células T, células B e monócitos, que se diferenciam em macrófagos e células dendríticas. IL-23 e IL-12 apoiam as células Th17 e Th1 na produção das citocinas IL17 e IFN-γ.
*Treg=células T regulamentares
IL-1: Descobertas empíricas mostram que os processos mediados por IL-1 não são mediados por HS e contribuem para a infiltração celular e danos nos tecidos. A família das citocinas IL-1 inclui 7 citocinas com actividade pró-inflamatória, estas incluem IL-1α, IL-1β, IL-18, IL-33, IL-36α, IL-36β, e IL-36γ. IL-1α é fortemente pró-inflamatória e induz uma cascata de mediadores inflamatórios como TNF e IL-18. Vários achados empíricos indicam que os queratinócitos produzem níveis elevados de IL-1. Pensa-se que existe um mecanismo de feedback positivo entre IL-1 e IL-17. IL-36 está envolvido na activação de inflammasomas, bem como na sinalização pró-inflamatória através da activação do factor nuclear-kB (NF-κB) e da proteína cinase activada por mitogénio (MAPK). Foram detectados níveis aumentados de IL-36α, IL-36β, e IL-36γ no soro e na pele lesional de doentes com SH.
IL-6: As provas sobre as associações entre IL-6 e HS são controversas. Enquanto alguns estudos mostraram um aumento da expressão de IL-6 mRNA nas lesões de doentes HS em comparação com a pele nãoesional, outros estudos mostraram uma diminuição dos níveis de IL-6 nas lesões HS em comparação com a pele nãoesional. A IL-6 é uma citocina pleotrópica que desempenha um papel fundamental em toda uma série de processos imunitários. Em combinação com TGF-β, IL-1β, e IL-23, IL-6 desencadeia o desenvolvimento de células Th17 e inibe o desenvolvimento de células T regulamentares induzidas por TGF-β.
IL-10: Foi observado que na SH não só existem níveis elevados de citocinas pró-inflamatórias, mas também o mediador anti-inflamatório IL-10 é sobreexpresso na pele lesional dos doentes com SH. Uma explicação possível é que a upregulação da IL-10 imunossupressora é uma resposta compensatória aos processos inflamatórios e à propagação de micróbios comensais na pele. Isto suprime os níveis de IL-22 e IL-17 na pele lesional. Para saber mais sobre o papel desta citocina anti-inflamatória na patogénese da SH, são necessários mais estudos.
IL-17/IL-23: Na derme papilar e reticular das lesões HS, existe um grande número de células Th17, que podem estar envolvidas em inflamação neutrofílica excessiva e drenagem purulenta. Observou-se uma sobreexpressão da IL-17 em pele lesional, perilesional e não lesional de doentes com SH, indicando uma inflamação subclínica que precede a formação de lesões activas. Foram também detectados níveis aumentados de IL-17 no soro de pacientes com SH. Nos queratinócitos, a IL-17 induz a expressão de várias proteínas (LL37/cathelicidina, S100A7, S100A8, e S100A9), que são aumentadas na pele e soro lesional de pacientes com HS, mas não na pele perilesional. Estas proteínas estão envolvidas na proliferação de queratinócitos e na expressão de citocinas e quimiocinas pró-inflamatórias. Globalmente, os resultados sugerem que o eixo IL-23/IL-17 está significativamente envolvido na patogénese da SH.

Em paralelo com a investigação sobre os patomecanismos a nível molecular, a eficácia das novas terapias anti-inflamatórias está a ser investigada em ensaios clínicos [8]. Isto inclui também uma série de casos que foi apresentada na conferência DDG deste ano pela Dra. med. Caroline Hilbring, médica assistente, Instituto de Investigação de Serviços de Saúde em Dermatologia e as Profissões de Enfermagem, Hospital Universitário de Hamburgo (D) (caixa ) [9].
Congresso: Conferência DDG 2021
Literatura:
- Iesalnieks I, Dornseifer U: Acne inversa (hidradenite suppurativa). Cirurgião 2020; 91: 293-300.
- Del Duca E, et al. Vias de Citocinas e Terapias Alvo Investigacionais na Hidradenite Supurativa. Int J Mol Sci 2020; 21: 8436; doi:10.3390/ijms21228436
- Vossen ARJV, van der Zee HH, Prens EP: Hidradenite suppurativa: uma revisão sistemática integrando vias inflamatórias num modelo patogénico coeso. Immunol frontal 2018; 9: 2965.
- Van der Zee H: Biólogos no tratamento da hidradenite suppurativa. Hessel van der Zee, MD, PhD. EADVVVirtual Highlights, 2020.
- https://2020.eadvhighlights.com (último acesso 14.09.2021)
- Revuz J: Hidradenite suppurativa. J Eur Acad Dermatol Venereol 2009; 23: 985-998.
- Zouboulis C, et al: Desenvolvimento e validação do International Hidradenitis Sup-purativa Severity Score System (IHS4), um novo sistema de pontuação dinâmica para avaliar a severidade do HS. Br J Dermatol 2017; 177: 1401-1409.
- Informação sobre drogas, www.swissmedicinfo.ch, (último acesso 14.09.2021)
- Schuch A, Absmaier-Kijak M, Volz T: Acne inversa/Hidradenite suppurativa – Da patogénese à terapia. Dermatologia actual 2019; 45(06): 277-287.
- Hilbring C, Kirsten N, Augustin M: série de casos de 10 pacientes com acne inversa: uso de Ixe-kizumab em caso de perda secundária do efeito do adalimumab. FV01/08, reunião do DDG, 15.04.2021.
- Scala E, et al.: Hidradenitis Suppurativa: Onde estamos e para onde vamos. Células 2021; 10(8), 2094; https://doi.org/10.3390/cells10082094
- Wolk K, Join-Lambert, O, Sabat, R: Etologia e patogénese da hidradenite supurativa. Br J Dermatol 2020; 183(6): 999-1010.
PRÁTICA DA DERMATOLOGIA 2021; 31(6): 39-40