A terceira causa mais comum de morte por doença cardiovascular é a embolia pulmonar aguda. A determinação de D-dimers é altamente sensível na exclusão da embolia pulmonar aguda. Hoje em dia, a angiografia CT é utilizada para fazer o diagnóstico. Após a estratificação do risco, é feita a escolha da estratégia de tratamento. Os doentes de alto risco requerem uma terapia agressiva, enquanto os doentes de baixo risco podem ser tratados como doentes ambulatórios. A duração da anticoagulação depende da presença de factores provocadores, risco de hemorragia e qualquer evidência de coagulação persistentemente activada após a descontinuação da anticoagulação. Dos novos anticoagulantes, o rivaroxaban é aprovado na Suíça como profilaxia de recaída.
As embolias pulmonares são a terceira causa de morte mais comum entre as doenças cardiovasculares após o enfarte do miocárdio e o insulto cerebrovascular. Nos estudos de registo, a mortalidade após 90 dias situa-se entre 8,6-17% [1, 2]. Os factores de risco para mortalidade elevada são a idade >70 anos, doença tumoral, insuficiência cardíaca, doença pulmonar obstrutiva crónica (DPOC), hipertensão arterial, taquipneia e hipocinesia do ventrículo direito na ecocardiografia.
A hipertensão pulmonar tromboembólica crónica é encontrada em 2-4% dos doentes após embolia pulmonar aguda. Esta condição é definida como pressão arterial pulmonar média superior a 25 mmHg persistindo durante 6 meses após o diagnóstico de embolia pulmonar aguda [3].
Diagnóstico
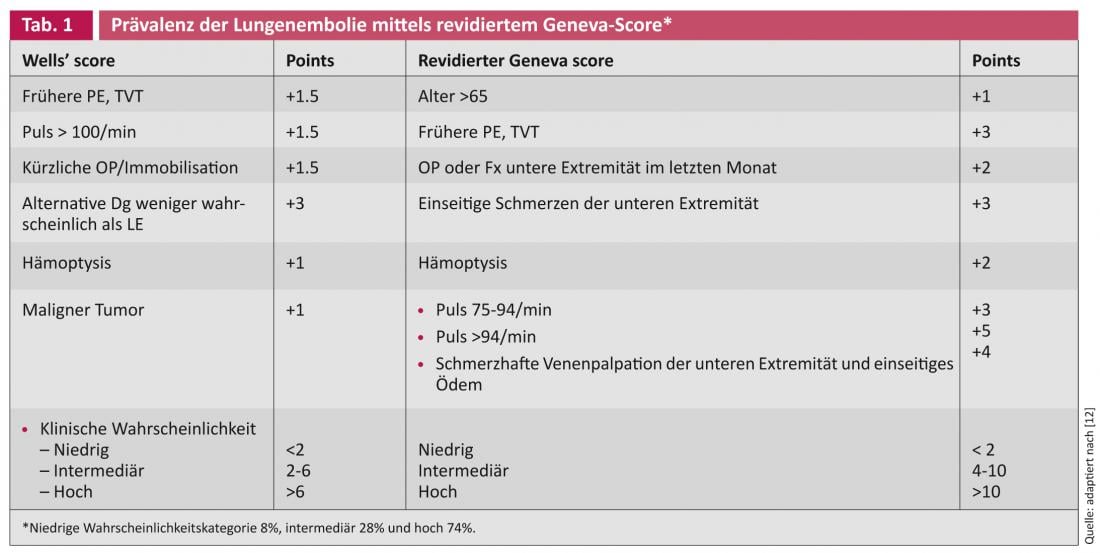
Os pacientes com suspeita de embolia pulmonar aguda devem ser classificados em níveis de suspeita elevados (60-80%), intermédios (20-30%) ou baixos (5-10%), com base na situação clínica. Se a probabilidade for baixa, um teste normal de D-dímero é suficiente para a descartar. Os doentes com probabilidade média e alta precisam de anticoagulação até que os resultados estejam disponíveis. O historial, sintomas, saturação de oxigénio e ECG são necessários para avaliar a probabilidade. Pode ser feito empiricamente ou por meio de pontuações – a Pontuação Wells e a Pontuação revista de Genebra são bem conhecidas [4].
D-dímero
O D-dímero é um produto de degradação da fibrina reticulada e é elevado em eventos tromboembólicos venosos agudos. Analisado por ELISA quantitativa ou testes turbidimétricos automatizados, a determinação do D-dímero é altamente sensível (>95%) na exclusão de embolia pulmonar aguda. Em pacientes com probabilidade clínica baixa e D-dímeros negativos, o risco de 3 meses de um evento tromboembólico é muito baixo em cerca de 0,1%. No entanto, a especificidade dos d-dimers não é muito elevada, especialmente em pacientes com elevada probabilidade clínica, pacientes atribuídos por outras razões, >65 anos de idade e mulheres grávidas. Os limiares de D-dímeros ajustados à idade poderiam aumentar o significado, mas as validações prospectivas ainda são necessárias.
Por exemplo, um estudo internacional mostrou uma melhor discriminação por D-dimers em pacientes com mais de 50 anos de idade e com baixa probabilidade clínica a um valor de corte de (idade do paciente x10) µg/l versus 500 µg/l fixos [5].
Angiografia CT
A angiografia CT multidetectores é mais sensível do que a angiografia CT de um único detector e substituiu largamente a cintilografia pulmonar de ventilação e perfusão. O risco de radiação deve ser considerado, especialmente em mulheres grávidas; nestas pacientes, as vantagens da angiografia CT sobre a cintilografia pulmonar continuam a ser controversas.
Angiografia convencional
A angiografia pulmonar convencional continua a ser o padrão de ouro para o diagnóstico da embolia pulmonar. Devido à sua invasividade, este método só deve ser utilizado em doentes em que uma suspeita de alto grau não pôde ser confirmada ou em que a terapia endovascular está planeada.
Tratamento
Os pacientes com embolia pulmonar aguda devem ter o seu prognóstico avaliado; o Índice de Gravidade de Embolia Pulmonar ou a sua versão simplificada pode ser usada para o fazer com base na clínica [6].
Para a terapia de embolias pulmonares agudas, devem ser observados os seguintes pontos:
– Pacientes de alto risco:
- aproximadamente 5% de todos os doentes sintomáticos
- Mortalidade na fase aguda de 15%
- devem ser tratados agressivamente por trombólise, cirurgicamente ou através de cateterização [7].
– Pacientes de baixo risco:
- Maioria de todos os pacientes
- Mortalidade na fase aguda de aproximadamente 1%.
- Pode ser tratado como um paciente internado de curta duração ou mesmo como um paciente externo
– Risco intermediário:
- Afecta cerca de 30% dos doentes sintomáticos
- Tratamento hospitalar
- Benefício pouco claro em relação à trombólise
A ecocardiografia, medições de troponina ou peptídeo natriurético pró-cérebro (pró-BNP) podem refinar a estratificação do risco, mas a relação custo-eficácia ainda não é clara.
Um estudo multicêntrico na Suíça, França, Bélgica e EUA não mostrou diferenças significativas nas taxas de recorrência e sangramento em comparação com a terapia de internamento em doentes com embolia pulmonar sintomática aguda, baixo risco de mortalidade (índice de gravidade da embolia pulmonar classe I ou II) e tratamento ambulatório com enoxaparina subcutânea durante pelo menos 5 dias, seguido de antagonistas de vitamina K [8].

Na fase aguda, estão disponíveis heparina não fracturada, heparinas de baixo peso molecular (NMH), fondaparinux e, mais recentemente, rivaroxaban.
As heparinas actuam ligando-se ao anticoagulante natural antitrombina, o que leva a uma inactivação maciçamente acelerada da trombina por antitrombina. Devido às grandes diferenças individuais na ligação da heparina às proteínas plasmáticas, a dosagem deve ser controlada e ajustada por meio de testes de coagulação. Isto pode ser feito usando aPTT, tempo de trombina, actividade anti-FXa.
A principal vantagem da administração subcutânea de NMH é a dose fixa adaptada ao peso, na maioria dos casos sem a necessidade de monitorização. O mecanismo de acção é o mesmo que para a heparina não fracturada, mas com um efeito mais forte também sobre o FXa. A equivalência clínica da heparina não fracionada e da NMH foi demonstrada num estudo [9]. Fondaparinux, um pentasacarídeo sintético, com uma dosagem de 7,5 mg/d é equivalente à heparina não fracturada e NMH em doentes com embolia pulmonar.
NMH e fondaparinux são predominantemente excretados pelo rim, pelo que se aconselha precaução na insuficiência renal com uma depuração <30 ml/min. Em tal situação, a redução da dose, intervalos mais longos, medição da actividade anti-FXa ou a utilização de heparina não fracturada estão disponíveis como alternativas. Os doentes com doença tumoral maligna devem ser tratados com NMH durante pelo menos 3 meses. Ao mudar para um antagonista de vitamina K, a sobreposição com NMH ou heparina não fracturada deve durar pelo menos 5 dias e ser descontinuada após se atingir uma INR de 2,0.
Todos os anticoagulantes podem causar hemorragias. O antagonista da vitamina K associado a grandes hemorragias aumenta com a idade. Actualmente, os resultados clínicos são validados para avaliar o risco de hemorragia (pontuação RIETE, pontuação HEMORR2HAGES).
Ao escolher a duração da anticoagulação, o risco de recidiva tromboembólica deve ser ponderado contra o risco de hemorragia sob anticoagulação. As 8 directivas do consenso ACCP recomendam geralmente a terapia durante pelo menos 3 meses. Isto é especialmente verdade para pacientes com um evento provocado em que o factor provocador foi entretanto eliminado. Em pacientes com eventos idiopáticos, a terapia prolongada pode ser discutida se a avaliação do benefício-risco for positiva. Em tumores malignos, a anticoagulação deve ser continuada até que o tumor seja controlado ou curado. Nos últimos anos, foi procurada uma abordagem individualizada. Por exemplo, um estudo com medição dos dímeros D 4 semanas após a interrupção da anticoagulação mostrou que a estratificação do risco é possível; baixo risco com dímeros D normais, sem necessidade de mais terapia, ou alto risco (15% de recorrências após 18 meses) com dímeros D elevados com a recomendação de continuar a anticoagulação por mais 12 meses [10].
Vários novos anticoagulantes estão em desenvolvimento ou já aprovados. Estes inibidores directos, independentes da antitrombina, de FXa (rivaroxaban, apixaban) ou trombina (dabigatran) podem substituir as heparinas e os antagonistas da vitamina K em muitos pacientes. Estes fármacos são administrados numa dose fixa e normalmente não requerem controlo de coagulação. O ensaio Einstein PE mostrou que o rivaroxaban na dose padrão (2×15 mg durante 3 semanas seguido de 20 mg 1x/d) era não-inferior à enoxaparina seguido de antagonistas da vitamina K durante 3, 6 ou 12 meses. Ocorreu uma hemorragia significativamente menos grave com a mesma taxa de recorrência [11]. Contudo, até à data, apenas o rivaroxaban foi aprovado na Suíça, e apenas para a prevenção de embolias pulmonares recorrentes.
Conclusão para a prática
- Em caso de suspeita de embolia pulmonar aguda, são efectuados esclarecimentos adicionais com base numa avaliação clínica de probabilidade.
- Os d-dimers têm uma sensibilidade elevada e um valor preditivo negativo e podem excluir embolia pulmonar aguda com baixa probabilidade clínica.
- Para o tratamento, os doentes são divididos em grupos de risco; os doentes de alto risco precisam de tratamento agressivo rapidamente, os doentes de baixo risco podem ser tratados como doentes ambulatórios.
- O tratamento é com heparinas (não fracturadas ou NMH) seguido por antagonistas da vitamina K; nenhuma das novas substâncias está actualmente aprovada na Suíça para o tratamento agudo da embolia pulmonar, mas a profilaxia de recaída pode ser administrada com rivaroxaban.
Thomas Lehmann, MD
Prof. Dr. med. Wolfgang Korte
Literatura:
- Goldhaber SZ, et al: Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999;353:1386-1389.
- Laporte S, et al: Clinical predictors for fatal pulmonary embolism in 15 520 patients with venous thromboembolism: findings from the Registro Informatizado de la Enfermedad TromboEmbolica venosa (RIETE) Registry. Circulation 2008;117:1711–1716.
- Piazza G, Goldhaber SZ: Hipertensão pulmonar tromboembólica crónica. N Engl J Med 2011;364:351-360.
- Ceriani E, et al: Clinical prediction rules for pulmonary embolism: a systematic review and meta-analysis. J Thromb Haemost 2010;8:957-970.
- Douma RA, et al: Potencial de um valor de corte D-dímero ajustado à idade para melhorar a exclusão da embolia pulmonar em pacientes mais velhos: uma análise retrospectiva de três grandes coortes. BMJ 2010;340:c1475.
- Torbicki A, et al: Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Eur Heart J 2008;29:2276-2315.
- Kucher N, et al: Massive pulmonary embolism. Circulação 2006;113:577-582.
- Aujesky D, et al: Tratamento ambulatório versus hospitalar para doentes com embolia pulmonar aguda: um ensaio internacional, aberto, aleatório, não-inferioritário. A Lanceta 2011;378:41-48.
- Simonneau G, et al: Uma comparação da heparina de baixo peso molecular com a heparina não fracturada para embolia pulmonar aguda. N Engl J Med 1997;337:663-669.
- Palareti G, et al: Teste D-dimer para determinar a duração da terapia anticoagulante. N Engl J Med 2006;355:1780-1789.
- Büller HR, et al: Rivaroxaban oral para o tratamento da embolia pulmonar sintomática. N Engl J Med 2012;366:1287-97.
- Le Gal G, et al: Prediction of pulmonary embolism in the emergency department: the revised Geneva score. Ann Intern Med. 2006;144:165-171.