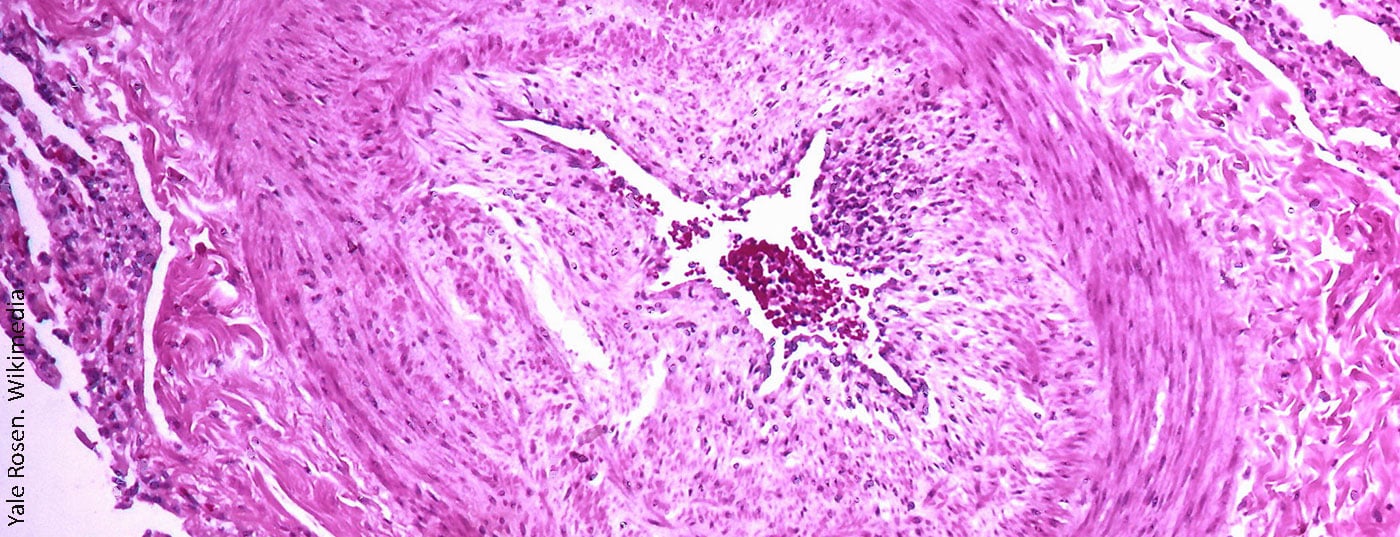
A hipertensão pulmonar tromboembólica crónica (CTEPH) é um subtipo de hipertensão pulmonar (PH). O diagnóstico é muito raro em geral, embora o CTEPH também não seja frequentemente reconhecido e, por conseguinte, subdiagnosticado, razão pela qual o número de casos não notificados é provavelmente mais elevado.
A hipertensão pulmonar tromboembólica crónica (CTEPH) é um subtipo de hipertensão pulmonar (PH), classe 4 de acordo com a classificação ESC/ERC [1]. O diagnóstico de CTEPH pode ser feito quando o PH pré-capilar sintomático (mPAP mínimo 20-25 mmHg e pressão de oclusão capilar pulmonar ≤15 mmHg) combinado com distúrbios de perfusão nos pulmões estão presentes após um mínimo de 3 meses de anticoagulação fiável [2] para diferenciação da embolia pulmonar aguda (LE). O diagnóstico é muito raro em geral, embora o CTEPH não seja muitas vezes reconhecido e, portanto, subdiagnosticado, e o número de casos não notificados é provavelmente mais elevado.
Este artigo apresenta o diagnóstico e terapia do CTEPH com o objectivo de tornar os médicos generalistas e também os colegas especializados mais conscientes desta doença, porque existe uma terapia curativa para estes pacientes – muito pelo contrário de todas as outras formas de PH.
Incidência, factores de risco e patogénese
A incidência anual de CTEPH nos EUA, Europa e Japão é de aproximadamente 3 a 5 casos por cada 100 000 habitantes [2]. A incidência acumulada de CTEPH nos primeiros 2 anos após a LE aguda varia entre 0,1-9,1% [2–10], uma vasta gama; para a Suíça, mesmo um estudo reportou apenas 0,79% [11]. Para piorar a situação, mais de 25% dos casos recentemente diagnosticados não têm historial de LE [12] aguda. Existem outros factores de risco conhecidos para além dos eventos tromboembólicos, tais como doenças auto-imunes e hematológicas [13], a presença de shunt ventrículo-atrial ou eléctrodos de estimulação infectados, uma história de esplenectomia, um grupo sanguíneo não-0, a presença de anticorpos lupus anticoagulantes/antifosfolípidos, terapia de reposição da hormona tiróide e uma história de tumores [14], que são também prognosticalmente desfavoráveis.
A fisiopatologia exacta da CTEPH é complexa, permanece pouco clara e é provável que estejam presentes múltiplos mecanismos causais, tais como trombos persistentes organizados e cicatrizes nas artérias pulmonares proximais (principal, lobo e segmentar) e/ou microangiopatia [15]. Vários processos têm sido associados à resolução incompleta dos trombos [16]: inflamatórios [17–19], factores genéticos [20–22], anomalias da fibrinólise [23–27] e muitos outros [28].
Quadro clínico e descrição do caso
O quadro clínico inclui sempre a dispneia por esforço, o sintoma principal [29,30]. Outros sintomas incluem fadiga em cerca de 30% dos casos, dores no peito em 15%, um episódio de síncope em cerca de 14% e hemoptise em 5% [12,31,32]. Estes sintomas não são raros, especialmente em pacientes mais velhos com comorbilidades adicionais, tais como doença pulmonar obstrutiva crónica, descondicionamento e obesidade frequentemente associada [33,34]. Para piorar a situação, cerca de metade de todos os pacientes com LE aguda relatam falta de ar persistente, mesmo anos após um evento, que é chamado “síndrome pósPE”. No entanto, estes pacientes devem ser objecto de um diagnóstico mais aprofundado para excluir o CTEPH.
O exame clínico revela edema progressivo das extremidades inferiores e outros sinais de congestão (veias do pescoço, aumento do fígado) [33]. Além disso, uma acentuação da componente pulmonar do segundo som cardíaco pode ser detectada na auscultação.
Diagnóstico
Infelizmente, até à data não existe nenhum biomarcador que diferencie claramente o CTEPH de outras formas de PH, alguns marcadores inflamatórios circulantes (por exemplo, CRP, interleucinas -6, -8 e -10) foram estudados [17,18,35], mas nenhum destes testes tem utilização de rotina até à data. O ECG mostra sinais de tensão do ventrículo direito, tais como tipo direito, bloqueio de ramo direito (in)completo ou negatividades da onda T nas derivações anteriores V1-V4 (“padrão de tensão do ventrículo direito”). Na radiografia do tórax só há sinais não específicos de tensão do coração direito com um ventrículo direito e átrio aumentados, por exemplo.
Em diagnósticos posteriores, a ecocardiografia transtorácica (TTE) é normalmente utilizada em primeiro lugar, que também é listada na conferência de consenso de 2016 como a primeira medida de diagnóstico no algoritmo de diagnóstico (Fig. 1). É também um bom primeiro teste de rastreio quando distinguido da síndrome pós-EPE. A hipertensão pulmonar é definida em TTE pela expressão da velocidade de regurgitação tricúspide [36], a partir da qual o sPAP pode ser medido. Com base na medição da velocidade de regurgitação (Vmax) através da válvula tricúspide, o gradiente de pressão entre o ventrículo direito e o átrio direito é estimado usando a equação Bernoulli simplificada (∆P=4×Vmax2). A pressão atrial direita é normalmente aproximada pela largura e variabilidade respiratória da veia cava inferior. Outros sinais são o tamanho e a dilatação do ventrículo direito e dos átrios, um “D-shaping” do septo, e o movimento plano tricúspide (“tricupsid annulat systlic trip”, TAPSE). No entanto, um eco normal não exclui o CTEPH.
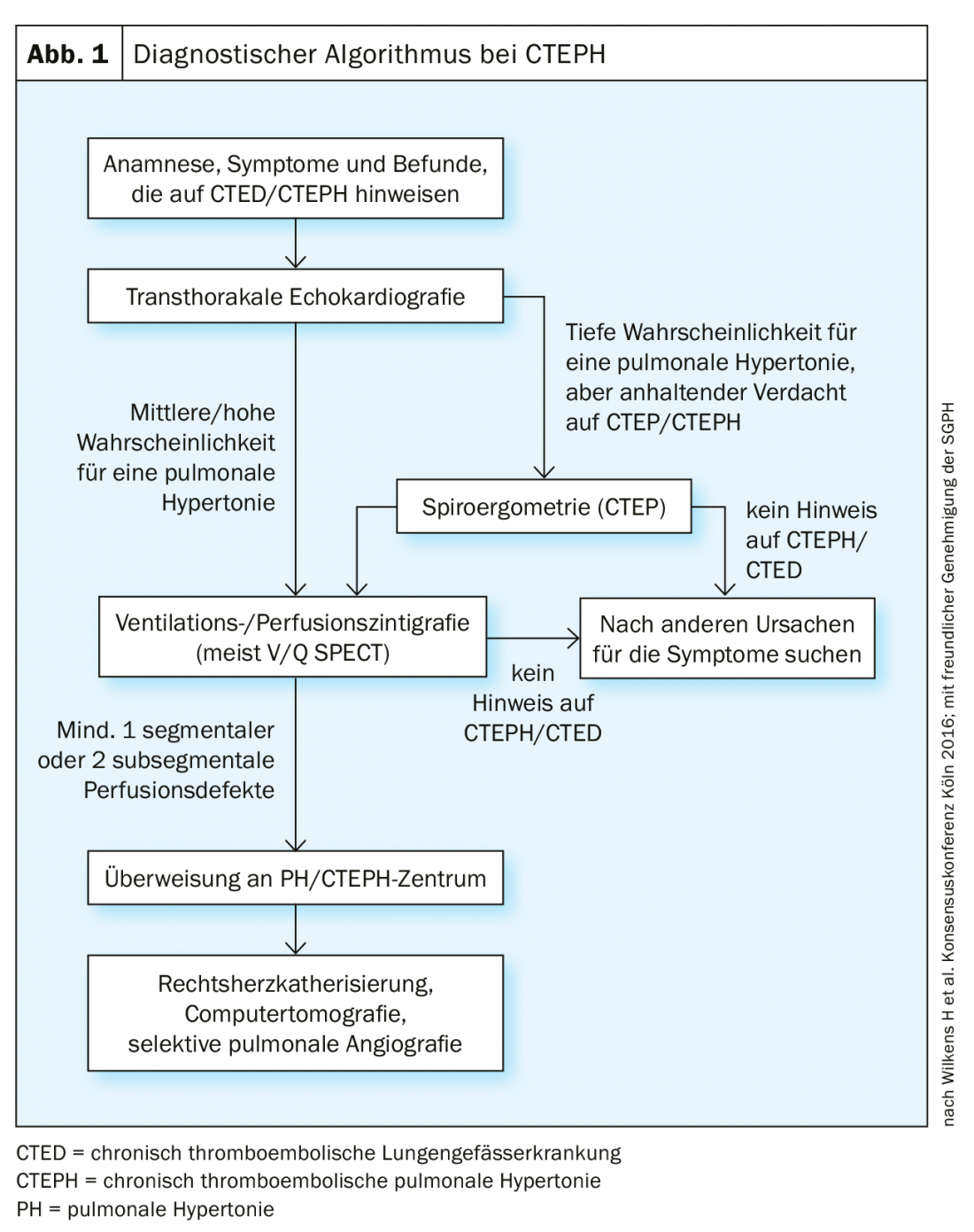
O primeiro método de rastreio por imagem é a cintilografia de ventilação/perfusão (Fig. 2), que, se normal (isto é, sem défices de perfusão “inigualáveis”), pode ser utilizado para excluir a CTEPH com uma sensibilidade de 90-100% e uma especificidade de 94-100% [37,38]. As novas técnicas de “dupla energia” com uma combinação híbrida de SPECT e CT têm a vantagem de imagearem simultaneamente o parênquima pulmonar para além dos défices de perfusão [39,40], mas não estão disponíveis em todos os hospitais.
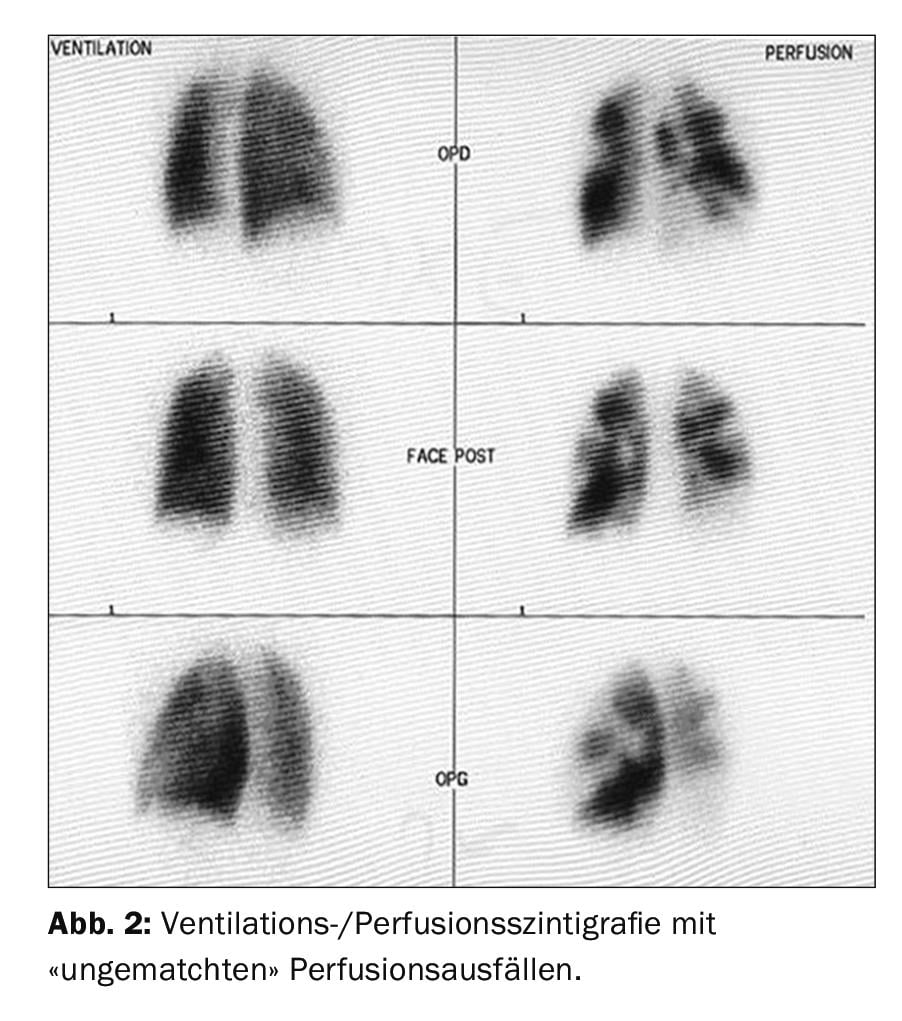
A angiografia pulmonar tomográfica computorizada (CTPA) tem muitas vantagens no diagnóstico e também na avaliação da operacionalidade da CTEPH. Em particular, tem sensibilidade e especificidade para detectar alterações tromboembólicas ao nível do lobar (97-100% e 95-100%, respectivamente), e um pouco mais baixo ao nível do segmento mais periférico (86-100% e 93-99%, respectivamente) [33,41–43]. Os sinais clássicos são trombos excêntricos (Fig. 3 acima), os chamados “webs”, e ocluindo “pouch-lesions”, bem como garantias pronunciadas das artérias intercostais, por exemplo. Todos estes sinais também podem ser vistos na angiografia pulmonar (Fig. 3 abaixo), que também tem a vantagem de medir a pressão invasiva da AP. No entanto, outros diagnósticos diferenciais (DD) podem ser detectados na TC, e sinais de “perfusão de mosaico” e possivelmente enfartes também podem ser detectados no parênquima pulmonar. Outra vantagem é a representação da acessibilidade das alterações tromboembólicas crónicas na identificação da forma como uma camada proximal de dissecção se apresenta e se é acessível para endarterectomia pulmonar. Para poder interpretá-los, são necessárias reconstruções no plano sagital e também coronário para além da fatia axial, e a TC deveria ter sido executada com uma espessura de fatia de 1 mm. A ressonância magnética (RM) ainda não desempenhou um papel no diagnóstico CTEPH numa aplicação padronizada; contudo, o registo simultâneo da função ventricular direita é uma vantagem e espera-se que no futuro a RM desempenhe um papel crescente no rastreio, mas também, se necessário, no acompanhamento de pacientes CTEPH após cirurgia ou outra terapia.
A confirmação hemodinâmica do CTEPH é feita por cateterismo cardíaco direito: A pressão arterial pulmonar média (mPAP) deve ser ≥20-25 mmgHg [1] e pré-capilar (“wedge pressure”/pulmonary capillary oclusion pressure ≤15 mmHg). A aquisição do débito cardíaco por termodiluição ou pelo método directo Fick é um pré-requisito para um cálculo correcto da resistência vascular pulmonar (RVP), um factor importante relativamente ao prognóstico e ao risco cirúrgico [44].
A espiroergometria representa um exame funcional adicional na delimitação do CTEPH: Aqui, são revelados os sinais típicos de desencontro ventilação-perfusão com aumento dos equivalentes respiratórios no limiar anaeróbico, um aumento do gradiente pO2 alveo-arterial, um gradiente positivo de CO2 capilar-e-marítimo, hipoxemia induzida pelo exercício e uma capacidade de exercício claramente reduzida [45–48].
É particularmente importante que, em caso de suspeita de CTEPH, o paciente seja encaminhado para um centro especializado para um diagnóstico interdisciplinar adicional e alocação terapêutica.
Em seguida, descreve-se um caso clássico com todo o historial do paciente:
Um paciente de 50 anos de idade com história de múltiplas embolias pulmonares e eventos tromboembólicos apresenta com a falta de ar da NYHA III-IV. No teste de caminhada de 6 minutos, o paciente atingiu 270 metros em Borg 2 (separador 1).
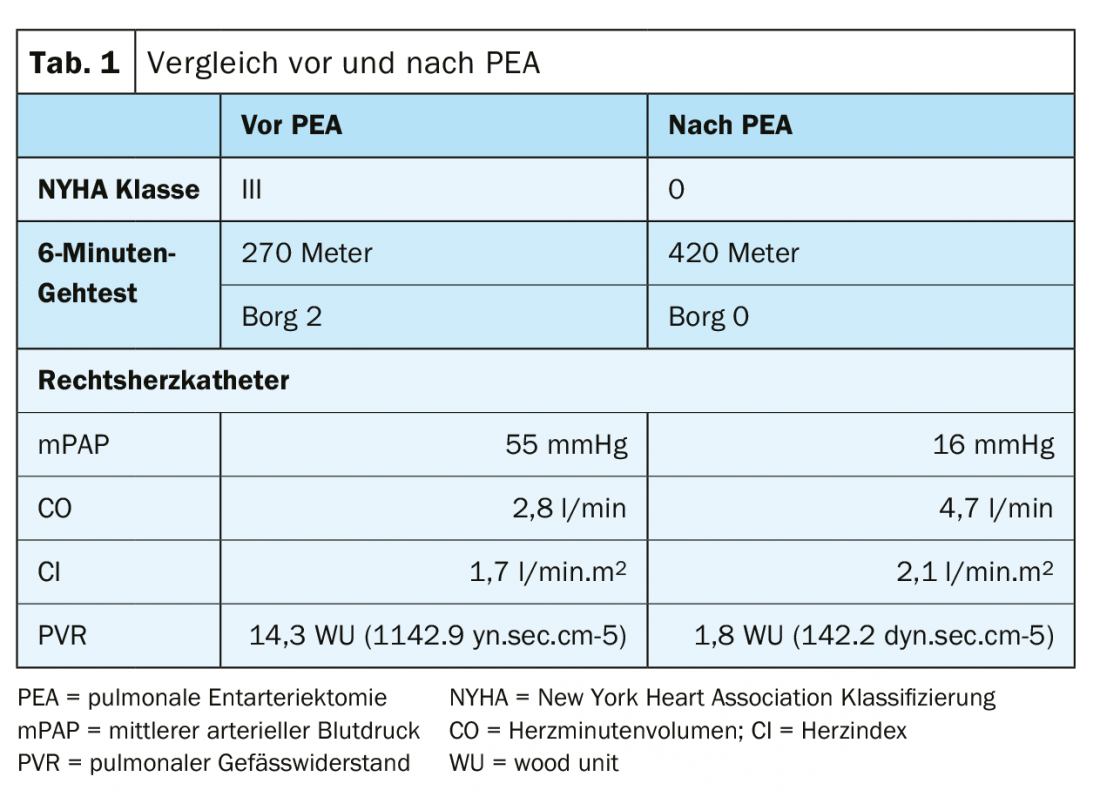
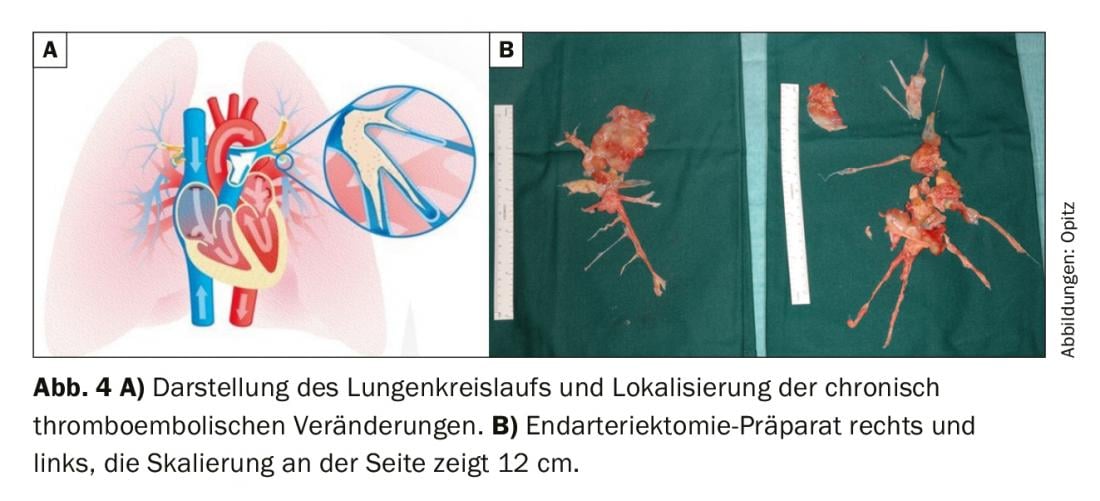
A cintilografia de ventilação/perfusão mostrou defeitos de perfusão bilaterais “inigualáveis” (fig. 2) . O ecocardiograma transtorácico mostra pressão sistólica elevada da artéria pulmonar sistólica (sPAP) e dilatação do ventrículo direito. O TAC mostra lesões centrais (Fig. 3 topo), que foram removidas para a periferia na entarterectomia pulmonar (Fig. 4B) . No pós-operatório, o paciente recuperou rapidamente e teve hemodinâmica normal e NYHA 0 no seguimento de 1 ano (tab. 1).
Previsão
Uma vez diagnosticado, o tratamento deve ser discutido imediatamente, como não tratado, um mPAP de >50 mmgHg tem uma mortalidade de 2 anos de >80% e um mPAP de >30 mmgHg está associado a uma mortalidade de 3 anos de 90% [49].
Desde 2015, tem sido oferecido um programa interdisciplinar de CTEPH no Hospital Universitário de Zurique (USZ), que fornece todo o espectro de tratamento, desde a cirurgia à angioplastia e à terapia medicamentosa. Uma ou duas vezes por mês, a Sociedade Suíça para a Hipertensão Pulmonar oferece um conselho nacional do CTEPH para encaminhar médicos que podem ser contactados para apresentação e discussão de casos (CTEPH@usz.ch, CTEPH@sgph.ch).
Terapia
Terapia cirúrgica: De acordo com as actuais directrizes ERS/ESC, a endarterectomia pulmonar (PEA) é recomendada como terapia de primeira linha em pacientes com CTEPH cirurgicamente acessível [1]. (Fig. 4A). Na AESP, as artérias pulmonares são abertas sequencialmente (sempre de ambos os lados) na máquina coração-pulmão e em hipotermia profunda (20°C) e o material tromboembólico crónico é removido em detenções circulatórias de 20 minutos; isto é tecnicamente possível bem dentro da periferia (Fig. 4B). A decisão de cirurgia e selecção de pacientes deve ser sempre tomada por uma equipa interdisciplinar de especialistas, composta por especialistas em PH, radiologistas e cirurgiões da PEA. [50]. Os factores determinantes para a AESP são: a gravidade dos sintomas, a extensão do PH, a função do ventrículo direito, o perfil de comorbidade do paciente e o material cirurgicamente acessível. Este último ponto em particular é uma avaliação desafiante, pois é bem sabido que a imagem quase sempre subestima a extensão do material tromboembólico crónico. Os doentes com doenças segmentares e sub-segmentares também podem beneficiar da APE com excelentes resultados a curto e longo prazo em centros experientes [51,52]. As recomendações feitas durante o Simpósio Mundial sobre PH afirmam que deve ser obtida uma “segunda opinião” de um centro cirúrgico especializado em CTEPH se um doente tiver sido considerado inoperante num centro não-CTEPH [50]. Além disso, a gravidade do PH e a limitação da disfunção cardíaca direita não são contra-indicações em si mesmas para a AESP e aos doentes sintomáticos deve ser oferecida terapia cirúrgica [53]. A idade também não é uma contra-indicação absoluta, pois os dados mostram que os pacientes >70 anos beneficiam tanto quanto os pacientes mais jovens [54]. No entanto, a mortalidade do procedimento não é totalmente insignificante e é relatada na literatura como sendo de 2,4-13,2%, sendo esta última de períodos anteriores [55].
Uma cirurgia bem sucedida pode melhorar significativamente a qualidade de vida e a expectativa de vida dos pacientes (taxas de sobrevivência de >90% após 1 ano >70%, após 6 a 10 anos [31,55,56]): Dyspnoea, o teste de caminhada de 6 minutos, bem como um aumento do consumo de oxigénio, um equivalente respiratório melhorado para oCO2 e uma redução da necessidade de oxigénio poderiam ser mostrados [57,58]. Tem sido relatado um aumento da esperança de vida a médio e longo prazo.
Angioplastia de balão pulmonar (BPA)
Se a cirurgia não for uma opção, a BPA interventiva pode tratar alterações crónicas periféricas segmentares ou subsegmentárias em várias sessões. Podem ser conseguidas melhorias convincentes em hemodinâmica, teste de caminhada de 6 minutos e aula de NYHA/OMS. Faltam ainda dados a longo prazo [59].
Terapia medicamentosa: Os pacientes com CTEPH distal, não acessível cirurgicamente e hipertensão pulmonar residual após a AESP podem ser tratados com medicamentos [50,60]. São utilizadas drogas semelhantes às utilizadas para HAP [61–64]. Independentemente da terapia de redução da pressão, que actua particularmente sobre a componente distal do CTEPH, cada paciente com CTEPH deve ser anticoagulado para toda a vida, independentemente de outras terapias. As decisões terapêuticas só devem ser tomadas após pelo menos 3 meses de OAC [1,65]. Actualmente, os pacientes ainda são tratados com antagonistas de vitamina K. Devido à sua eficácia comparável e ao seu bom perfil de segurança, os NOAK (novos anticoagulantes orais) estão também a ser cada vez mais utilizados, especialmente também em casos de problemas de dose-finding e nos casos em que o INR (International Normalized Ratio) está frequentemente fora da gama alvo de 2,5-3,5 [65,66].
Mensagens Take-Home
- A hipertensão pulmonar tromboembólica crónica (CTEPH) é definida como hipertensão pulmonar sintomática com defeitos persistentes de perfusão pulmonar apesar de uma anticoagulação adequada durante pelo menos 3 meses.
- Os doentes com CTEPH devem ser encaminhados para um centro especializado em CTEPH para confirmação do diagnóstico através de cateterismo cardíaco direito e subsequente terapia.
- A Sociedade Suíça para a Hipertensão Pulmonar oferece uma comissão nacional do CTEPH para encaminhar médicos para contacto para apresentação e discussão de casos (CTEPH@usz.ch, CTEPH@sgph.ch).
- A capacidade funcional, a resiliência física e também a esperança de vida dos pacientes pode ser aumentada por endarterectomia pulmonar. Por esta razão, uma PEA deve ser avaliada em qualquer caso.
- A terapia com medicamentos e/ou angioplastia com balão pode ajudar os pacientes com CTEPH inoperável ou hipertensão pulmonar residual pós-operatória.
- O CTEPH exige a anticoagulação oral obrigatória para toda a vida.
|
Equipa do CTEPH do Hospital Universitário de Zurique: |
Literatura:
- Galie N, Humbert M, Vachiery JL, et al: 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endossed by: Associação para Cardiologia Pediátrica e Congénita Europeia (AEPC), Sociedade Internacional de Transplante de Coração e Pulmão (ISHLT). O diário respiratório europeu. 2015;46(4): 903-975.
- Gall H, Hoeper MM, Richter MJ, et al: Uma análise epidemiológica da carga de hipertensão pulmonar tromboembólica crónica nos EUA, Europa e Japão. European respiratory review : um jornal oficial da Sociedade Respiratória Europeia. 2017;26(143).
- Korkmaz A, Ozlu T, Ozsu S, et al: Resultados a longo prazo no tromboembolismo pulmonar agudo: a incidência de hipertensão pulmonar tromboembólica crónica e factores de risco associados. Clin Appl Appl Appl Appliances Thromb Hemost. 2012;18(3): 281-288.
- Otero R, Oribe M, Ballaz A, et al: Avaliação ecocardiográfica da pressão arterial pulmonar no acompanhamento de pacientes com embolia pulmonar. Investigação da trombose. 2011;127(4): 303-308.
- Poli D, Grifoni E, Antonucci E, et al: Incidência de tromboembolismo venoso recorrente e de hipertensão pulmonar tromboembólica crónica em doentes após um primeiro episódio de embolia pulmonar. J Thromb Thrombolysis. 2010;30(3): 294-299.
- Surie S, Gibson NS, Gerdes VE, et al: A procura activa de hipertensão pulmonar tromboembólica crónica não aparece indicada após embolia pulmonar aguda. Investigação da trombose. 2010;125(5): e202-205.
- Dentali F, Donadini M, Gianni M, et al: Incidência de hipertensão pulmonar crónica em doentes com embolia pulmonar anterior. Investigação da trombose. 2009;124(3): 256-258.
- Marti D, Gomez V, Escobar C, et al: Incidência de hipertensão pulmonar tromboembólica crónica sintomática e assintomática. Arch Bronconeumol. 2010;46(12): 628-633.
- Klok FA, van Kralingen KW, van Dijk AP, et al: Prospective cardiopulmonary screening program to detect chronic tromboembolic pulmonary hypertension in patients after acute pulmonary embolism. Haematologica. 2010;95(6): 970-975.
- Noble S, Pasi J: Epidemiologia e fisiopatologia da trombose associada ao cancro. Br J Câncer. 2010;102 Suppl 1: S2-9.
- Coquoz N, Weilenmann D, Stolz D, et al: Estudo de rastreio observacional multicêntrico para a detecção de CTEPH após embolia pulmonar. O diário respiratório europeu. 2018;51(4).
- Pepke-Zaba J, Delcroix M, Lang I, et al: Chronic thromboembolic pulmonary hypertension (CTEPH): resulta de um registo internacional prospectivo. Circulação. 2011;124(18): 1973-1981.
- Blauwet LA, Edwards WD, Tazelaar HD, McGregor CG: Patologia cirúrgica da tromboendarterectomia pulmonar: um estudo de 54 casos de 1990 a 2001. Hum Pathol. 2003;34(12): 1290-1298.
- Bonderman D, Wilkens H, Wakounig S, et al: Factores de risco para hipertensão pulmonar tromboembólica crónica. O diário respiratório europeu. 2009;33(2): 325-331.
- Kim NH: Grupo 4 Hipertensão Pulmonar: Hipertensão Pulmonar Tromboembólica Crónica: Epidemiologia, Fisiopatologia, e Tratamento. Clínica Cardiol. 2016;34(3): 435-441.
- Simonneau G, Torbicki A, Dorfmuller P, Kim N: A patofisiologia da hipertensão pulmonar tromboembólica crónica. Revista respiratória europeia: um jornal oficial da Sociedade Respiratória Europeia. 2017; 26 (143).
- Quarck R, Nawrot T, Meyns B, Delcroix M: proteína C-reativa: um novo preditor de resultado adverso na hipertensão arterial pulmonar. Journal of the American College of Cardiology. 2009;53(14): 1211-1218.
- Zabini D, Heinemann A, Foris V, et al: Análise abrangente de marcadores inflamatórios em doentes com hipertensão pulmonar tromboembólica crónica. O diário respiratório europeu. 2014;44(4): 951-962.
- Reesink HJ, Meijer RC, Lutter R, et al: Correlatos hemodinâmicos e clínicos de endotelina-1 em hipertensão pulmonar tromboembólica crónica. Circ J. 2006;70(8): 1058-1063.
- Wolf M, Boyer-Neumann C, Parent F, et al: Thrombotic risk factors in pulmonary hypertension. O diário respiratório europeu. 2000;15(2): 395-399.
- Bonderman D, Turecek PL, Jakowitsch J, et al: Alta prevalência de factor VIII de coagulação elevado em hipertensão pulmonar tromboembólica crónica. Thromb Haemost. 2003;90(3): 372-376.
- Gu S, Su P, Yan J, et al.: Comparação dos perfis de expressão genética e vias relacionadas na hipertensão pulmonar tromboembólica crónica. Int J Mol Med. 2014;33(2): 277-300.
- Lang IM, Dorfmuller P, Vonk Noordegraaf A: A Patobiologia da Hipertensão Pulmonar Tromboembólica Crónica. Ann Am Thorac Soc. 2016;13 Suppl 3: S215-221.
- Le Gal G, Delahousse B, Lacut K, et al: Fibrinogen Aalpha-Thr312Ala e factor XIII-A Val34Leu polimorfismos no tromboembolismo venoso idiopático. Investigação da trombose. 2007;121(3): 333-338.
- Suntharalingam J, Goldsmith K, van Marion V, et al: Fibrinogen Aalpha Thr312Ala polimorfismo está associado a hipertensão pulmonar tromboembólica crónica. O diário respiratório europeu. 2008;31(4): 736-741.
- Marsh JJ, Chiles PG, Liang NC, Morris TA: As disfibrinogenemias pulmonares associadas à hipertensão pulmonar tromboembólica crónica exibem uma estrutura desorganizada de fibrina. Investigação da trombose. 2013;132(6): 729-734.
- Morris TA, Marsh JJ, Chiles PG, et al: Alta prevalência de disfibrinogenemia entre doentes com hipertensão pulmonar tromboembólica crónica. Sangue. 2009;114(9): 1929-1936.
- Opitz I, Kirschner MB: Investigação Molecular em Hipertensão Pulmonar Tromboembólica Crónica. Int J Mol Sci. 2019;20(3).
- Mayer E, Jenkins D, Lindner J, et al: Gestão cirúrgica e resultado de pacientes com hipertensão pulmonar tromboembólica crónica: resultados de um registo internacional prospectivo. J Thorac Cardiovasc Surg. 2011;141(3): 702-710.
- Held M, Grun M, Holl R, et al.: Chronic thromboembolic pulmonary hypertension: Time delay from onset of symtoms to diagnosis and clinical condition at diagnosis. Dtsch Med Wochenschr. 2014;139(33): 1647-1652.
- Hoeper MM, Madani MM, Nakanishi N, et al: Hipertensão pulmonar tromboembólica crónica. Lancet Respir Med. 2014;2(7): 573-582.
- Lang IM, Simonneau G, Pepke-Zaba JW, et al: Factores associados ao diagnóstico e operabilidade da hipertensão pulmonar tromboembólica crónica. Um estudo de caso-controlo. Thromb Haemost. 2013;110(1): 83-91.
- Gopalan D, Delcroix M, Held M. Diagnóstico de hipertensão pulmonar tromboembólica crónica. Revista respiratória europeia: um jornal oficial da Sociedade Respiratória Europeia. 2017; 26 (143).
- Fedullo P, Kerr KM, Kim NH, Auger WR: Hipertensão pulmonar tromboembólica crónica. Revista americana de medicina respiratória e de cuidados críticos. 2011;183(12):1605–1613.
- Quarck R, Wynants M, Verbeken E, et al: Contribuição da inflamação e da angiogénese deficiente para a patologia da hipertensão pulmonar tromboembólica crónica. O diário respiratório europeu. 2015;46(2): 431-443.
- Rehman MB, Garcia R, Christiaens L, et al: Poder das medições ecocardiográficas de repouso para classificar os doentes com hipertensão pulmonar de acordo com a sociedade europeia de testes de estratificação de risco de exercício cardiológico. Revista internacional de cardiologia. 2018;257: 291-297.
- Leblanc M, Leveillee F, Turcotte E: Avaliação prospectiva do valor preditivo negativo de V/Q SPECT usando 99mTc-technegas. Nucl Med Commun. 2007;28(8): 667-672.
- Gruning T, Drake BE, Farrell SL, Nokes T. Experiência clínica de três anos com VQ SPECT para o diagnóstico de embolia pulmonar: desempenho diagnóstico. Clin Imaging. 2014;38(6): 831-835.
- Gutte H, Mortensen J, Jensen CV, et al: Detecção de embolia pulmonar com SPECT de ventilação-perfusão combinada e CT de baixa dose: comparação cabeça a cabeça com angiografia CT multidetectores. J Nucl Med. 2009;50(12): 1987-1992.
- Simanek M, Koranda P: O benefício da imagiologia pulmonar híbrida personalizada SPECT/CT. Am J Nucl Med Mol Imaging. 2016;6(4): 215-222.
- Ley S, Ley-Zaporozhan J, Pitton MB, et al: Desempenho diagnóstico de técnicas de imagem de ponta para avaliação morfológica de anomalias vasculares em pacientes com hipertensão pulmonar tromboembólica crónica (CTEPH). Eur Radiol. 2012;22(3): 607-616.
- Reichelt A, Hoeper MM, Galanski M, Keberle M: Hipertensão pulmonar tromboembólica crónica: avaliação com TC de 64-detectores de linha versus angiografia digital de substrato. Eur J Radiol. 2009;71(1): 49-54.
- Sugiura T, Tanabe N, Matsuura Y, et al: Papel da imagiologia por tomografia computorizada de 320 folhas no trabalho diagnóstico de pacientes com hipertensão pulmonar tromboembólica crónica. Peito. 2013;143(4): 1070-1077.
- Jenkins D, Mayer E, Screaton N, Madani M: Diagnóstico e gestão da hipertensão pulmonar tromboembólica crónica de última geração. Revista respiratória europeia: um jornal oficial da Sociedade Respiratória Europeia. 2012;21(123): 32-39.
- Scheidl SJ, Englisch C, Kovacs G, et al: Diagnóstico de CTEPH versus IPAH usando gradientes de dióxido de carbono capilar a fim de maré. O diário respiratório europeu. 2012;39(1): 119-124.
- Held M, Meintz S, Baron S, et al: Cura cirúrgica da apneia central do sono? Revista americana de medicina respiratória e de cuidados críticos. 2013;188(3): 395-396.
- Held M, Grun M, Holl R, et al: Teste de exercício cardiopulmonar para detectar hipertensão pulmonar tromboembólica crónica em doentes com ecocardiografia normal. Respiração. 2014;87(5): 379-387.
- Held M, Linke M, Jany B: Ecocardiografia e cateterização do coração direito em hipertensão pulmonar. Dtsch Med Wochenschr. 2014;139(30): 1511-1517.
- Lewczuk J, Piszko P, Jagas J, et al: Factores prognósticos em doentes medicamente tratados com embolia pulmonar crónica. Peito. 2001;119(3): 818-823.
- Kim NH, Delcroix M, Jenkins DP, et al: Hipertensão pulmonar tromboembólica crónica. Journal of the American College of Cardiology. 2013;62(25 Suppl): D92-99.
- Madani MM, Auger WR, Pretorius V, et al: Endarterectomia pulmonar: mudanças recentes na experiência de mais de 2.700 pacientes de uma única instituição. Os Anais da Cirurgia Torácica. 2012;94(1): 97-103; discussão
- D’Armini AM, Morsolini M, Mattiucci G, et al: Endarterectomia pulmonar para hipertensão pulmonar tromboembólica distal. J Thorac Cardiovasc Surg. 2014;148(3): 1005-1011; 12 e1-2; discussão 11-2.
- Madani MM: Tratamento Cirúrgico da Hipertensão Pulmonar Tromboembólica Crónica: Tromboendarterectomia Pulmonar. Metodista Debakey Cardiovasc J. 2016;12(4): 213-218.
- Berman M, Hardman G, Sharples L, et al: Endarterectomia pulmonar: resultados em doentes com idade >70. European journal of cardio-thoracic surgery : revista oficial da Associação Europeia de Cirurgia Cardíaco-Torácica. 2012;41(6): e154-160.
- Cannon JE, Su L, Kiely DG, et al: Dynamic Risk Stratification of Patient Long-Term Outcome After Pulmonary Endarterectomy: Results From the United Kingdom National Cohort. Circulação. 2016;133(18): 1761-1771.
- Archibald CJ, Auger WR, Fedullo PF, et al: Resultado a longo prazo após tromboendarterectomia pulmonar. Revista americana de medicina respiratória e de cuidados críticos. 1999;160(2): 523-528.
- Rahnavardi M, Yan TD, Cao C, et al: Tromboendarterectomia pulmonar para hipertensão pulmonar tromboembólica crónica: uma revisão sistemática. Anais de cirurgia torácica e cardiovascular: revista oficial da Associação de Cirurgiões Torácicos e Cardiovasculares da Ásia. 2011;17(5): 435-445.
- Condliffe R, Kiely DG, Gibbs JS, et al: Melhores resultados na hipertensão pulmonar crónica tromboembólica crónica tratada por via médica e cirúrgica. Revista americana de medicina respiratória e de cuidados críticos. 2008;177(10): 1122-1127.
- Mahmud E, Behnamfar O, Ang L, et al: Balloon Pulmonary Angioplasty for Chronic Thromboembolic Pulmonary Hypertension. Interv Cardiol Clin. 2018;7(1): 103-117.
- Mayer E: Tratamento cirúrgico e pós-operatório da hipertensão pulmonar tromboembólica crónica. Revista respiratória europeia: um jornal oficial da Sociedade Respiratória Europeia. 2010;19(115): 64-67.
- Moser KM, Bloor CM: Lesões vasculares pulmonares que ocorrem em doentes com hipertensão pulmonar tromboembólica crónica dos vasos principais. Peito. 1993;103(3): 685-692.
- Ghofrani HA, D’Armini AM, Grimminger F, et al: Riociguat para o tratamento da hipertensão pulmonar tromboembólica crónica. The New England journal of medicine. 2013;369(4): 319-329.
- Simonneau G, D’Armini AM, Ghofrani HA, et al: Preditores de resultados a longo prazo em doentes tratados com riociguat para hipertensão pulmonar tromboembólica crónica: dados do ensaio de extensão a longo prazo, aleatorizado, do rótulo aberto CHEST-2. Lancet Respir Med. 2016;4(5): 372-380.
- Ghofrani HA, Simonneau G, D’Armini AM, et al: Macitentan para o tratamento da hipertensão pulmonar tromboembólica crónica inoperável (MERIT-1): resultados do estudo multicêntrico, fase 2, aleatório, duplo-cego, controlado por placebo. Lancet Respir Med. 2017;5(10): 785-794.
- Konstantinides SV, Torbicki A, Agnelli G, et al: 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014;35(43): 3033-3069, 69a-69k.
- Konstantinides SV, Torbicki A, Agnelli G, et al: Corrigendum to: Orientações CES 2014 sobre o diagnóstico e a gestão da embolia pulmonar aguda. Eur Heart J. 2015;36(39): 2642.
InFo PNEUMOLOGIA & ALERGOLOGIA 2020; 2(2): 12-15.