No melanoma maligno, algumas novas descobertas sobre factores prognósticos e riscos foram publicadas recentemente. As directrizes alteradas trazem consigo algumas inovações na vida quotidiana e visam a divisão mais precisa possível entre melanomas de alto risco e melanomas de baixo risco. As maiores alterações ocorrem principalmente nos melanomas finos entre 0,75 e 1 mm, para os quais foram criados novos critérios adicionais. No entanto, o futuro do diagnóstico do melanoma envolverá sem dúvida o trabalho com marcadores de melanoma e análises de mutação, que já hoje em dia são rotineiramente utilizados para o tratamento do melanoma metastásico avançado.
A taxa de incidência do melanoma é muito elevada, especialmente na população mais jovem. Além disso, as metástases ocorrem relativamente cedo, para as quais ainda não foi encontrada cura. O melanoma maligno é o tumor fatal mais comum em adultos jovens, tornando-o na terceira principal causa de morte após acidentes e suicídio. No futuro, a atenção deve, portanto, não se concentrar apenas no tratamento do melanoma, mas também na prevenção e na identificação de grupos de risco para os quais vale a pena um exame e uma despistagem regulares.
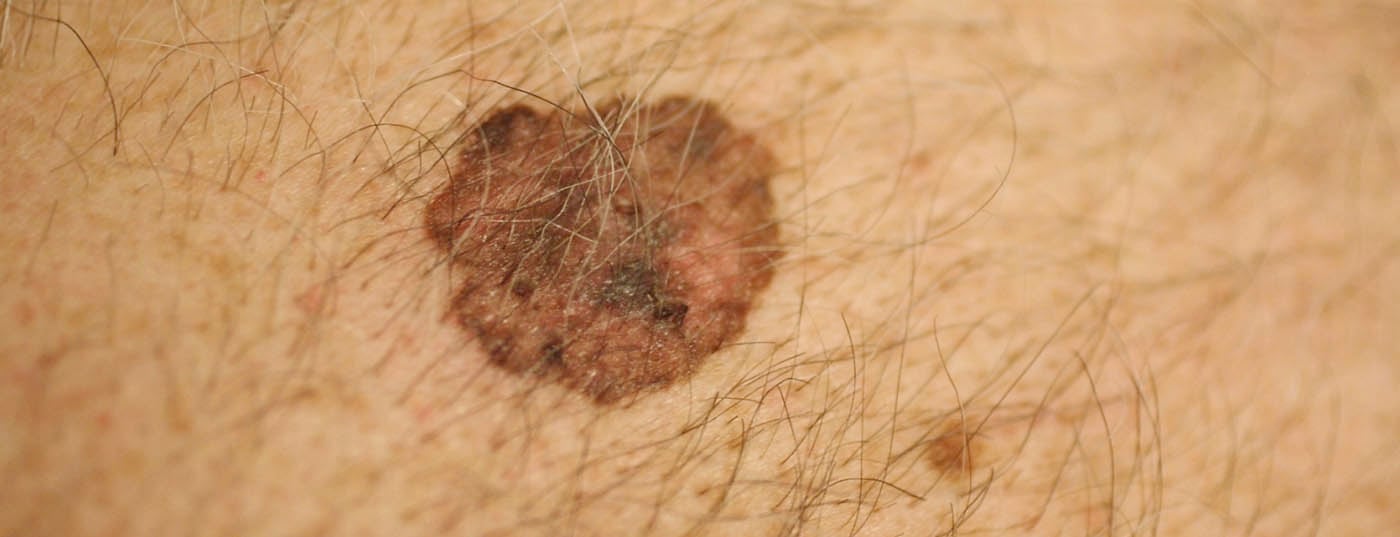
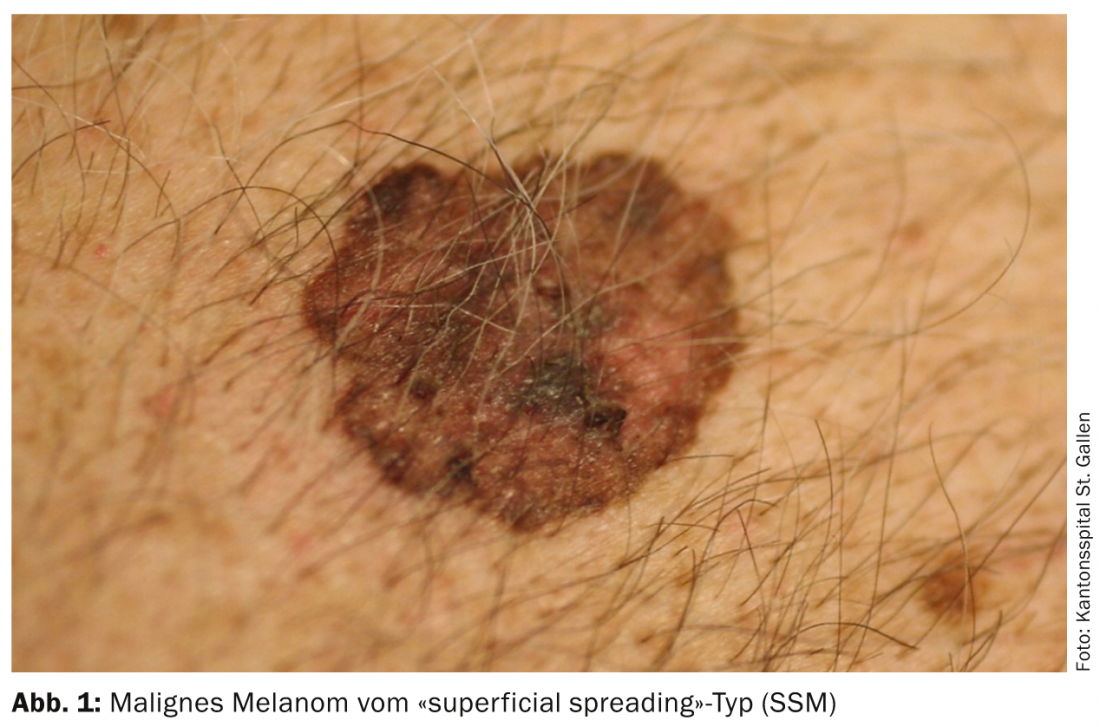
O enorme aumento dos melanomas tem em grande parte a ver com a mudança no comportamento de lazer. Assim, a pele jovem é exposta ao sol mais cedo e de forma mais intensiva, especialmente durante as férias de banho, na banda da praia, solário, etc. Em particular, desenvolve-se o chamado “melanoma de espalhamento superficial” (SSM). (Fig.1) e melanomas nodulares em locais do corpo que nem sequer estão cumulativamente expostos a muito sol, mas experimentam a exposição ao sol. Além disso, a maior mistura de etnias nas latitudes do sul é também significativa, uma vez que os caucasianos que vivem perto do equador têm uma incidência significativamente maior de melanoma, especialmente os de ascendência da Europa Central e do Norte. A taxa de incidência na Suíça é superior a 220 pessoas por 1 milhão de habitantes por ano, a taxa mais alta da Europa.
Grupos de risco
As anteriores campanhas de prevenção visavam mais a pele de alto risco, ou seja, os tipos de pele I e II, que sofrem mais queimaduras solares sem protecção solar suficiente. No entanto, os verdadeiros doentes de risco listados no Quadro 1 têm sido bastante negligenciados até agora. Por conseguinte, as medidas de prevenção relativas à protecção solar devem ser aplicadas a todos, uma vez que não é possível distinguir entre indivíduos de baixo risco e indivíduos de alto risco na população em geral.

Em particular, o número de nevos celulares displásicos, especialmente na região glútea, indica um risco de melanoma que é até nove vezes superior ao da população normal. Os outros grupos de risco listados no Quadro 1 também têm um risco 2,3-18 vezes maior de melanoma. Por conseguinte, é importante incluir também precisamente os doentes (grupo 5 dos Separador. 1), que já tenham sido tratados para outro tumor devem também ser informados sobre o risco de melanoma e regularmente examinados. É também importante apontar um risco já nas crianças e certamente realizar um exame corporal total, incluindo um exame médico. a região glútea e genital.
Os homens têm um risco adicional. Têm pior prognóstico e maior mortalidade, independentemente da espessura do melanoma. Encontramos outros factores de risco no lado da genética; especialmente nos melanomas familiares, são postuladas mutações herdadas de dois genes com um papel crítico no ciclo celular, nomeadamente o CDKM2A e o CDK4. No entanto, factores desencadeantes adicionais, tais como a exposição solar e outros factores ambientais, também desempenham um papel neste caso. Além disso, estão envolvidos muitos outros loci genéticos, que diferem dependendo do tipo de melanoma, seja um melanoma lentigo-maligna ou um melanoma uveal, por exemplo.
O melanoma lentigo-maligna está mais associado à velhice e à radiação solar total acumulada. Aparece apenas na face, parte superior das costas e extremidades superiores.
O uso de aspirina durante mais de cinco anos foi considerado como um fraco factor de protecção, tal como o uso de nicotina para o melanoma maligno lentigo. A utilização de inibidores de TNF-α (biológicos) no tratamento da doença inflamatória intestinal leva a um aumento da incidência de melanoma em comparação com os doentes livres de TNF-α. Estes pacientes têm um risco mais elevado de desenvolver melanoma do que, por exemplo, os familiares de pacientes com melanoma que não têm factores de risco adicionais.
Classificação de melanoma e alterações
Até agora, a espessura do melanoma é o factor de prognóstico mais importante e conduz às decisões terapêuticas. Não mudou muito neste procedimento principalmente cirúrgico no que diz respeito à pós-excisão. A regra ainda se aplica: abaixo de 1 mm de espessura de acordo com Breslow, 1 cm é recortado, acima de 2 mm de espessura é de 2 cm. Para o melanoma in-situ, é escolhida uma distância de segurança de 0,5 cm.
A avaliação do índice mitótico é agora decisiva para outros exames, tais como a remoção dos gânglios linfáticos sentinela. A taxa de mitose em um milímetro quadrado é agora também analisada para melanomas entre 0,75 mm e 1 mm de espessura. Se este for maior do que 1, um exame de gânglios linfáticos sentinela também deve ser efectuado aqui, como no caso de um melanoma mais espesso com mais de 1 mm. No entanto, isto não tem influência na sobrevivência global e na ausência de recorrência, mas serve para detectar micrometástases e, portanto, também a indicação de linfadenectomia. Além disso, existe a possibilidade de em estudos futuros estes doentes de alto risco com micrometástases poderem também ser tratados prospectivamente e/ou adjuvantemente de acordo com a análise da mutação do melanoma.
No entanto, é importante que a reexaminação ocorra no prazo de um mês, porque isto também tem influência na sobrevivência global do paciente. A excisão primária deve ser realizada raramente, no máximo a pós-excisão juntamente com o gânglio linfático sentinela, mas no prazo de um mês.
A nova classificação TNM (quadros 2 e 3) tem em conta a taxa mitótica, que deve ser avaliada para melanomas com menos de 1 mm de espessura.

Um factor adicional importante é a ulceração, que pode ser indicativo de um imunótipo de defesa tumoral diferente e pode justificar a terapia com interferão-α adjuvante na fase IIb do tumor, ou seja, acima de 2 mm Breslow com ulceração.

Quem deve cuidar dos doentes de alto risco?
Hoje em dia, já é certo que uma formação dermatológica especializada de três anos é crucial para a detecção do melanoma. Além disso, os doentes de alto risco devem também ser examinados pelo menos uma vez por ano, incluindo o exame dermatoscópico. Devem ser tiradas fotografias de corpo inteiro e fotografias de comparação ou mesmo meios de armazenamento digitais como o Molemax.
O rastreio também pode ter lugar no médico de família?
Não há dúvida de que a população de risco é demasiado grande para ser examinada por um especialista como um todo, o que seria de facto recomendado. De facto, é mais importante que as pessoas em risco, especialmente os homens de meia-idade entre os 40 e os 60 anos, façam check-ups em primeiro lugar. Este deve ser o objectivo principal de qualquer campanha de melanoma. Além disso, contudo, deve ser desenvolvida e oferecida mais formação aos médicos de clínica geral sobre normas de dermoscopia. Um diploma de competências especiais seria útil, também para não-dermatologistas.
Diagnósticos adicionais na presença de melanoma
De acordo com a directriz S3 da ADO, o diagnóstico inicial de propagação é útil para melanomas até à fase IIb, ou seja, melanomas até 4 mm com ou sem ulceração sem gânglio linfático ou metástases distantes são tratados de acordo com o estadiamento, incluindo o estadiamento. Biópsia anual dos gânglios linfáticos das sentinelas e proteína S-100 anualmente durante cinco anos. Os exames clínicos têm lugar de seis em seis meses. Além disso, os doentes em fase Ib, ou seja, melanomas inferiores a 1 mm mas com ulceração e uma taxa mitótica mais elevada de ≥1/mm2, são também candidatos ao exame anual de ultra-sons e medição S-100 em soro. A ressonância magnética, TAC, raio-X torácico, ultra-som abdominal e cintilografia esquelética não são recomendados no seguimento destes melanomas de até 4 mm de espessura.
Exame PET-CT: A partir de melanomas de 4 mm de espessura e em situações seleccionadas, bem como em pacientes muito jovens, recomenda-se também um exame PET-CT como teste de diagnóstico primário antes de se efectuar uma dissecção ou remoção de gânglios linfáticos sentinela. A utilidade de uma ressonância magnética adicional da cabeça é questionável no caso de um PET-CT negativo. No PET-CT, por outro lado, são repetidamente encontradas metástases solitárias, que podem ser abordadas curativamente (por exemplo, recorrência em cicatrizes, gânglios linfáticos, metástases de tecido mole solitário entre o tumor primário e a estação de gânglios linfáticos).
gânglio linfático sentinela: Em qualquer melanoma com mais de 1 mm de diâmetro (e em situações especiais também a 0,75 mm, separador 4) , é aconselhável a pesquisa e remoção selectiva do gânglio linfático sentinela (caso não seja encontrado enriquecimento em PET-CT num melanoma com mais de 4 mm Breslow).

O trabalho dos gânglios linfáticos sentinela é recomendado na directriz S3 de acordo com os protocolos nacionais ou internacionais. Faz aqui sentido trabalhar com pelo menos oito secções de tecido e definir se estão presentes micrometástases (conglomerados de células melanoma, especificados em décimos de milímetro) ou macrometástases. Outros factores que precisam de ser respondidos são a profundidade de penetração das células melanoma no parênquima linfonodal, a infiltração da cápsula linfonodal, o seu avanço e a linfangiose. O significado das várias indicações relativas à carga tumoral ainda não é claro em termos prognósticos, mas deve ser indicado histopatologicamente.
Recomendações para metástases da fase IIc (doentes com elevado risco de recorrência): Estes doentes devem receber uma RM da cabeça, PET-CT de todo o corpo, sonografia de gânglios linfáticos, marcador tumoral S-100 no soro e marcador tumoral LDH. Se forem detectadas metástases locorregionais, deve ser realizada uma ultra-sonografia abdominal, bem como uma radiografia ao tórax. Os pacientes com micro ou macrometástases comprovadas devem ser apresentados no quadro interdisciplinar de tumores. O consenso é que a linfadenectomia electiva não é realizada principalmente a menos que tenham sido encontradas macrometástases no gânglio linfático sentinela ou melhoramentos no PET-CT. A linfadenectomia profiláctica na presença de micrometástases deve ser discutida caso a caso. Neste momento, é também necessária informação activa do paciente e discussão/suporte detalhado. Determina também se as terapias adjuvantes, por exemplo, fazem sentido ou não.
Recomenda-se a radioterapia adjuvante após a linfadenectomia se três gânglios linfáticos forem afectados, se tiver havido uma ruptura capsular ou se houver uma metástase de mais de 3 cm nos gânglios linfáticos. No caso de quaisquer metástases, é também útil mandar analisar os espécimes num instituto de patologia, que pode realizar testes genéticos moleculares. Em particular, recomenda-se a análise da mutação BRAF, se também for negativa a análise da mutação NRAS e, no caso dos melanomas da mucosa, o exame no que diz respeito ao kit c. Isto é muito importante hoje em dia, não só para os estudos adjuvantes actuais, mas também para o tratamento posterior de quaisquer metástases, contra as quais podem ser utilizados fármacos específicos para esta mutação.
Mark David Anliker, MD
Literatura:
- Nikolaou V, Stratigos AJ: Tendências emergentes na epidemiologia do melanoma. Br J Dermatol 2014; 170: 11-19.
- Fong ZV, Tanabe KK: Comparação das directrizes sobre melanoma nos EUA, Canadá, Europa, Austrália e Nova Zelândia: uma avaliação crítica e revisão abrangente. Br J Dermatol 2014; 170: 20-30.
- Vredenborg A, et al: nevos melanocíticos adquiridos na infância e melanoma familiar. JAMA Dermatol 2014; 150: 35-40.
- Programa de Orientação Oncológica, Orientação S3, Melanoma, Versão 1.0, Janeiro de 2013.
CONCLUSÃO PARA A PRÁTICA
- A nova classificação TNM não só diferencia de acordo com a espessura do melanoma, mas também de acordo com a taxa mitótica, o que influencia fortemente o procedimento de encenação e também define melhor o risco de metástase em melanomas finos.
- Todos os médicos são obrigados a fazer um check-up regular e a indicar as medidas preventivas já na infância.
- Nos melanomas finos, são realizadas menos imagens para o diagnóstico primário, mas recomenda-se a extirpação dos gânglios linfáticos sentinela para melanomas tão finos como 0,75 mm se estiver presente uma taxa mitótica mais elevada, o que pode tornar-se significativo no que diz respeito à terapia adjuvante e futuras abordagens terapêuticas envolvendo, por exemplo, BRAF, inibição do NRAS e inibição de alvos moleculares mais recentes.
- Devem ser introduzidas normas para médicos de clínica geral e dermatologistas, possivelmente também cursos com certificados de aptidão para a detecção de dermatoscopia e melanoma.
UM RETENIR
- A nova classificação TNM faz a diferença não só com base na espessura do melanoma, mas também com base no nível de mitose, o que tem repercussões importantes na classificação e também define melhor o risco de metástase no melanoma de baixa espessura.
- Todos os médicos devem propor controlos regulares aos doentes em risco e informá-los das medidas preventivas a partir da infância.
- A imagem é raramente utilizada para o diagnóstico inicial em mélanomos de baixa espessura; contudo, o exame dos gânglios sentinela é recomendado após uma espessura de 0,75 mm do mélanomo, na presença de uma elevada taxa de mitose, ce qui peut être pertinent en ce qui concerne le traitement adjuvant et les futures approches thérapeutiques englobant par exemple l’inibition de BRAF, NRAS et l’inhibition de nouvelles cibles thérapeutiques.
- Devem ser definidas normas para clínicos gerais e dermatologistas, e de preferência também para cursos de formação com certificado de competência em dermatoscopia e o reconhecimento de melanomas.
PRÁTICA DA DERMATOLOGIA 2014; 24(3): 6-10