Os inibidores de pontos de controlo imunitários estão a encontrar uma utilização cada vez mais generalizada em oncologia, com alguns sucessos inovadores. No entanto, a activação do sistema imunitário também desencadeia uma vasta gama de efeitos secundários. Também são observados efeitos secundários neurológicos – raros, mas depois potencialmente graves. Então é necessária uma boa gestão.
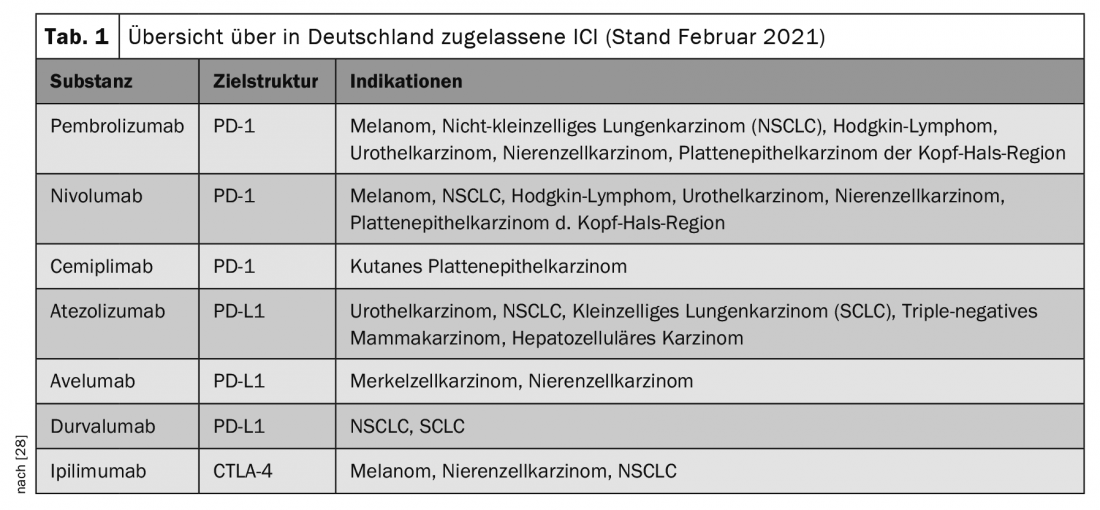
Na terapia oncológica, os chamados inibidores do ponto de controlo imunitário (ICI) têm sido cada vez mais utilizados nos últimos anos e levaram a um avanço na terapia de várias malignidades, por vezes com remissões duradouras ou permanentes. As indicações estão constantemente a ser expandidas e novas substâncias estão a ser aprovadas, de modo que os ICI estão a ser utilizados na terapia de um número crescente de tipos de tumores (Quadro 1).
Os ICI são anticorpos específicos dirigidos contra pontos de controlo imunitário. Exemplos de tais moléculas de ponto de controlo são a morte celular programada 1 receptor (PD-1), PD-1 ligando (PD-L1) ou antigénio de linfócitos T citotóxico 4 (CTLA-4) [1].
Em condições fisiológicas, os pontos de controlo imunitário na maturação das células T e B ocupam uma posição chave para a auto-tolerância e modulação do sistema imunitário. Assim, o CTLA-4 tem principalmente uma função inibitória no priming de células T, enquanto o PD-1 e o PD-L1 como receptor/ligando desempenham um papel inibitório na fase effector, ou seja, no ataque da célula T com um receptor de células T já específico sobre a célula tumoral [2]. As células tumorais utilizam estas moléculas de ponto de controlo para a invasão imunitária, activando-as para inibir o próprio sistema imunitário do organismo que é dirigido contra elas. Por exemplo, muitas células tumorais expressam PD-L1 e podem utilizar este mecanismo para inibir células T específicas dirigidas contra as células tumorais, ligando-se ao seu receptor PD-1 e escapando à destruição pelo próprio sistema imunitário do organismo. Esta evasão imunitária deve ser evitada bloqueando os receptores acima mencionados com ICI, promovendo assim a resposta imunitária anti-tumoral.
Está actualmente a ser realizada investigação sobre combinações de quimioterapia convencional, inibidores da tirosina quinase, radioterapia e ICI, bem como sobre outros pontos de controlo como alvos ou sobre a combinação de diferentes ICIs. Os estudos mostraram evidências de um efeito sinérgico da radioterapia local seguida da administração sistémica do ICI. Assume-se que o tecido tumoral desintegrado pela radioterapia com antigénios libertados e neoantigénios específicos do tumor promove o priming das células T e pode, assim, causar uma resposta mais forte antitumoral sistemicamente [2].
Contudo, devido à activação do sistema imunitário mediada pela ICI, não é surpreendente que uma vasta gama de fenómenos auto-imunes (evento adverso relacionado com a imunidade; irAE) possa ser desencadeada ou que doenças auto-imunes e paraneoplásicas existentes possam ser desencadeadas como efeitos secundários. Dependendo do ponto de controlo inibido, os irAE foram observados em 70-90%, a maioria dos quais de gravidade ligeira (grau 1 ou 2 de acordo com CTCAE (Common Terminology Criteria for Adverse Events)) [1]. Os órgãos mais frequentemente afectados pelo irAE são o intestino, a pele, os pulmões, o fígado e os órgãos endócrinos. O irAE neurológico (nirAE), por outro lado, que pode afectar o sistema nervoso central e periférico, a placa terminal neuromuscular e a musculatura, são raros [3]. Devido à crescente utilização de ICIs, o conhecimento sobre o nirAE está continuamente a aumentar, embora a maior parte das provas até agora geradas principalmente através de relatórios de casos, séries de casos retrospectivos e meta-análises; faltam até agora grandes estudos prospectivos de efeitos secundários. Por conseguinte, as frequências relatadas do nirAE diferem muito. Observaram-se nirAEs de grau 1-2 em 6-12%, nirAEs de grau 3-4 graves em 0,1-1% dos doentes tratados [4]. A doença auto-imune pré-existente não parece comportar um risco significativamente maior de desenvolvimento de novos irAEs com terapia ICI [5]. Contudo, isto é controverso, devido aos dados ainda muito limitados disponíveis. Os irAEs sob terapia ICI ocorrem em média nas primeiras 12 semanas após o início da terapia ICI [6]. Em casos individuais, contudo, a duração pode variar muito, desde alguns dias após a primeira administração ICI até mais de um ano após o início da terapia ou mesmo depois de a administração ICI ter terminado.
Evidentemente, outros diagnósticos diferenciais neurológicos devem ser descartados por meios de diagnóstico apropriados. Eventuais nirAEs devem ser detectadas e tratadas precocemente, pois são raras mas por vezes associadas a uma morbilidade e mortalidade elevadas [7,8].
Uma visão geral das nirAEs actualmente conhecidas será dada aqui. As doenças associadas ao ICI imitam parcialmente quadros clínicos neurológicos bem conhecidos, mas ocorrem em combinações pouco usuais ou representam um novo tipo de fenómeno. No entanto, a gravidade, a gestão terapêutica e o curso diferem consideravelmente dos quadros clínicos neurológicos clássicos.
Sistema nervoso periférico
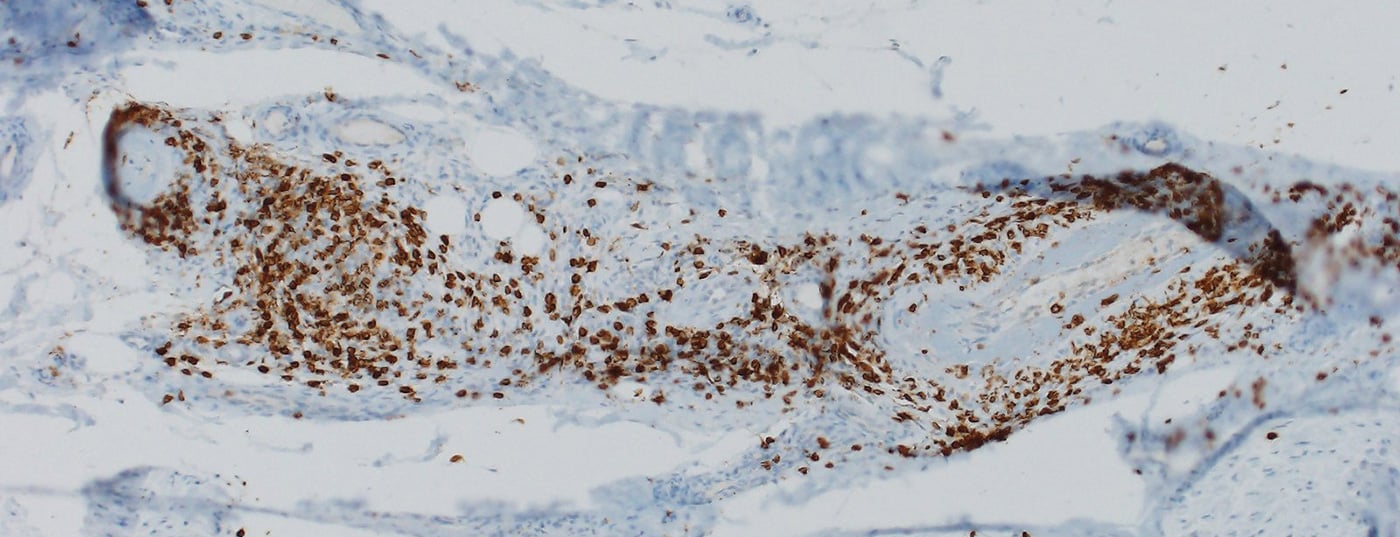
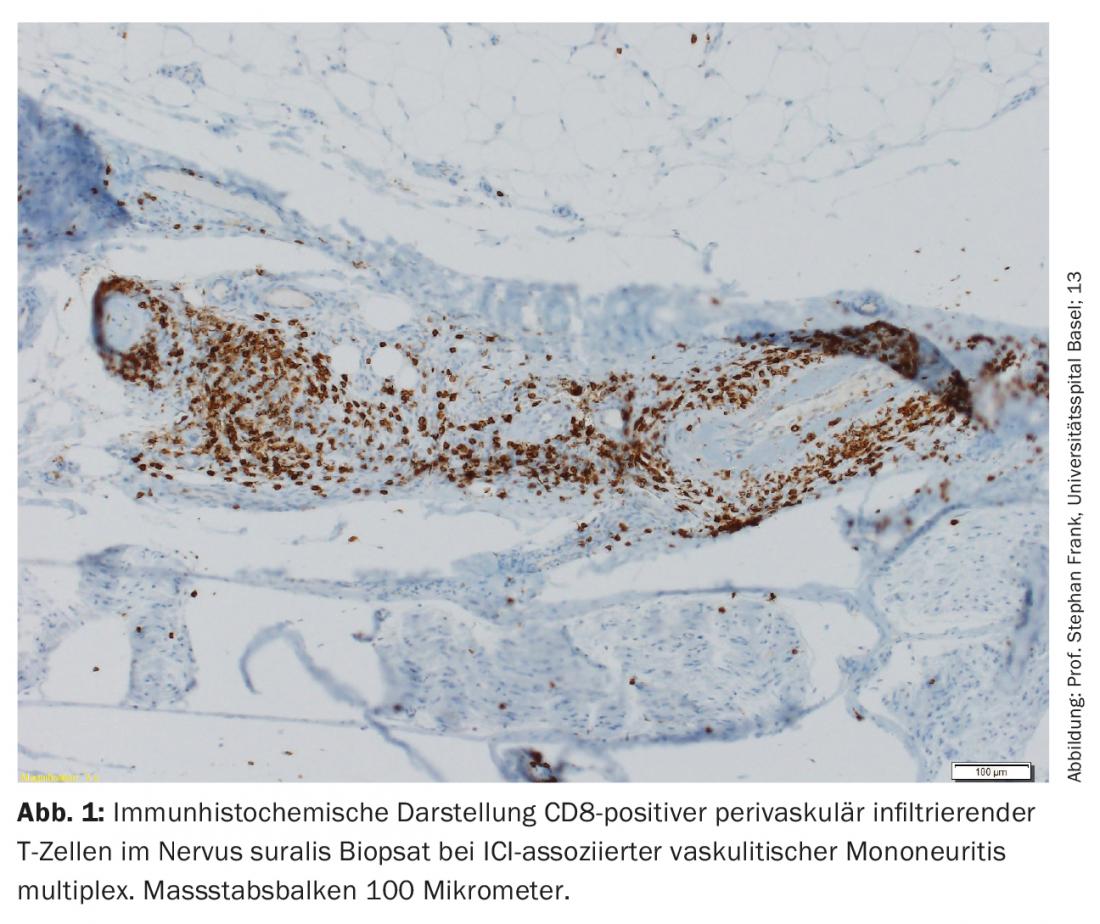
A maioria dos nirAEs afecta o sistema nervoso periférico [9]. Foram observadas polineuropatias em cerca de 3% dos doentes tratados com ICI. As neuropatias associadas ao ICI podem ser axonais e desmielinizantes e ter diferentes padrões de distribuição, incluindo mononeuropatia, mononeurite multiplex, polineuropatia simétrica, neuropatia de pequenas fibras, neuropatia autonómica, amiotrófia nevrálgica, meningoradiculite e envolvimento do nervo craniano [10,11]. Polineuropatias periféricas vasculíticas e multiplex mononeurite p-ANCA-positiva também foram descritas (Fig. 1) [12,13]. Dependendo da gravidade, deve ser considerada a pausa da ICI, a administração de esteróides e/ou a separação do plasma (para remover anticorpos ainda eficazes do ponto de vista terapêutico). No entanto, muitas vezes existem apenas sintomas ligeiros, pelo que a terapia ICI pode ser continuada, dependendo do contexto geral [9,10]. A resposta das neuropatias associadas ao ICI aos esteróides é boa.
O paradigma é uma polineuropatia inflamatória desmielinizante aguda (AIDP), na qual o quadro clássico de uma dissociação cialbuminosa com elevada proteína e baixa contagem de células é menos evidente no LCR, mas uma ligeira pleocitose (até 15 células/μl) é característica, para além do aumento da proteína [9]. Um curso crónico (CIDP) é raro. No caso da AIDP (síndrome tipo Guillain-Barré), a administração de ICI deve ser parada permanentemente e a administração de esteróides de alta dose em combinação com imunoglobulinas intravenosas (IVIG) ou plasmaférese deve ser iniciada, tendo em conta a potencial ameaça à vida [14].
A miosite dolorosa com paresia truncal como principal sintoma também tem sido descrita, especialmente nas terapias anti-PD-1 [15]. Por vezes ocorrem isoladamente, mas frequentemente em combinação com a síndrome miasténica ou uma condição semelhante à AIDP. A miocardite concomitante é comum e deve ser sempre considerada por ter uma mortalidade elevada (cerca de 1/3 dos casos) [16]. Tanto a dermatomiosite como a polimiosite e a miosite necrosante aguda com um fenótipo histopatológico característico são conhecidas [9]. Até agora não foram detectados anticorpos paraneoplásicos ou auto-imunes específicos. Na maioria dos casos, a melhoria dos sintomas ocorreu após a interrupção da administração e imunossupressão do ICI.
Myasthenia gravis, em 60% com anticorpos anti-AChR positivos, foi diagnosticada em aproximadamente 0,1-0,2% dos doentes em terapia ICI [17]. A maioria das regiões oculares e bulbar foram afectadas, seguidas pelas extremidades proximais. Numa grande proporção, a creatina cinase (CK) foi elevada como sinal de concomitância (cardio)myositis [15]. O curso era frequentemente severo com elevada mortalidade. Assim, recomenda-se a cessação permanente da ICI e da terapia imunossupressora. Em contraste com a miastenia gravis clássica, o uso precoce (bem monitorizado) de esteróides de alta dose é também recomendado aqui devido à boa resposta [14]. Como os esteróides podem levar a um agravamento temporário da fraqueza muscular com o risco de insuficiência respiratória, deve ser considerada a administração de IVIG ou a realização de plasmaferese antes dos esteróides [3]. A resposta à terapia sintomática com, por exemplo, piridostigmina, varia.
Sistema nervoso central
A encefalite associada foi observada em 0,1-0,2% dos doentes tratados com ICI. Foram frequentemente encontrados anticorpos paraneoplásicos tais como anti-Ma-2, anti-Hu, anti-CASPR2 ou anticorpos receptores anti-NMDA [18,19]. Os achados patológicos do LCR com pleocitose linfocítica são típicos, os achados da ressonância magnética variam desde hiperintensidades não notáveis a T2 até casos isolados com absorção de contraste regional no neurocrânio [20]. O curso é normalmente favorável quando a administração do ICI é interrompida e são utilizados esteróides, embora tenham sido relatados cursos fatais [21,22].
As perturbações endocrinológicas são diagnosticadas em 4,9-17% no contexto de hipofisite, especialmente durante a terapia com o anticorpo anti-CTLA-4 ipililumab numa dose superior a 3 mg/kg. Em doses mais baixas, a incidência é significativamente menor [23]. Como a reacção imunitária danifica rapidamente a pituitária de forma irreversível, a substituição hormonal a longo prazo é geralmente necessária. Assim, a recomendação terapêutica actual é substituir as hormonas correspondentes, transmitir o ICI e administrar esteróides apenas em casos individuais, uma vez que isto raramente leva a uma melhoria relevante [24].
Especialmente sob inibição do CTLA-4, foi observada meningite asséptica em 0,1-0,2% dos pacientes. Para além do aumento da contagem de células, foi frequentemente encontrado um aumento de proteínas no LCR, na ausência de detecção de patogénicos. Com a terapia com esteróides e a descontinuação da administração de ICI, os sintomas regridem normalmente [3].
As exacerbações associadas ao ICI de doenças inflamatórias pré-existentes do SNC como a esclerose múltipla foram descritas em casos individuais, tal como o desenvolvimento de novo da esclerose múltipla. No entanto, a terapia pode ser executada sob estreita monitorização neurológica em esclerose múltipla [25,26]. Aquaporin-4, neuromielite óptica mediada por anticorpos e mielite transversa seronegativa também foram relatados. Foram também descritos casos individuais de síndrome de caça à tolosa-associada ao ICI, neurosarcoidose, síndromes do tipo PRES ou vasculite do SNC [27,28].
Resumo da recomendação terapêutica
Devido à falta de dados prospectivos, as recomendações terapêuticas baseiam-se na experiência de peritos e em relatórios de casos. Como regra geral, a terapia ICI deve ser imediatamente interrompida em casos de irAE grave. Para o irAE mais suave (grau 1-2), a administração do ICI pode muitas vezes ser retomada. Estas são sobretudo decisões caso a caso, pesando a gravidade do nirAE e o risco de progressão de tumores se o ICI for interrompido. No irAE não neurológico, para o qual há mais dados disponíveis devido à maior frequência, a resposta aos esteróides é normalmente boa. Isto também se aplica à nirAE. O grau de utilidade de uma combinação com imunoglobulinas e/ou separação de plasma depende da gravidade do nirAE e do tipo de ICI (por exemplo, monoterapia versus terapia combinada). Notavelmente, os AIDP associados ao ICI respondem frequentemente bem aos esteróides, em contraste com a clássica síndrome de Guillain-Barré. Devido à longa semi-vida ICI de 2-4 semanas, dependendo da preparação, recomenda-se administrar prednisolona a 0,5-2 mg/kgKG, dependendo da gravidade do nirAE, durante 2-4 semanas e depois afinar lentamente a dose de esteróides. As recorrências do irAE na redução de esteróides são comuns, pelo que estas só devem ser reduzidas lentamente ao longo de algumas semanas [24]. Se os sintomas não forem sensíveis aos esteróides, podem ser utilizadas imunoglobulinas intravenosas (IVIG) ou plasmaférese [3]. São necessários estudos prospectivos para optimizar os regimes de tratamento e para seleccionar pacientes para diferentes opções de tratamento (monoterapia versus terapia combinada). Uma contribuição essencial para a segurança terapêutica destes pacientes frequentemente muito complexos e multimórbidos é a cooperação interdisciplinar de neurologistas e oncologistas. As pessoas de contacto concretas devem ser definidas aqui.
Mensagens Take-Home
- nirAEs como complicações raras mas potencialmente graves da terapia ICI.
- Qualquer tipo de doença auto-imune possível como nirAE, afectando mais frequentemente o sistema nervoso periférico.
- Dependendo da gravidade, descontinuação terapêutica do ICI e/ou esteróides como terapia primária.
Literatura:
- Heinzerling L, De Toni E, Schett G, et al. (2019): Inibidores de pontos de controlo. Dtsch. Arztebl. Int. 116: 119-126
- Riggenbach E, Ermiş E, Elicin O, et al. (2021): Combinação de rádio- e imunoterapia. Swiss Med Forum 21(5-6): 78-82.
- Astaras C, de Micheli R, Moura B, et al. (2018): Eventos Neurológicos Adversos Associados a Inibidores de Pontos de Controlo Imune: Diagnóstico e Gestão. Moeda. Neurol. Neurosci. Rep. 18
- Martins F, Sofiya L, Sykiotis GP, et al. (2019): Efeitos adversos dos inibidores de pontos de imuno-controlo: epidemiologia, gestão e vigilância. Nat. Rev. Clin. Oncol. 16: 563-580
- Menzies AM, Johnson DB, Ramanujam S, et al. (2017): Terapia anti-PD-1 em doentes com melanoma avançado e doenças auto-imunes pré-existentes ou toxicidade importante com ipilimumab. Ann Oncol 28(2): 368-376.
- Weber JS, Hodi FS, Wolchok JD, et al. (2017): Perfil de segurança da monoterapia nivolumab: Uma análise conjunta de pacientes com melanoma avançado. J Clin Oncol 35(7): 785-792.
- Hottinger AF (2016): Complicações neurológicas dos inibidores do ponto de controlo imunitário. Moeda. Opinião. Neurol. 29: 806-812
- Kao JC, Liao B, Markovic SN, et al. (2017): Complicações neurológicas associadas a anticorpos anti-morte programada 1 (PD-1). JAMA Neurol 74(10): 1216-1222.
- Harrison RA, Tummala S, de Groot J (2020) Neurologic Toxicities of Cancer Immunotherapies: a Review. Moeda. Neurol. Neurosci. Rep. 20
- Gu Y, Menzies AM, Long GV, et al (2017): Neuropatia imune mediada após imunoterapia de ponto de controlo. J. Clin. Neurosci. 45: 14-17
- McNeill CJ, Fehmi J, Gladwin J, Preço C (2019): Um caso raro da variante de Miller Fisher da Síndrome de Guillain-Barr é (GBS) induzido por um inibidor do ponto de controlo. BMJ Processo Rep 12(8).
- Daxini A, Cronin K, Sreih AG: Vasculite associada a inibidores do ponto de controlo imunitário – uma revisão sistemática. Reumatologia Clínica 2018; 37: 2579-2584.
- Baldauf MC, Kapauer M, Joerger et al. (no prelo, aceite para publicação em Fevereiro de 2021): Pembrolizumab-associado a CD8+ mononeurite vasculítica multiplex num paciente com mesotelioma. Neurologia: Neuroimunologia & Neuroinflamação.
- Thompson JA, Schneider BJ, Brahmer J, et al. (2020): Gestão das toxicidades relacionadas com a imunoterapia, versão 1.2020 apresentava actualizações às directrizes da NCCN. JNCCN J Natl Compre Cancer Netw 18(3): 231-241.
- Touat M, Maisonobe T, Knauss S, et al. (2018): Miosite e miocardite relacionadas com o ponto de controlo imunitário em doentes com cancro. Neurologia 91(10): e985-e994.
- Moreira A, Loquai C, Pföhler C, et al. (2019): Miosite e efeitos secundários neuromusculares induzidos por inibidores do ponto de controlo imunitário. Eur J Cancer 106:12-23.
- Makarious D, Horwood K, Coward JIG (2017): Myasthenia gravis: Uma toxicidade emergente dos inibidores do ponto de controlo imunitário. Eur J Cancro 82: 128-136
- Mongay-Ochoa N, Vogrig A, Muñiz-Castrillo S, Honnorat J (2020): Sindromes paraneoplásicas anti-Hu-associadas desencadeadas por tratamento inibidor de imuno-checkpoint. J Neurol 267: 2154-2156
- Nowosielski M, Di Pauli F, Iglseder S, et al. (2020): Encefalomieloneurite e artrite após tratamento com inibidores do ponto de controlo imunitário. Neurol Neuroimmunol Neuroinflamação 7(4).
- Nishijima H, Suzuki C, Kon T, et al. (2021): Lesões Talâmicas Bilaterais Associadas à Encefalite Autoimune Induzida por Atezolizumab. Neurologia 96(3): 126-127.
- Touat M, Talmasov D, Ricard D, Psimaras D (2017): Toxicidades neurológicas associadas a inibidores de pontos de imunodeficiência. Moeda. Opinião. Neurol. 30: 659-668
- Johnson DB, McDonnell WJ, Gonzalez-Ericsson PI, et al. (2019): Um relatório de caso de activação clonal de células T CD4+ tipo EBV na encefalite induzida por inibidores de pontos de controlo fatais. Nat Med 25(8): 1243-1250.
- Maker AV, Yang JC, Sherry RM, et al. (2006): Escalada da dose intra-paciente de anticorpos anti-CTLA-4 em doentes com melanoma metastásico. J Immunother 29(4):455-463.
- Haanen JBAG, Carbonnel F, Robert C, et al. (2017): Gestão de toxicidades da imunoterapia: Directrizes de Prática Clínica da OMPE para diagnóstico, tratamento e acompanhamento. Ann Oncol 28(suppl_4): iv119-iv142.
- Donia M, Pedersen M, Svane IM (2017): Imunoterapia do cancro em doentes com doenças auto-imunes pré-existentes. Semin. Imunopatol. 39: 333-337.
- Hasan Ali O, Berner F, Ackermann CJ, et al. (2020): Fingolimod e linfócitos de infiltração de tumores em doentes com cancro tratados por inibidores de controlo. Cancer Immunol Immunother 70(2).
- Narumi Y, Yoshida R, Minami Y, et al. (2018): Neuromielite do espectro óptico secundária ao tratamento com anticorpos anti-PD-1 nivolumab: O primeiro relatório. BMC Cancer 18(1).
- Fan S, Ren H, Zhao L, et al. (2020): Acontecimentos adversos neurológicos relacionados com os inibidores do ponto de controlo imunitário: Uma revisão da literatura. Asia Pac J Clin Oncol. 16: 291-298.
- Lista Vermelha da Rote Liste® Service GmbH. www.rote-liste.de. Acesso em 27 Fev 2021
InFo NEUROLOGIA & PSYCHIATry 2021; 19(2): 6-9.