Carcinoma endometrial, sarcoma uterino, carcinoma cervical – os tumores uterinos são tão diversos como as diferentes células encontradas no útero. Por conseguinte, a gestão também difere significativamente. O diagnóstico cuidadoso para classificar e categorizar o risco é crucial para assegurar o melhor cuidado possível para cada indivíduo.
Os tumores uterinos afectam mulheres de diferentes idades e em diferentes fases da vida. A origem dos tumores é variada, tal como as diferentes células encontradas no útero. Processos malignos frequentemente presentes com o sintoma comum de hemorragia vaginal.
Neste artigo de revisão, gostaríamos de discutir os diferentes tumores uterinos e dar uma visão geral com uma perspectiva sobre as opções de tratamento.
Carcinoma endometrial
O carcinoma endometrial é um dos tumores ginecológicos mais comuns após o carcinoma da mama, com 4634 casos registados no registo de cancro na-tio-nal da Suíça em 2013-2017. Num bom 75% dos casos, o carcinoma endometrial é diagnosticado na pós-menopausa, após a ocorrência frequente de hemorragias pós-menopausa. O factor de risco para o carcinoma endometrial dependente de hormonas (tipo I) é o excesso de estrogénio. Isto é demonstrado pelo risco aumentado com a terapia de estrogénio apenas na pós-menopausa (tibolona, tamoxifeno, dependendo da duração da utilização, também terapia combinada com progestogénio, terapias de estimulação ovárica) [1]. A menarca precoce e a menopausa tardia também podem favorecer o cancro endometrial, tal como a obesidade, a diminuição do metabolismo da glicose e a presença da síndrome do ovário policístico (PCOS). Se houver uma história familiar positiva de cancro endometrial em parentes de 1º grau, o risco de desenvolver a doença até aos 70 anos de idade aumenta para 3,5% em comparação com a população normal de 3,1% [2]. Felizmente, o cancro endometrial é frequentemente sintomático nas fases iniciais em termos de hemorragia pós-menopausa, o que em certa medida explica o bom prognóstico com uma probabilidade de sobrevivência de 5 anos de 80%. Em doentes pré-menopausais com hemorragia uterina anormal, o risco de hiperplasia com atipias ou carcinoma é inferior a 1,5%. Após uma tentativa infrutífera de terapia conservadora, no entanto, uma biopsia por pipeta ou uma histeroscopia e curetagem para exame histológico também deve ser realizada aqui generosamente.
O padrão dourado de diagnóstico é ainda a histeroscopia com curetagem, que deve ser realizada em casos de hemorragia pós-menopausa com um endométrio ≥3 mm. As condições uterinas locais devem ser examinadas por sonografia transvaginal. Se os resultados não forem claros, uma ressonância magnética da pélvis pode proporcionar clareza. Outras imagens por tomografia computorizada são indicadas em fases avançadas ou histologia agressiva para avaliar condições extra-uterinas.
O carcinoma endometrial está classicamente dividido em dois tipos. O tipo I, adenocarcinoma endometrióide, é sensível às hormonas, enquanto que o carcinoma tipo II é independente das hormonas. O grupo de carcinomas tipo II é composto por carcinomas celulares serosos ou claros mais agressivos e carcinosarcomas e afecta uma população mais idosa. Através da análise molecular do grupo TCGA (The Cancer Genome Atlas-Project), foi possível dividir o carcinoma endometrial em quatro grupos moleculares, que podem prever melhor o prognóstico e proporcionar uma terapia adaptada no futuro. Na edição da WHO Pathology 2020, os cancros endometriais são agora classificados como POLE, MMRd (deficiente na reparação de desajustes), p53mut e NSMP (perfil molecular não específico). O prognóstico é muito favorável para o mutante POLE, seguido pelo MMRd do tipo instável do microsatélite; os carcinomas p53mut têm um prognóstico significativamente pior e comportam-se de forma semelhante ao carcinoma seroso dos ovários [3,4].
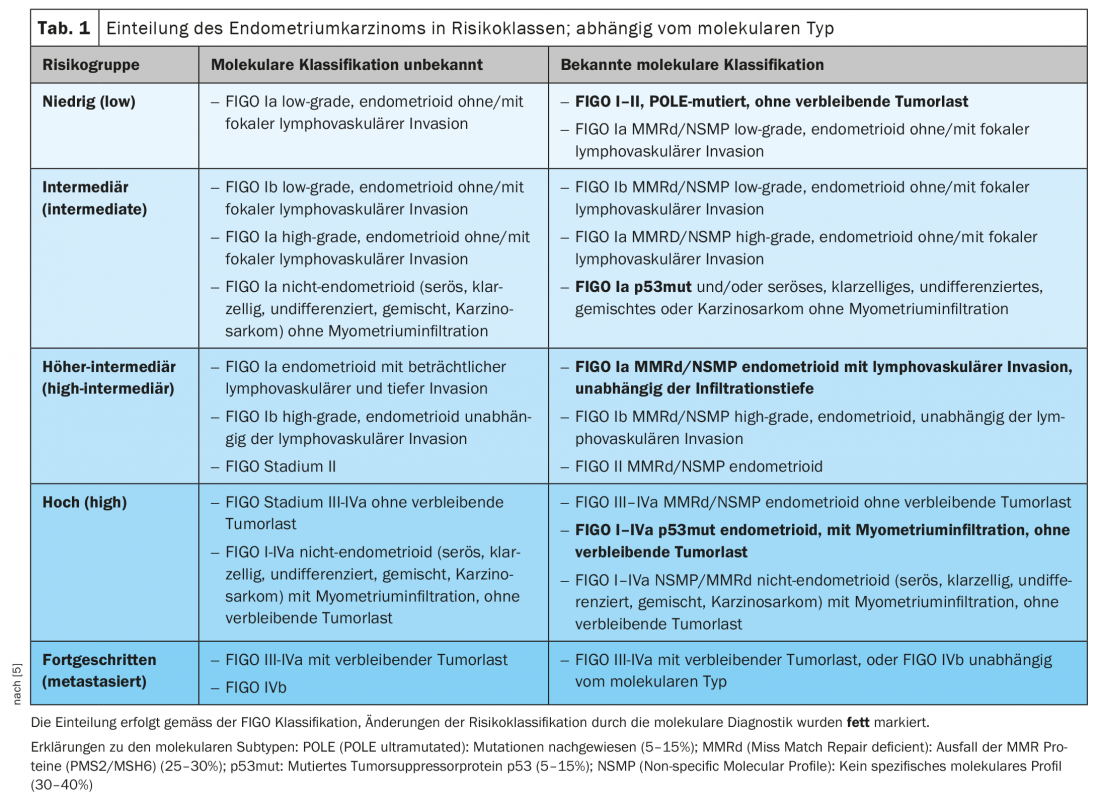
A classificação de risco ESMO-ESGO-ESTRO integrou os marcadores moleculares na sua última edição 2021, de modo que estes marcadores estão agora incluídos na clínica (Quadro 1) [5]. Em tumores avançados, os marcadores moleculares, especialmente MMRd, permitem novas opções de tratamento utilizando inibidores de pontos de controlo.
Actualmente, a terapia cirúrgica deve ser executada por meio de uma histerectomia laparoscópica com adnexectomia bilateral. Nos doentes em pré-menopausa, a adnexa pode ser deixada no lugar em fases iniciais, após educação de risco e se não houver mutação BRCA e não houver síndrome de Lynch. A encenação é realizada cirurgicamente. Isto pode incluir uma secção congelada para avaliar a espessura da infiltração. A decisão de realizar uma linfonodectomia pélvica e para-aórtica e uma omentectomia depende do grupo de risco (intermédio-alto e alto risco) e do estádio (pT1b, G3, tipo II, L1). A linfonodectomia deve sempre incluir a linfonodectomia pélvica e para-aórtica de acordo com a drenagem linfática do útero. Os gânglios linfáticos conspícuos macroscópicos também devem ser removidos nas fases iniciais dos carcinomas de tipo I.
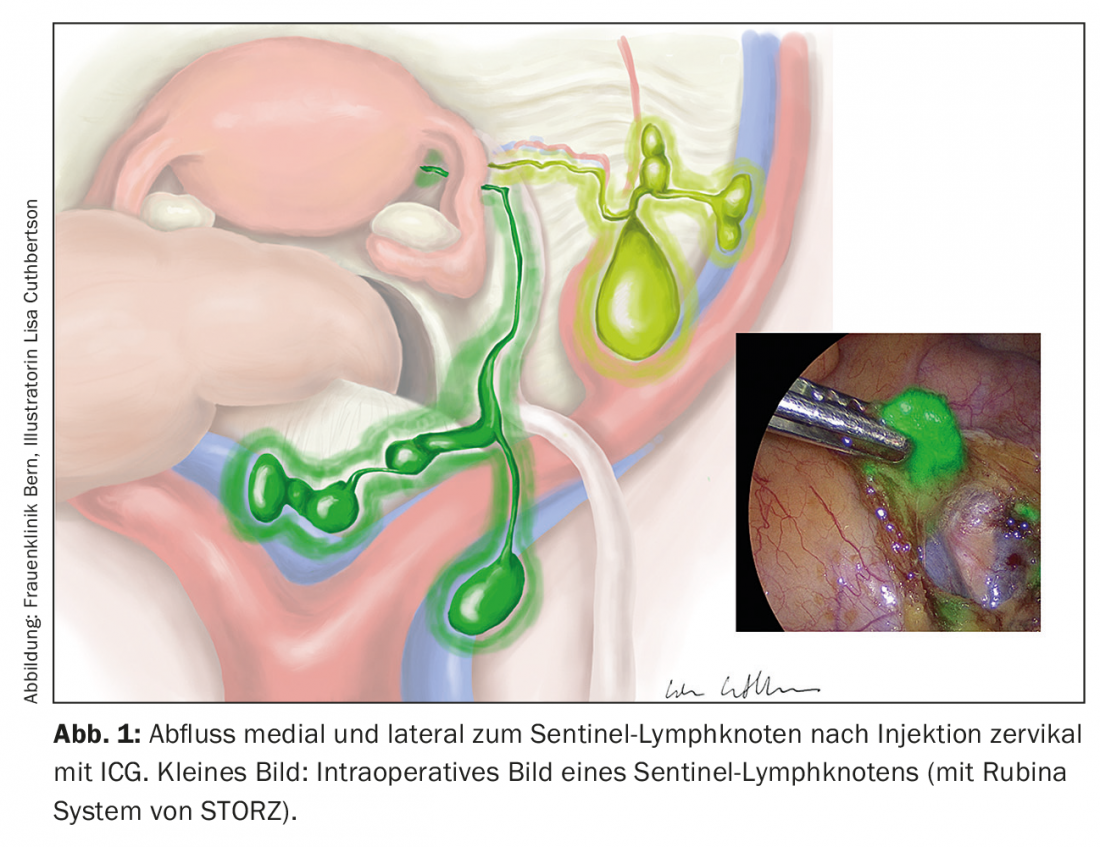
O conceito de excisão do gânglio linfático sentinela foi agora investigado em muitos estudos. O verde indocianina é aplicado cervical ou peritumoralmente e pode ser visualizado intra-operatoriamente usando uma técnica de imagem quase infravermelha (Fig. 1). A técnica não aumenta a morbilidade e a taxa de detecção é superior a 90%, com uma taxa de falsos positivos de 5%. O exame imuno-histoquímico por ultra-sons dos gânglios linfáticos sentinela negativos pode ter um benefício adicional ao visualizar as micrometástases [6–8]. Em situações de alto risco, contudo, a excisão do gânglio linfático sentinela ainda é indicada apenas no contexto de estudos.
A terapia de preservação da fertilidade só é considerada na fase IA após ter sido excluída a infiltração miométrica. Após informação explícita, uma terapia de progestogénio (minipílula ou DIU de progestogénio) é administrada durante seis meses, seguida do desejo de ter um filho. Uma vez cumprida esta condição, a encenação cirúrgica deve ter lugar.
Sarcomas uterinos
Com uma incidência de 1,5-3/100 000, os sarcomas são encontrados com uma frequência significativamente menor do que os carcinomas endometriais, com um aumento significativo da mortalidade. A taxa de sobrevivência de 5 anos é inferior a 50%. Os sarcomas podem ter origem no miométrio, tecido conjuntivo uterino ou estroma endometrial. A OMS distingue entre leiomiossarcoma (60-70%), estroma endometrial de grau baixo ou alto (10% cada), sarcoma uterino indiferenciado (10%), adenosarcoma e a variante maligna do PEComa (tumor epitélioide perivascular ) (ambos significativamente menos comuns). Os factores de risco incluem a descendência africana, a toma de tamoxifen e uma mutação da linha germinal no gene TP53, também chamada síndrome de Li-Fraumeni.
Clinicamente, os sarcomas apresentam frequentemente hemorragias vaginais, mas um útero em rápido crescimento pode também ser um sinal da presença de um sarcoma. A histeroscopia, bem como outros procedimentos de imagem, como um exame de ressonância magnética, podem dar indicações de um sarcoma, mas não o podem excluir. Os sarcomas são frequentemente encontrados como um achado incidental durante as miomectomias ou histerectomias, que acarretam o risco de distribuição de células malignas e assim pioram o prognóstico. Informar o doente antes de cada operação é hoje em dia uma norma. Em caso de suspeita clínica, a técnica cirúrgica deve ser ajustada em conformidade.
A terapia do leiomiossarcoma inclui uma histerectomia total. Uma adnexectomia e uma linfonodectomia pélvica sistemática e para-aórtica não são indicadas principalmente no caso de uma baixa incidência de metástases nesta área, a menos que haja anomalias intra-operatórias [9]. Ainda não há provas suficientes de terapia adjuvante após a ressecção de R0. A quimioterapia adjuvante com doxorubicina ou uma combinação de gemcitabina e docetaxel são opções individuais sem recomendações claras. A radioterapia adjuvante deve ser discutida em caso de ressecção cirúrgica incompleta. Em situações metastáticas primárias, a doxorubicina é utilizada. A administração de inibidores da aromatase pode prolongar a sobrevivência sem progressão após a confirmação da expressão do receptor hormonal.
No sarcoma endometrial de baixo grau, o prognóstico é bom, com uma taxa de sobrevivência de 5 anos de 80-90%. Se o estado do receptor hormonal for positivo, isto pode ser melhorado por adnexectomia bilateral ou terapia endócrina adjuvante a partir da fase III.
O sarcoma estromal endometrial de alto grau e os sarcomas uterinos indiferenciados têm um prognóstico inadequado com uma sobrevivência global mediana de 1-3 anos. Há uma recomendação terapêutica clara para histerectomia total com adnexectomia bilateral. A radioterapia percutânea é recomendada para as fases I e II. Não existem dados suficientes sobre quimioterapia ou terapia endócrina.
Carcinoma do colo do útero
Na Suíça, há cerca de 250 novos casos de carcinoma cervical por ano. Através do rastreio e, no futuro, também através da vacinação contra o HPV, esperamos uma nova diminuição destes números. Infelizmente, o cancro do colo do útero ainda é responsável por cerca de 1% de todas as mortes por cancro. A fase do tumor de acordo com a FIGO no diagnóstico tem uma grande influência na sobrevivência global de 5 anos. Isto é 21% na fase IV e 95% na fase I. Os factores de risco incluem a persistência de infecção por HPV de alto risco com possível displasia cervical, bem como imunossupressão, abuso de nicotina, má higiene sexual, mudança de parceiros sexuais e utilização a longo prazo de contraceptivos orais. Clinicamente, esta neoplasia também se manifesta frequentemente através de hemorragia típica (pós-coital) ou alteração do flúor vaginal.
O carcinoma espinocelular dependente de HPV é responsável por até 80% dos casos de carcinoma cervical. Os restantes 20% são em grande parte compostos por carcinomas adenosquâmicos e adenocarcinomas. Os subtipos histológicos menos comuns são mistos, neuroendócrinos, serosos, papilares e carcinomas celulares claros.
O diagnóstico é feito após uma Papanicolau anormal por confirmação histológica sob a forma de uma biópsia portio ou curetagem endocervical. As condições locais podem ser avaliadas por ultra-sonografia transvaginal, ultra-sonografia renal para excluir hidronefrose, e ressonância magnética ou exame anestésico por cistoscopia e/ou rectoscopia. O PET-CT é utilizado na suspeita primária de metástases distantes ou em situações de recorrência. O estadiamento clínico primário no cancro do colo do útero foi complementado em 2018 por uma combinação de imagiologia e envolvimento dos gânglios linfáticos na classificação actualizada da FIGO [10]. O envolvimento dos gânglios linfáticos paraaórticos não pode ser diagnosticado com sensibilidade suficiente utilizando PET-CT, razão pela qual o estatuto nodal deve ser determinado principalmente cirurgicamente no decurso da linfonodectomia sentinela, que tem uma sensibilidade de 91,4% com uma especificidade de 100%. No caso da fase tumoral T1a1 sem invasão linfovascular, remoção completa por conização e carcinoma microinvasivo, não é necessária a linfonodectomia sentinela. Nesses casos, uma simples conização ou histerectomia pode ser suficiente.
A cirurgia ou radiochemoterapia pode ser considerada como terapia primária. Até à fase do tumor FIGO IIA, recomenda-se a ressecção cirúrgica primária por histerectomia radical aberta. A indicação de uma ovariectomia depende do tipo histológico e do estado menopausal.
O estudo prospectivo e randomizado do LACC publicado em 2018 comparou o resultado após uma histerectomia radical minimamente invasiva com o resultado após a laparotomia. O tamanho do tumor ≥2 cm mostrou um resultado pior em termos de intervalo sem recorrência, uma maior taxa de recorrência locorregional e também uma sobrevivência global significativamente menor em comparação com a histerectomia radical aberta. Se as células tumorais são dispersas pelo manipulador uterino utilizado durante a laparoscopia ou pelainflação de CO2 não foi esclarecido pelo estudo [11].
A radiochemoterapia é o padrão de cuidados a partir da fase IIB ou se houver evidência de prolapso dos gânglios linfáticos após a linfonodectomia paraaórtica. A radioterapia percutânea com administração simultânea de quimioterapia com cisplatina como radiossensibilizador é realizada antes da braquiterapia intravaginal. Estudos sobre histerectomia secundária após quimioterapia neoadjuvante não mostraram qualquer vantagem.
Em casos seleccionados, recomenda-se a radioterapia adjuvante com quimioterapia após tratamento cirúrgico primário. Isto aplica-se a ressecções R1, infiltrações parametriais, metástases linfonodais e factores de risco (L1, V1, G3, tamanho do tumor >4 cm). A indicação de braquiterapia vaginal deve ser discutida em casos de infiltração vaginal, grandes tumores, bem como em situações de L1 extensas. A terapia paliativa envolve principalmente quimioterapia com carboplatina e taxol, combinada com bevacizumab. Os inibidores Checkpoint também podem ser utilizados aqui.
Conclusão
Em resumo, os tumores uterinos incluem entidades bastante diferentes e são tratados de forma diferente em conformidade. O diagnóstico exacto para a classificação é crucial. Os marcadores moleculares são cada vez mais importantes, tanto para a classificação dos riscos como para o ajustamento das terapias adjuvantes.
Mensagens Take-Home
- Os tumores uterinos compreendem diversas entidades cuja gestão difere significativamente. O diagnóstico cuidadoso para classificar e categorizar o risco é crucial para assegurar o melhor cuidado possível para cada indivíduo.
- O significado clínico dos marcadores moleculares está a aumentar; a partir deste ano, estes fazem parte da classificação de risco ESMO-ESGO-ESTRO do carcinoma endometrial. Os marcadores moleculares permitem não só uma avaliação mais precisa do prognóstico, mas também a utilização orientada de opções de tratamento inovadoras, tais como inibidores de pontos de controlo, especialmente para tumores avançados.
- O carcinoma endometrial é um dos malignos ginecológicos mais comuns e é diagnosticado em 75% dos casos na pós-menopausa. Manifesta-se normalmente por hemorragia vaginal e é favorecida por um excesso de estrogénio, entre outras coisas com a terapia de tamoxifeno. Em caso de hemorragia pós-menopausa e endométrio ≥3 mm, uma pipeta ou histeroscopia com curetagem deve ser realizada em qualquer caso para confirmação histológica.
- Os sarcomas uterinos são menos comuns do que os carcinomas endometriais, mas têm um prognóstico mais pobre. O uso de Tamoxifen é também um dos factores de risco aqui. As miomectomias e histerectomias comportam o risco de distribuição maligna de células, razão pela qual a técnica cirúrgica deve ser adaptada em conformidade em caso de suspeita clínica.
- O prognóstico do carcinoma cervical varia muito dependendo da fase do tumor.
- Em fases iniciais até ao FIGO IIA, a histerectomia radical aberta com ou sem ovariectomia é o tratamento de primeira escolha. A partir da fase IIB ou se houver evidência de prolapso dos gânglios linfáticos, a radiochemoterapia é utilizada principalmente. Uma histerectomia secundária não traz qualquer vantagem.
Literatura:
- Allen NE, et al: Menopausal hormone therapy and risk of endometrial carcinoma among postmenopausal women in the European Prospective Investigation Into Cancer and Nutrition. Am J Epidemiol. 2010; 172(12): 1394-1403.
- Win AK, Reece JC, Ryan S: História familiar e risco de cancro endometrial: uma revisão sistemática e meta-análise. Obsteto Gynecol. 2015; 125(1): 89-98.
- Kandoth C, et al.: Paisagem mutante e significado através de 12 tipos principais de cancro. Natureza, 2013; 502(7471): 333-339.
- Morice P, et al: Cancro endometrial. Lanceta. 2016 ; 387(10023): 1094-1108.
- Concin N, et al: ESGO / ESTRO / ESP guidelines for the management of patients with endometrial carcinoma. Virchows Arch. 2021; 478(2): 153-190.
- Rossi EC, et al: Uma comparação da biopsia do gânglio linfático sentinela com a linfadenectomia para o estadiamento do cancro endometrial (ensaio FIRES): um estudo multicêntrico, prospectivo, de coorte. Lancet Oncol. 2017; 18(3): 384-92.
- Papadia A, et al: Mapeamento Laparoscópico do Nódulo Linfático de Sentinela Verde Indocianina em Cancro Endometrial. Ann Surg Oncol. 2016; 23(7): 2206-2211.
- Imboden S, et al: Segurança oncológica e morbilidade perioperatória em cancro endometrial de baixo risco com dissecção do gânglio linfático sentinela. Eur J Surg Oncol. 2019; 45(9): 1638-1643.
- Kapp DS, Shin JY, Chan JK: factores prognósticos e sobrevivência em 1396 doentes com leiomiossarcomas uterinos: ênfase no impacto da linfadenectomia e ooforectomia. O cancro. 2008; 112(4): 820-830.
- Bhatla N, et al: Realização revista do FIGO para o carcinoma do colo do útero. Int J Gynecol Obstet. 2019; 145(1): 129-135.
- Ramirez PT, et al: Histerectomia minimamente invasiva versus histerectomia radical abdominal para o cancro do colo do útero. N Engl J Med 2018; 379(20): 1895-1904.
InFo ONCOLOGy & HEMATOLOGy 2021; 9(3): 10-13