Os doentes com gamopatia monoclonal de significado pouco claro (MGUS) correm um risco acrescido de desenvolver certas formas de cancro. Através de controlos regulares, as alterações podem ser detectadas numa fase precoce e as medidas de tratamento necessárias podem ser tomadas a tempo. Em qualquer caso, é importante adaptar a gestão ao risco individual, a fim de evitar incertezas desnecessárias.
MGUS caracteriza-se pela detecção de imunoglobulinas monoclonais aumentadas, completas ou incompletas, no soro de um paciente. Estes são normalmente determinados como “paraproteína” ou “M-proteína” na electroforese do soro. Ao contrário do mieloma múltiplo, porém, não há sinais de doença como hipercalcemia, insuficiência renal, anemia e lesões ósseas. Embora o MGUS não seja uma doença, pode ser o precursor de uma doença maligna associada a uma proliferação de células plasma monoclonais, tais como o mieloma múltiplo, a doença de Waldenström ou o linfoma não-Hodgkin. Muitas vezes, a principal dificuldade na gestão é identificar correctamente os pacientes com elevado risco de progressão.
Delimitação e definição
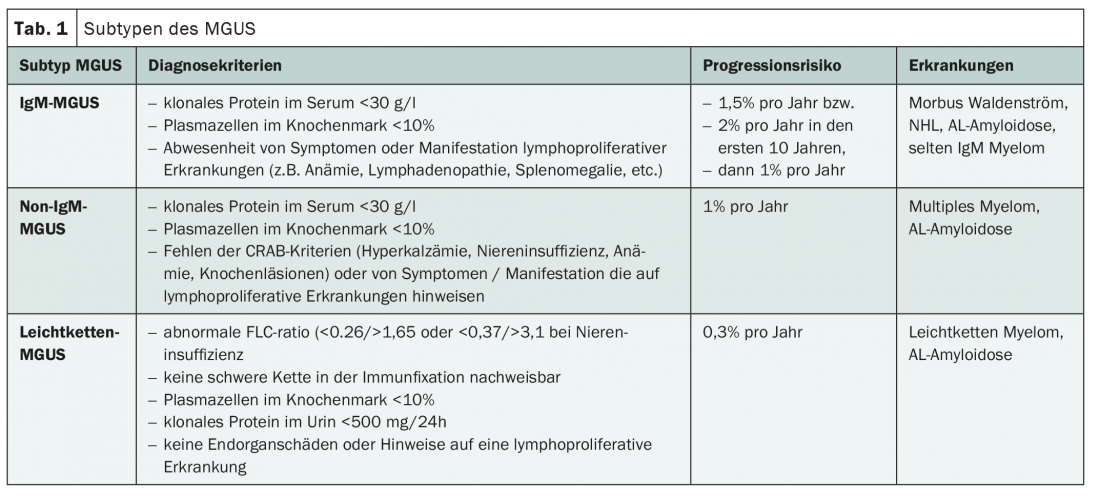
MGUS é definido por uma proteína sérica IgM inferior a 30 g/l, menos de 10% de células linfoplasmáticas clonais na medula óssea e a ausência de sintomas sugestivos de mieloma múltiplo ou outro linfoma de células B. Após o diagnóstico, deve ainda ser esclarecido se um mieloma de plasmócitos já se encontra eventualmente presente. Se isto for excluído, o MGUS é dividido em três subtipos (tab. 1).
Diagnóstico
Para além de uma história médica cuidadosa e de um exame físico, os diagnósticos básicos incluem um hemograma, determinação da proteína total e albumina no soro e determinação quantitativa de IgG, IgA e IgM no sangue. Se os critérios para um MGUS forem cumpridos, devem seguir-se mais investigações. Neste caso, outros sintomas sugestivos de mieloma múltiplo que requerem tratamento devem ser activamente procurados e descartados. Estes incluem hipercalcemia, anemia, insuficiência renal e lesões ósseas – também conhecidas pela sigla CRAB. A determinação laboratorial de electrólitos (sódio, potássio, cálcio) e valores renais (creatinina incluindo a taxa de filtração glomerular calculada e a ureia) desempenha um papel importante na análise de parâmetros relevantes. Uma vez que as paraproteínas também podem ser depositadas como amilóide, e a amiloidose que se desenvolve subsequentemente afecta principalmente o coração e os rins, o BNP e o NT-proBNP também devem ser determinados.
Factores de risco e terapia
Se houver suspeita de uma doença mais grave, são necessários mais exames. Estes também são necessários se um MGUS de alto risco estiver presente. Os factores de risco mais comuns para a progressão do MGUS estão resumidos no quadro 2. No caso de MGUS de baixo risco, por outro lado, não são necessários mais exames e muitas vezes são mesmo contraproducentes, pois podem causar incerteza desnecessária entre os afectados.

Em contraste com o mieloma múltiplo, o MGUS não é tratado. Os controlos regulares podem detectar uma transição para uma doença que requer tratamento numa fase precoce. Segundo o Prof. Jacob Passweg, chefe de hematologia do Hospital Universitário da Basileia, isto deve ser feito seis meses após o diagnóstico inicial. Se os valores laboratoriais não se deterioraram nestes seis meses, o intervalo pode ser prolongado até doze meses. Os doentes de alto risco, por outro lado, devem ser acompanhados de seis em seis a 24 meses. Especialmente devido ao curso frequentemente indolente, os doentes em risco devem ser cuidadosamente identificados e informados. Por um lado, é importante evitar doenças secundárias. Por outro lado, evitar a incerteza é também muito importante.
Fonte: “Monoclonal Gamopathy of Unclear Signance (MGUS)”, palestra do Prof. Jakob Passweg no virtual SGAIM Spring Congress 2021, 19.05.2021
InFo ONCOLOGY & HEMATOLOGY 2021; 9(3): 24-25 (publicado 16.6.21, antes da impressão).