As queratoses actínicas (QA) estão associadas ao carcinoma de células escamosas, mas pouco se sabe sobre o risco de progressão de lesões individuais. No entanto, a carcinogénese de campo ou um maior número de lesões e a extensão da hiperproliferação de células queratinocíticas atípicas parecem ser factores relevantes. Uma ferramenta boa e prática para avaliar a gravidade da QA e avaliar o sucesso do tratamento é a pontuação AKASI. Atualmente, o diagnóstico de QA pode ser confirmado por procedimentos modernos não invasivos.
As queratoses actínicas (QA) estão entre as dermatoses mais comuns na pele cronicamente danificada pelo sol. Trata-se de lesões cutâneas pré-cancerosas resultantes da proliferação de queratinócitos atípicos na pele danificada pelos raios UV, que afectam sobretudo o rosto, o couro cabeludo sem pêlos e as extremidades. De acordo com dados epidemiológicos, a prevalência de QA em pessoas com mais de 60 anos de idade situa-se entre 20-35% [1–3].
A QA é uma doença pré-cancerosa facultativa
Um estudo de coorte com um período de seguimento de 5 anos mostrou que 65% dos carcinomas de células escamosas (CEC) surgiram de lesões de QA pré-existentes [4]. Noutro estudo, a probabilidade de progressão para CEC no prazo de 10 anos em doentes com uma média de 7,7 AK foi relatada como sendo de cerca de 10% [19].
“Os estudos de sequenciação do genoma confirmam que as queratoses actínicas são lesões pré-cancerosas”, afirma a Prof.ª Dr.ª Nicole Kelleners-Smeets do Centro Médico da Universidade de Maastricht (NL) [5]. A conclusão de um grande estudo de genética molecular utilizando a sequenciação do exoma foi que a QA é caracterizada por alterações genómicas que também ocorrem no CEC, incluindo anomalias na via de transdução do sinal TGF-β [6]. Também em consonância com outros estudos, foram igualmente detectadas mutações no TP53 e no NOTCH. A inativação mutacional precoce do NOTCH1 nas QA pode facilitar a progressão das QA para CEC [6]. O TP53 é um gene supressor de tumores cujo produto genético (proteína p53) funciona como um fator de transcrição. É ativado por stress celular, por exemplo, danos no ADN induzidos por UV. Embora exista um conjunto crescente de provas sobre os factores que favorecem a progressão para CEC, continua a ser difícil avaliar quais as lesões de QA que apresentam um risco elevado e quais as que irão regredir. O orador sublinhou que o tratamento das QA pode prevenir o desenvolvimento do CEC.
| O risco de progressão de AK para SCC está estimado entre 0,025% e 16% para uma única lesão por ano. De acordo com isto, as taxas de transformação para um doente com 6-8 lesões são de 0,15-80% por ano [9]. Atualmente, a base de provas para os factores de prognóstico que determinam a transição de QA para CEC é ainda insuficiente [9]. Estudos recentes indicam que o estadiamento prévio das QA e a estimativa do risco de progressão devem ser reconsiderados [13,14]. Tendo em conta a ocorrência de QA no contexto da cancerização do campo e uma correlação positiva entre o número de lesões e a probabilidade de progressão, são propostos novos critérios de avaliação dos estádios das QA [9]. O AKASI (índice de área e gravidade da queratose actínica) é atualmente uma ferramenta significativa para avaliar a gravidade das QA, mas também para avaliar o sucesso do tratamento [12]. |
Utilize métodos não invasivos para diagnosticar as QA
De acordo com a atual diretriz S3, a indicação para a terapêutica das QA deve ser feita em sinopse do quadro clínico e dos factores de risco (por exemplo, imunossupressão, exposição cumulativa aos raios UV, número de lesões) [9]. Histologicamente, uma caraterística da QA é a acumulação de queratinócitos atípicos no estrato basal da epiderme, de onde podem progredir ao longo do tempo para o estrato granuloso e o estrato córneo [16,17]. Os queratinócitos alterados da QA apresentam núcleos aumentados, pleomórficos, hipercrómicos e um rácio nuclear-citoplasmático elevado [9]. Enquanto no passado eram necessários exames histopatológicos para identificar alterações pré-cancerosas na pele, atualmente estão disponíveis várias técnicas de diagnóstico não invasivas, nomeadamente a dermatoscopia, a microscopia confocal de reflexão (RCM) e a tomografia de coerência ótica (OCT) ou OCT de campo linear, explicou o Prof. Dr. Giuseppe Micali, da Universidade de Catania (I) [7]. A dermatoscopia tem uma elevada sensibilidade (cerca de 98%) e especificidade (cerca de 95%) para a deteção de QA, de acordo com o orador [7]. No entanto, a QA pigmentada é por vezes difícil de diferenciar clínica e dermatoscopicamente de outras lesões cutâneas, como o lentigo maligno. Para além da dermatoscopia, a MCR é outra técnica de diagnóstico não invasiva. A MCR permite a visualização do substrato citomorfológico das estruturas dermatoscópicas suspeitas a nível celular [8]. A pele danificada pela luz mostra frequentemente um padrão atípico em favo de mel numa carcinização de campo como sinal de QA subclínica [9]. Uma nova técnica de imagiologia não invasiva é a LC-OCT. Ao obter imagens de células individuais numa resolução elevada com uma profundidade de penetração de até 500 μm, a precisão do diagnóstico pode ser significativamente aumentada.
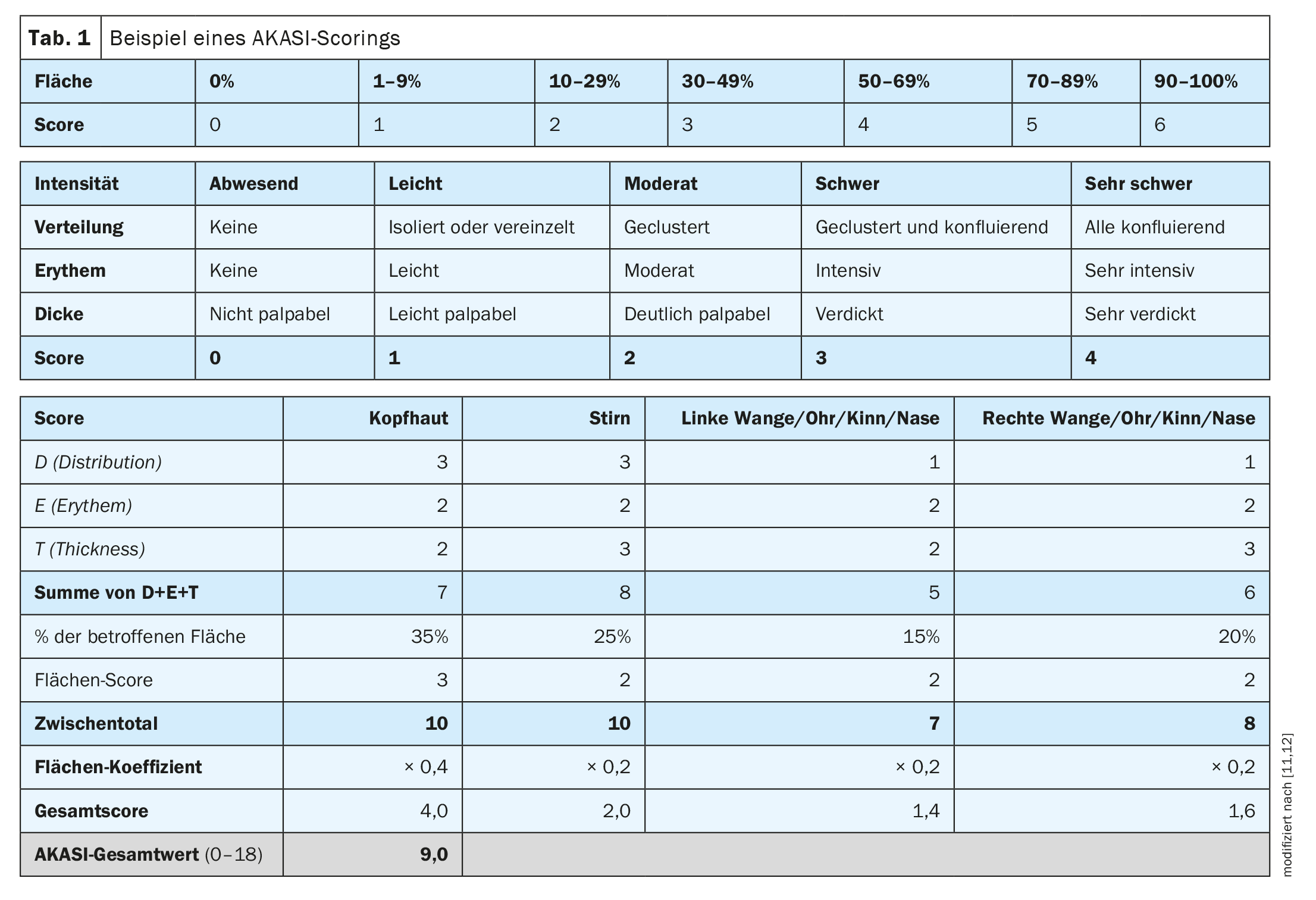
AKASI como ferramenta de avaliação da gravidade
Na prática clínica, também é importante avaliar a gravidade das queratoses actínicas como base para as decisões terapêuticas, afirma o Dr. Girish Gupta, dermatologista e professor clínico sénior da Universidade de Edimburgo (Reino Unido) [10]. “Sabemos que os carcinomas de células escamosas estão associados às QA”, explicou o orador [10]. O AKASI (“Actinic keratoses activity and severity index”) foi desenvolvido para avaliar e monitorizar a gravidade [12]. “Talvez possamos utilizar a pontuação AKASI para avaliar o risco”, diz o Dr. Gupta. O facto de o AKASI ser um instrumento muito bom para avaliar objetivamente a gravidade das QA também corresponde à opinião do Prof. Dr. Thomas Dirschka, Centroderm Klinik Wuppertal (D) [11,12]. O AKASI permite uma quantificação simples das lesões (Tab. 1) [11,12]. Num estudo publicado em 2018 por Schmitz et al. investigou se e como a pontuação AKASI está associada a tumores queratinocíticos [18]. A conclusão foi que os doentes com um ecrã AKASI >7 têm provavelmente um risco mais elevado de desenvolver CEC invasivo em comparação com os doentes com AK com uma pontuação mais baixa.
Relativamente aos métodos não invasivos descritos, o Prof. Dirschka destacou a LC-OCT como um método de diagnóstico muito bom para detetar lesões potencialmente perigosas. As secções horizontais e verticais, bem como os aspectos histológicos, são visualizados em tempo real.
O risco de transformação maligna está correlacionado com o número de lesões
“O objetivo mais importante é evitar a progressão para CEC”, afirmou o Prof. Dirschka, acrescentando: “Precisamos de terapias para os doentes de alto risco” [11]. Quanto maior for o número de lesões, maior é o risco de uma das lesões evoluir para CEC. Por conseguinte, o número de lesões e o campo de carcinização desempenham um papel importante no risco de progressão, afirmou o orador. Neste contexto, questiona a limitação da área a tratar (25 cm2). O risco de uma única QA evoluir para CEC no espaço de um ano é referido na literatura como sendo de 0,025-16%, embora pouco se saiba sobre o risco de progressão nesta altura [9]. Mas o risco é maior com um maior número de lesões, diz o Prof. Dirschka. Assumindo que o risco de progressão de uma única lesão de QA é de 16% por ano, isto significa que com 40 lesões o risco correspondente é superior a 99% [11].
Abordagem pragmática – que objectivos terapêuticos são visados?
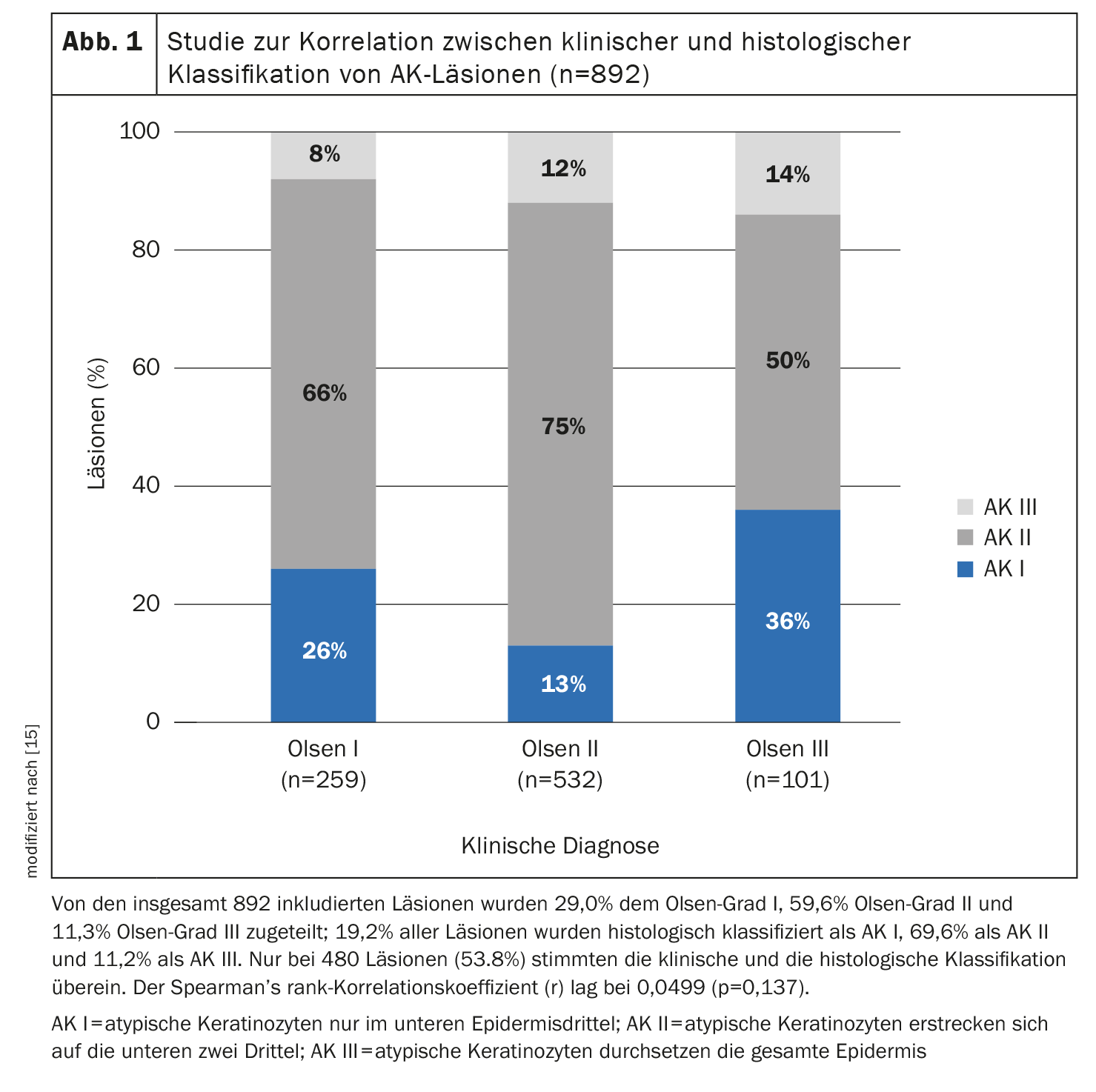
A extensão da proliferação basal das células queratinocíticas atípicas é um critério importante, diz o Prof. Dirschka [11]. Não considera que as restrições de tratamento baseadas na classificação de Olsen, que foram introduzidas no contexto de ensaios clínicos, sejam úteis para a prática clínica quotidiana. Por um lado, num estudo, a classificação de Olsen estava apenas relativamente ligeiramente correlacionada com a classificação histopatológica das lesões de QA (espessura da lesão) (Fig. 1) e, por outro lado, havia lesões Olsen I com muita hiperproliferação e lesões Olsen III com pouca hiperproliferação. Do seu ponto de vista, a localização das zonas também está ultrapassada. É importante que não se concentre exclusivamente no rosto e no couro cabeludo, mas também nas extremidades. Por último, o orador salienta que a ausência total de lesões é um objetivo de tratamento bastante irrealista na cancerização de campo e que é preferível visar uma redução da pontuação AKASI. Além disso, deve estar atento às lesões resistentes ao tratamento, uma vez que são potencialmente perigosas.
Literatura:
- Ferrándiz C, et al.: EPIQA Study Group; Prevalence of actinic keratosis among dermatology outpatients in Spain. Actas Dermosifiliogr 2016; 107(8): 674–680.
- Flohil SPC, et al: Prevalência de queratose actínica e seus factores de risco na população em geral: o Estudo de Roterdão. J Invest Dermatol 2013; 133(8): 1971-1978
- Eder J, et al.: Prevalence of actinic keratosis among dermatology outpatients in Austria. Br J Dermatol 2014; 171(6): 1415–1421.
- Criscione VD, et al.: Actinic keratoses: natural history and risk of malignant transformation in the veterans affairs topical tretinoin chemoprevention trial. Cancer 2009; 115(11): 2523–2530.
- «Biology of AK», Symposium 8: Management of actinic keratosis and field cancerization, Prof. Dr. Nicole Kelleners-Smeets, EADO Annual Meeting, 20–22 April 2023.
- Thomson J, et al.: The Genomic Landscape of Actinic Keratosis. J Invest Dermatol 2021; 141(7): 1664–1674.e7.
- «Imaging technologies as diagnostic tools for AK», Symposium 8: Management of actinic keratosis and field cancerization, Dr. Giuseppe Micali, EADO Annual Meeting, 20–22 April 2023.
- Ahlgrimm-Siess V, et al.: Diagnostischer Nutzen der Konfokalmikroskopie als weiterführende Untersuchungsmethode von Gesichtsläsionen. JDDG 2019; 17(3): 266–274.
- AWMF: S3-Leitlinie Aktinische Keratose und Plattenepithelkarzinom der Haut. Register-Nr. 032-022OL, Version 2.0: https://register.awmf.org, (letzter Abruf 04.07.2023)
- «Treatment Update – AK», Dr. Girish Gupta, Symposium 8: Management of actinic keratosis and field cancerization, EADO Annual Meeting, 20–22 April 2023.
- «New approaches to study design in AK», Prof. Dr. Thomas Dirschka, Symposium 8: Management of actinic keratosis and field cancerization, EADO Annual Meeting, 20–22 April 2023.
- Dirschka T, et al; Athens AK Study Group: A proposed scoring system for assessing the severity of actinic keratosis on the head: actinic keratosis area and severity index. J Eur Acad Dermatol Venereol 2017; 31(8): 1295–1302.
- Dirschka T, et al.: A proposed scoring system for assessing the severity of actinic keratosis on the head: actinic keratosis area and severity index. J Eur Acad Dermatol Venereol 2017; 31(8): 1295–1302.
- Dreno B, et al.: A Novel Actinic Keratosis Field Assessment Scale for Grading Actinic Keratosis Disease Severity. Acta dermato-venereologica 2017; 97(9): 1108–1113.
- Schmitz L, et al.: Actinic keratosis: correlation between clinical and histological classification systems. J Eur Acad Dermatol Venereol 2016; 30(8): 1303–1307.
- Babilas P, Landthaler M, Szeimies RM: Die aktinische Keratose. Hautarzt 2003; 54: 551–562.
- Fu W, Cockerell CJ: The actinic (solar) keratosis: a 21st-century perspective. Arch Dermatol 2003; 139: 66–70.
- Schmitz L, et al.: Actinic keratosis area and severity index (AKASI) is associated with the incidence of squamous cell carcinoma. J Eur Acad Dermatol Venereol 2018; 32(5): 752–756.
- Marks R, Rennie G, Selwood TS: Malignant transformation of solar keratoses to squamous cell carcinoma. Lancet 1988; 1: 795–797.
DERMATOLOGIE PRAXIS 2023; 33(4): 28–30