Na artrite reumatóide, o sistema imunitário ataca a membrana sinovial do sinóvio. Se não for tratado, há um risco de destruição gradual das articulações. Os DMARD são portanto utilizados para cursos severos. As análises ómicas de tipos de células individuais proporcionam novos conhecimentos sobre o processo da doença. Entre outras coisas, o foco está na investigação sobre a actividade das células T e diferentes tipos de macrófagos de tecido como base para novas estratégias de tratamento. Os resultados actuais e dos estudos foram comunicados por ocasião da conferência anual da Sociedade Alemã de Reumatologia (DGRh) .
Para uma compreensão diferenciada da doença e das opções de tratamento dela derivadas, a investigação sobre os complexos eventos moleculares que têm lugar a nível celular é muito informativa. Os avanços nas tecnologias de alto rendimento (“ómica”) tornaram possíveis observações a nível genómico, transcriptómico e regulamentar de várias moléculas biológicas (caixa). O desenvolvimento de abordagens terapêuticas contra a artrite reumatóide beneficiou muito com os resultados da investigação básica nas últimas décadas. “Os reumatologistas podem agora influenciar bem o curso da doença injectando ou infundindo vários anticorpos biológicos do Abatacept ao Rituximab”, explica o porta-voz do grupo de trabalho da Rede de Competência em Reumatismo, Prof. Ulf Wagner, MD, do Hospital Universitário de Leipzig [1]. Mais recentemente, drogas sintéticas como o baricitinibe ou tofacitinibe, que podem ser tomadas em comprimidos, foram adicionadas. “Os novos medicamentos tornam o tratamento mais suportável para muitos doentes”, diz o perito.

Desenvolver mais o princípio terapêutico de modulação da actividade das células T
A activação de células T autoreactivas é de importância patogénica central em doenças auto-imunes, tais como a artrite reumatóide. Estão envolvidos na cascata inflamatória influenciando outras células imunitárias e produzindo um certo número de citocinas pró-inflamatórias. Com base nestas descobertas, foram desenvolvidos vários conceitos para o bloqueio terapêutico das células T. Estes visam eliminar em grande parte as células T do processo da doença ou influenciar a sua função de tal forma que os seus efeitos patogénicos sejam retardados. O Abatacept (Orencia®) é um modulador da actividade das células T que tem sido utilizado terapeuticamente há algum tempo. O mecanismo de acção consiste em bloquear especificamente a via de sinalização CD28-CD80/CD86 [2,3]. CD28 é uma das moléculas costimulatórias mais proeminentes, expressa por cerca de metade das células T. O CD28 tem dois ligandos, CD80 e CD86, que são expressos na superfície de várias células que apresentam antigénios de uma forma dependente da activação. Além disso, “cytotoxic T-lymphocyte-associated antigen 4” (CTLA-4) é também expresso em células T de uma forma dependente de activação e também se liga a CD80 e CD86. Contudo, em contraste com o CD28, o CTLA-4 abranda a activação das células T através da inibição da proliferação e da produção de citocinas e pode, portanto, ser considerado como um antagonista do CD28.
A modulação das células T nocivas é também o foco de uma nova estratégia de tratamento actualmente em investigação. “Presumimos actualmente que no início da doença há uma perda de auto-tolerância, que normalmente impede as células T de atacarem as células do próprio corpo na membrana sinovial”, diz o Prof. Ulf Wagner, MD [1]. “As células T começam a atacar as células sinoviais e fazem com que as células B produzam anticorpos, dos quais o factor reumatóide é o exemplo mais conhecido”. De acordo com o perito, os estudos ómicos mostram que o metabolismo das células T muda completamente no decurso da doença. Por exemplo, o fornecimento de energia é mudado da glicólise para a via do fosfato pentose. “Estes processos metabólicos alterados podem proporcionar possibilidades completamente novas de influenciar terapeuticamente doenças auto-imunes inflamatórias crónicas”, explica o Prof. Wagner. “O nosso objectivo deve ser transformar as ‘más’ células T em ‘boas’ células T e parar o processo da doença logo no início”. O futuro mostrará se esta abordagem de tratamento se estabelecerá e conduzirá ao lançamento no mercado das substâncias activas correspondentes.
Macrófagos teciduais como parte da cascata inflamatória
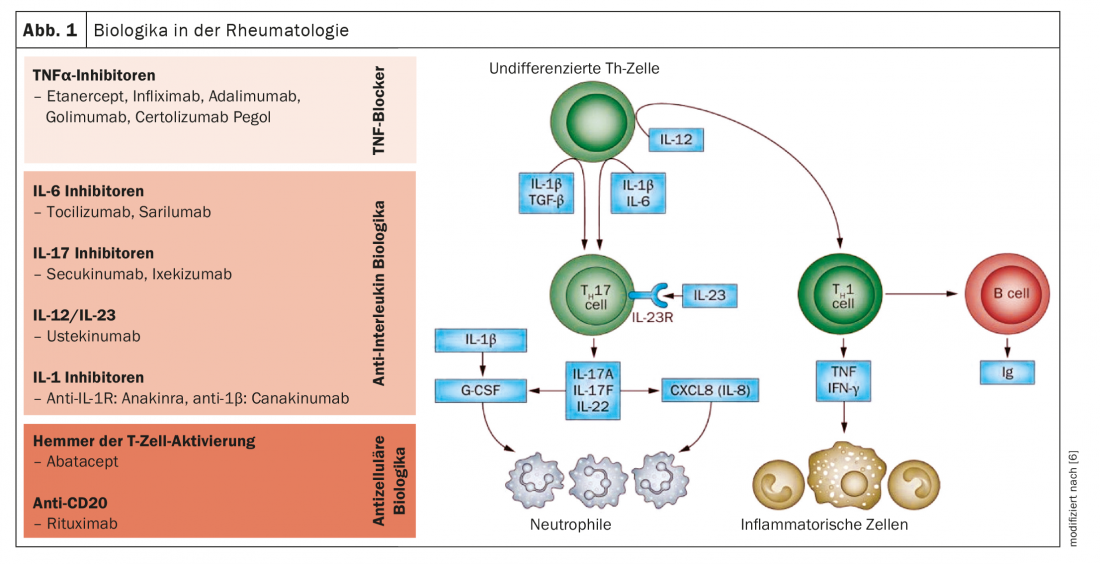
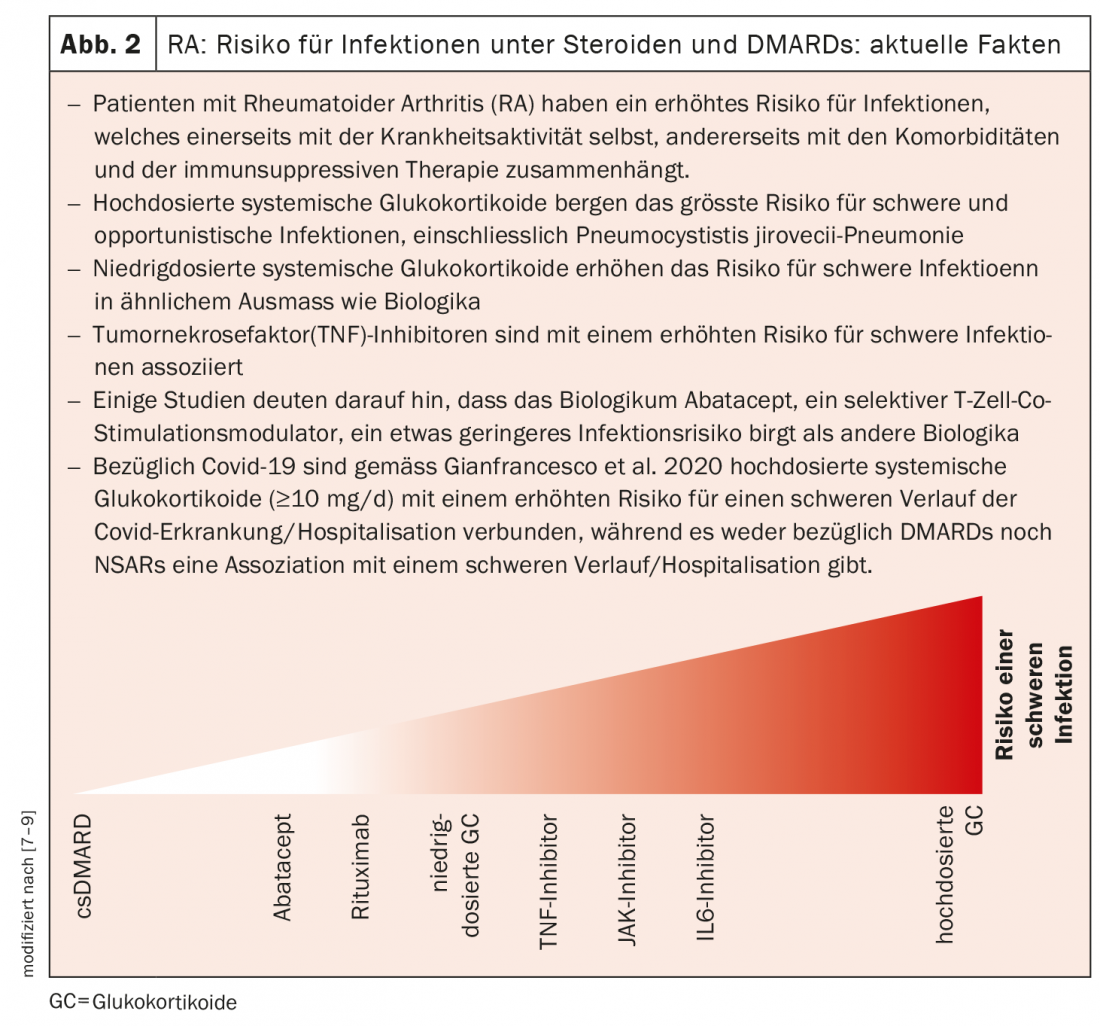
Os anticorpos biológicos e as drogas sintéticas aprovadas até à data bloqueiam as citocinas ou os seus receptores, que são libertados pelas células do sistema imunitário como parte dos processos inflamatórios (Fig. 1 e 2) . Entretanto, a investigação básica tem-se voltado para as diferentes células inflamatórias que produzem estas citocinas. Métodos ómicos mais recentes, tais como sequenciação de RNA de célula única, perfil de ribossomas, ou espectrometria de massa, permitem pela primeira vez uma visão das células individuais. “As investigações mostram que grupos celulares se comportam de forma diferente em doentes com reumatismo do que em pessoas saudáveis e que, portanto, estão provavelmente envolvidos no processo da doença”, explica o Prof. Wagner [1]. Combinando diferentes tecnologias ómicas, é possível obter uma imagem mais completa da expressão genética, da quantidade de proteínas ou de diferentes processos intracelulares. Um dos actores centrais na artrite reumatóide são os macrófagos de tecido, que também estão presentes na membrana sinovial em pessoas saudáveis. “A investigação quer esclarecer o que faz com que estas células libertem as citocinas inflamatórias e como isto pode ser evitado”, diz o perito.
MerTK-negativo e CD206- macrófagos de tecido negativo como alvo
Os investigadores de base descobriram, por exemplo, que existem dois grupos de macrófagos de tecido que se distinguem pelos marcadores de superfície MerTK e CD206. Um estudo recente publicado na Nature Medicine descobriu que os macrófagos tecidulares negativos MerTK e CD206 produzem uma gama de citocinas e alarminas pró-inflamatórias, promovendo respostas inflamatórias na membrana sinovial [4]. Em contraste, os macrófagos de tecido positivo MerTK e CD206 parecem inibir as respostas inflamatórias. Estas células encontram-se principalmente em doentes cuja inflamação diminuiu completamente. O Prof. Wagner explica: “A ideia de uma abordagem terapêutica seria colocar os macrófagos de tecido num estado dormente permanente com medicamentos e, assim, parar a doença a longo prazo”.
Congresso: Conferência Anual da DGRh
Literatura:
- “Artrite reumatóide: análise de células únicas permite novas perspectivas sobre o processo da doença – novas abordagens terapêuticas esperadas”, Congresso Alemão de Reumatologia, 16.09.2021
- Swissmedicinfo: Orencia®, www.swissmedicinfo.ch (último acesso 18.11.2021)
- Graninger W, Emminger W, Scheinecker C: J Med Drug Rev 2013; 3: 44-60.
- Alivernini S, et al: Nat Med 2020; 26(8): 1295-1306.
- Rosenstiel P, Franke A, Schreiber S: Previsão e tratamento individual da inflamação crónica. www.systembiologie.de (última chamada 18.11.2021)
- Mihai C: Rheumatism Workshop, Carmen-Marina Mihai, MD, 23.09.2021; www.usz.ch/app/uploads/2021/09/CMihai_NW-Biologika_RheumaWorkshop_Sept21.pdf (último acesso 18.11.2021)
- Tamborrini G: Risco de infecção sob DMARDs e esteróides, Semanário 2021, www.rheuma-schweiz.ch (último acesso 18.11.2021).
- Riley TR, et al: Risco de infecções com glicocorticóides e DMARD em pacientes com artrite reumatóide, RMD Open 2021: online.
- Gianfrancesco M, et al: Ann Rheum Dis 2020; 79: 859-866.
InFo DOR & GERIATURA 2021; 3(2): 30-31
PRÁTICA DO GP 2021; 16(12): 20-22