A modulação dos receptores S1P é um alvo terapêutico importante e interessante na gestão do tratamento da esclerose múltipla, devido à sua diversidade funcional. Actualmente, estão disponíveis três moduladores de receptores S1P para pacientes com RRMS e um para pacientes com SPMS. Nenhum dos moduladores dos receptores S1P mostrou um efeito negativo na cognição e fadiga.
A esclerose múltipla (EM) é uma doença neurológica comum que leva à desmielinização e aos danos axonais através da inflamação crónica do sistema nervoso central (SNC) [1]. A maioria das pessoas afectadas (cerca de 85%) tem inicialmente um curso de recaída-remitente (RRMS), que no decurso da doença se transforma numa fase secundária crónica progressiva [2]. O RRMS é definido por recaídas com sintomas clínicos novos ou crescentes. Segue-se uma fase de remissão parcial ou completa. Durante as fases de remissão, a progressão da doença não é evidente [1,2].
O diagnóstico da EM requer provas objectivas de um evento inflamatório no SNC e provas adicionais de uma propagação espacial e temporal do processo da doença (disseminação no espaço e no tempo). Os testes paraclínicos mais importantes para confirmar o diagnóstico são a ressonância magnética (MRI) e o exame do líquido cefalorraquidiano (LCR) [3].
Existe agora um consenso de que as recaídas por si só não são significativas em termos do processo da doença e do seu desenvolvimento. Assim, o número de recidivas dá pouca informação sobre a quantidade de danos estruturais e funcionais que estão realmente presentes. Além disso, a perda de volume cerebral, que pode ocorrer muito cedo no decurso da doença, não está necessariamente associada à actividade de empuxo. Do ponto de vista patológico, os danos dos tecidos activos na EM estão associados à inflamação. Além disso, outros mecanismos como o stress oxidativo que conduz a danos mitocondriais estão provavelmente envolvidos na indução da desmielinização e da neurodegeneração, tanto nas fases de recaída como nas fases progressivas da EM [4]. Como nem o RR nem a fase progressiva da EM têm características patológicas ou mecanicistas distintas, as diferenças quantitativas em vez de qualitativas entre estas fases parecem ser responsáveis pelo fenótipo predominante que resulta [4,5]. A moderna terapia de esclerose múltipla hoje em dia visa o diagnóstico precoce e o uso precoce de drogas modificadoras da progressão, a fim de influenciar o mais favoravelmente possível a progressão da deficiência numa fase inicial [1,2,6].
Fadiga e problemas cognitivos
Contudo, não é apenas a progressão física da incapacidade que coloca grandes desafios aos doentes afectados e aos médicos que os tratam. Na vida quotidiana, são principalmente sintomas tais como fadiga e problemas cognitivos. Estima-se que 75-95% de todos os pacientes com EM sofrem de fadiga e 40-50% de deficiência cognitiva [7]. Ambos os sintomas têm efeitos graves na participação social, na capacidade profissional e na qualidade de vida em geral [7,8]. É importante incluir os sintomas acima mencionados na avaliação da progressão e registá-los regularmente, uma vez por ano, com instrumentos sensíveis, independentemente do EDSS [9]. Isto permite avaliar o respectivo indivíduo no curso longitudinal. Na cognição, há provas de que os doentes que já apresentam anomalias cognitivas no diagnóstico correm um risco acrescido de patologia agressiva com grave progressão da incapacidade [10]. A partir disto, um algoritmo terapêutico melhor adaptado ao caso individual poderia ser derivado logo no início.
Uma vez que a fadiga é o sintoma que, juntamente com as perturbações cognitivas, é responsável pela reforma antecipada e invalidez, deve ter-se cuidado ao escolher imunoterapia para que não sejam utilizados fármacos que se espera que intensifiquem os sintomas.
Curso de modificação de terapias
As opções de tratamento modificadoras da doença são conhecidas como terapias modificadoras da doença (DMT) e podem ser administradas como comprimidos, cápsulas, injecções ou infusões. O objectivo é reduzir tanto a taxa anual de recidivas como a progressão. Estão disponíveis preparativos com diferentes modos de acção. Neste trabalho, concentramo-nos nos moduladores de receptores S1P. Na Suíça, quatro preparações desta classe de medicamentos estão actualmente aprovadas – fingolimod, ozanimod e ponesimod para RRMS, siponimod como o único modulador de receptores S1P para pacientes com SPMS [11–14].
Receptores de esfingosina-1-fosfato
As esfingosinas são componentes estruturais da membrana celular a partir da qual muitos lípidos bioactivos são formados, tais como o S1P. Este é um metabolito lipídico bioactivo multifuncional que actua como molécula de sinalização solúvel e circula no sangue e no sistema linfático [15]. O S1P está envolvido numa variedade de processos fisiológicos e fisiopatológicos através da sua interacção com os receptores S1P, que são receptores de superfície celular de alta afinidade G-coupled de células encontradas em todo o corpo [16].
S1P tem uma afinidade de ligação para cinco subtipos diferentes de receptores S1P através dos quais os sinais celulares são transduzidos. Os receptores S1P1, S1P2 e S1P3 são expressos de forma omnipresente, tendo cada subtipo uma especificidade celular diferente. Em contraste, a expressão dos receptores S1P4 e S1P5 está menos difundida. Os receptores S1P4 são restritos ao tecido linfóide e hematopoiético e os receptores S1P5 encontram-se no baço e na matéria branca do SNC, principalmente nos oligodendrócitos (Tab. 1) [17].
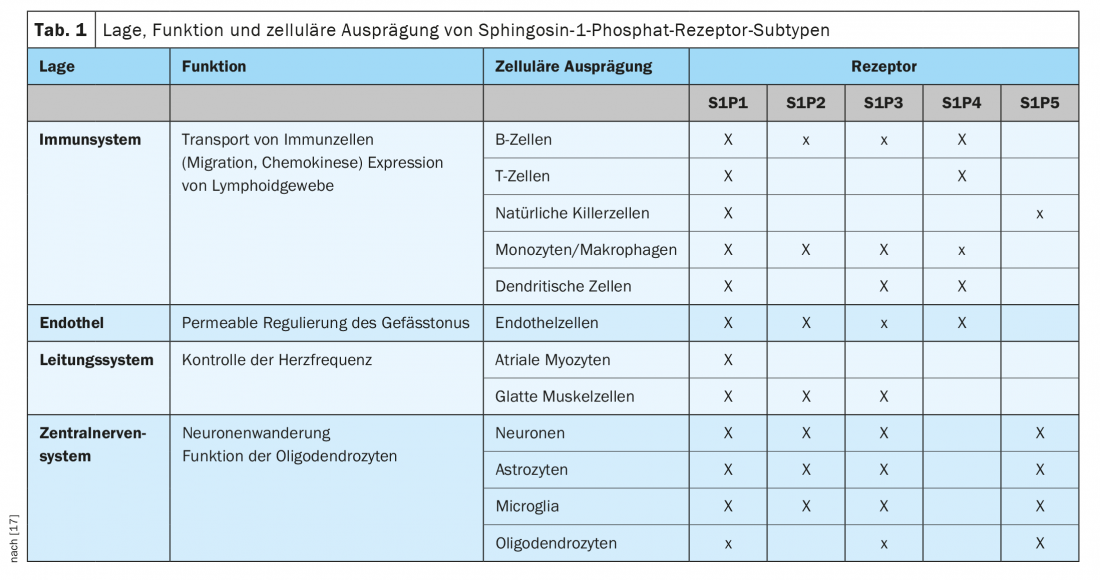
Assim, os receptores S1P estão envolvidos em muitas funções biológicas, incluindo proliferação celular, angiogénese, organização citoesquelética, quimiotaxia das células endoteliais, transporte de células imunitárias e mitogénese. Desempenham também um papel no desenvolvimento do cérebro e do coração, na proliferação de células da pele, na permeabilidade vascular e na regulação do tónus vascular e brônquico [18]. Esta diversidade funcional torna a modulação dos receptores S1P um alvo terapêutico interessante e importante.
O desenvolvimento de moduladores S1PR
Os moduladores de receptores S1P podem agir tanto como antagonistas funcionais como agonistas tradicionais, dependendo do subtipo ou subtipos de receptores S1P visados, e podem ter uma especificidade variável [19]. Estas são pequenas moléculas para administração oral. O principal mecanismo imunológico dos moduladores do receptor S1P baseia-se na regulação da migração linfocitária através da interacção com o receptor S1P1. Este mecanismo baseia-se num gradiente de concentração de S1P, que é fisiologicamente mais elevado no sangue do que nos tecidos linfáticos. Quando o ligante liga o receptor às células que expressam o receptor de quimiocina C-C (CCR7), o receptor S1P1 é internalizado e degradado, resultando numa perda de capacidade de resposta ao gradiente S1P. Consequentemente, os linfócitos são retidos no timo e nos órgãos linfóides secundários, o que resulta num menor número de linfócitos no sangue periférico e limita a migração de células inflamatórias [20].
Alguns dos moduladores dos receptores S1P actuam como pró-fármacos (fingerolimod) que requerem fosforilação ou outras etapas metabólicas para serem convertidos no composto farmacologicamente activo, enquanto outros são medicamentos directamente activos (siponimod, ozanimod, ponesimod). Portanto, apesar de um mecanismo de acção comparável, os moduladores S1PR têm propriedades farmacocinéticas diferentes (Tab. 2) [21]. A fim de tomar uma decisão terapêutica à medida, é portanto essencial considerar as preparações da classe de substâncias activas de uma forma diferenciada.
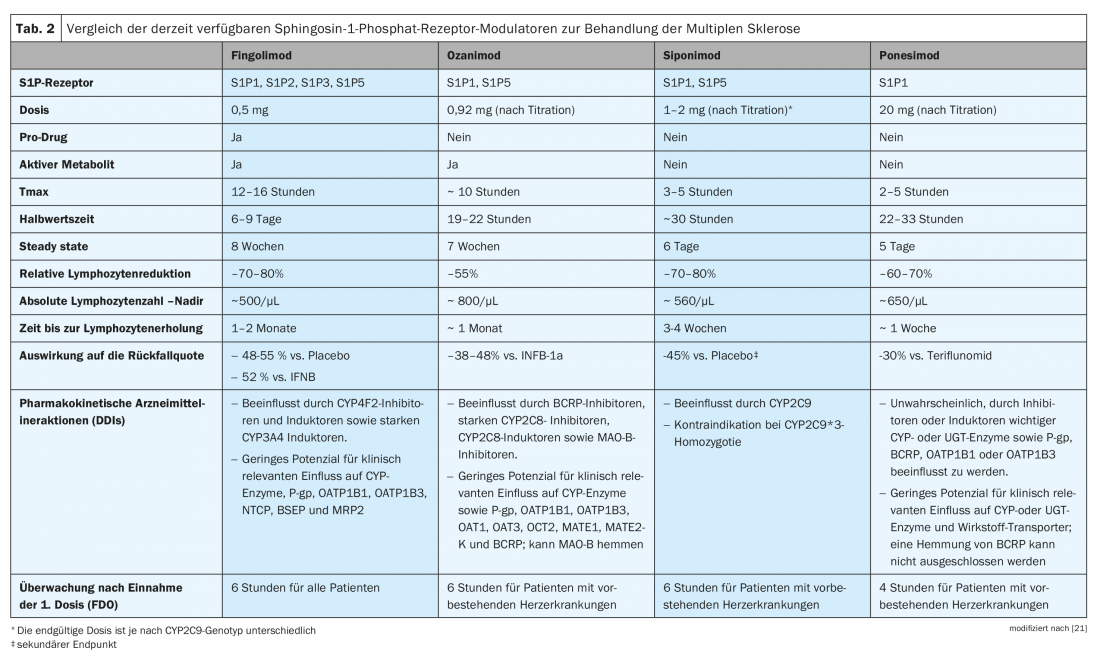
Moduladores S1PR num relance
Fingolimod (FTY) foi o primeiro modulador S1PR aprovado para terapia RRMS. O cloridrato de dedalimod pró-fármaco é estereoselectivamente fosforilado ao metabolito activo (S)-fingolimod fosfato principalmente no fígado por esfingosina kinase-2 (SphK-2). Este é um análogo de S1P. A modulação dos receptores leva a uma desregulação dos receptores na superfície celular e reduz a sensibilidade ao ligante endógeno. Bloqueia assim a saída de linfócitos dos gânglios linfáticos para a corrente sanguínea periférica e reduz o número de linfócitos no sangue para 20-30% do valor inicial. Uma vez que a activação de S1PR3 pode levar a um efeito agonístico inicial nas células cardíacas, causando bloqueios atrioventriculares (AV), deve ser feita uma avaliação exaustiva antes de se iniciar a terapia. O doente deve ser avaliado para bradicardia, QT longo, bloqueio AV e outros factores de risco de arritmia e monitorizado durante seis horas após a primeira administração. -Além disso, as condições pré-existentes devem ser excluídas. As enzimas hepáticas, o hemograma e a pressão sanguínea devem ser constantemente monitorizados. Se os linfócitos caírem abaixo dos 200/ml, é indicada uma interrupção do tratamento. Níveis elevados de enzimas hepáticas poderiam ser abordados com uma redução da dose para fingerolimod de dois em dois dias. No entanto, isto pode resultar numa eficácia reduzida. Especialmente em pacientes mais jovens e em pacientes que mudaram de natalizumab, há um risco de efeitos de ricochete com um aumento do risco de recaídas e actividade radiológica [22,23].
Dados de estudo comparando o fingolimod com placebo ou interferon beta 1a mostraram uma redução nas recidivas de cerca de 50% e uma redução no desenvolvimento de lesões cerebrais novas ou em expansão de 74% em [24–26]. Além disso, foi demonstrada uma influência favorável no desempenho cognitivo, medido com o PASAT-3, com o fingolimod em comparação com o placebo [27]. No entanto, verificou-se que o modulador S1PR também aumenta o risco de vírus do herpes e infecções criptocócicas, com o risco a aumentar com uma duração de tratamento mais longa e idade mais avançada [28]. Outras complicações potencialmente graves podem incluir danos hepáticos com elevação da transaminase, cancro da pele como o carcinoma basocelular, e complicações oculares (por exemplo, edema macular, hemorragia da retina e oclusão da veia da retina).
O Siponimod foi aprovado na Suíça em 2020 para o tratamento da síndrome clinicamente isolada, esclerose múltipla recorrente-remitente e esclerose múltipla progressiva secundária activa [29,30]. Este inibidor de S1PR liga-se selectivamente aos subtipos S1PR1 e S1PR5. A droga evita assim a migração de linfócitos dos gânglios linfáticos e reduz a recirculação de células T para o sistema nervoso central (SNC) para limitar a inflamação no SNC. A hipótese por detrás disto assume menos efeitos fora do alvo do que com o fingolimod [30]. Análoga ao fingolimod, condições pré-existentes tais como olhos, ritmo cardíaco e doenças hepáticas graves devem ser verificadas e o estado de vacinação actualizado (por exemplo, varicela). Outras possíveis complicações associadas à imunossupressão induzida incluem um risco acrescido de infecções e cancro da pele. Possíveis efeitos secundários no início da terapia (por exemplo bradicardia, bloqueio AV) podem ser reduzidos com a ajuda de um esquema de titulação. Isto prevê a administração de 0,25 mg/dia nos dias 1 e 2, seguido de 0,5 mg no dia 3, 0,75 mg no dia 4, 1,25 mg no dia 5, seguido de uma dose de manutenção de 2 mg/dia. De notar que o siponimod é metabolizado principalmente por CYP2C9. Uma variante menos comum desta enzima (CYP2C9*3) reduziu a actividade metabolizadora. Por esta razão, os heterozigotos para CYP2C9*3 devem receber metade da dose de manutenção, enquanto a homozigotosidade é uma contra-indicação ao tratamento com siponimod [32].
Em comparação com placebo, observou-se uma redução do número de lesões que aumentam o contraste na ponderação T1 e lesões T2 novas ou recentemente aumentadas aos 6 meses (84% para siponimod 10 mg, 80% para siponimod 2 mg e 58% para siponimod 0,5 mg) [30]. Além disso, foi também demonstrada uma redução significativa na progressão da incapacidade em doentes com SPMS [29]. Em particular, os doentes mais jovens, aqueles com um EDSS mais baixo na linha de base, duração mais curta da doença na linha de base e sinais de actividade inflamatória aguda respondem bem ao tratamento [31].
Vale também a pena notar que os pacientes que recebem terapia siponimod mostraram um benefício na velocidade de processamento da informação, tal como medida pelo SDMT. Isto mostrou não só um atraso de deterioração cognitiva, mas também uma melhoria cognitiva clinicamente relevante no prazo de 6 meses [33].
Ozanimod foi também aprovado para o tratamento de RRMS e, tal como o siponimod, liga-se selectivamente aos subtipos S1PR1 e S1PR5, evitando a fuga de linfócitos de órgãos linfóides secundários [34]. Em doentes sem sintomas cardíacos actuais/preexistentes, não é necessária nenhuma observação inicial da dose quando o fármaco é subtraído (0,23 mg nos dias 1-4, 0,46 mg nos dias 5-7, depois 0,92 mg uma vez por dia).
Os resultados do estudo mostram uma menor taxa de recidivas anualizadas, um menor número de lesões gadolínicas anualizadas, lesões T2 novas ou em aumento e uma menor taxa de atrofia cerebral com um perfil de segurança favorável em comparação com o interferão beta-1a [35]. No entanto, a progressão da deficiência era comparável entre os grupos. Semelhante ao siponimod, também foram encontrados efeitos positivos na velocidade cognitiva (SDMT) com ozanimod [36].
Ponesimod foi aprovado para adultos com esclerose múltipla em recidiva activa desde Novembro de 2020, o que o torna a mais recente adição a esta classe de medicamentos. O modulador S1PR1 com alta afinidade para S1PR1 tem uma meia-vida curta de 32 horas [37]. Depois de parar o tratamento, a contagem de linfócitos normaliza-se no prazo de sete dias. A monitorização da dose inicial é necessária em doentes com doenças/condições cardíacas actuais ou pré-existentes, uma vez que o início do tratamento com Ponvory resulta numa redução transitória da frequência cardíaca e das anomalias da condução atrioventricular (AV).
A eficácia do ponesimod já foi estabelecida num estudo de fase II de determinação da dose e mais tarde confirmada num RCT de fase III maior. Em comparação com o placebo, o tratamento com ponesimod (10 mg, 20 mg e 40 mg) atingiu o objectivo primário de reduzir o número cumulativo de novas lesões com gadolínio num estudo de fase II em doentes com RRMS [38]. Bradicardia transitória e bloqueio atrioventricular ocorreram em 2% dos participantes cada um. A dispneia ou os efeitos secundários respiratórios foram registados de forma dose-dependente [38]. Ponesimod também demonstrou ser superior a um comparador activo (teriflunomida) em termos de fadiga [39].
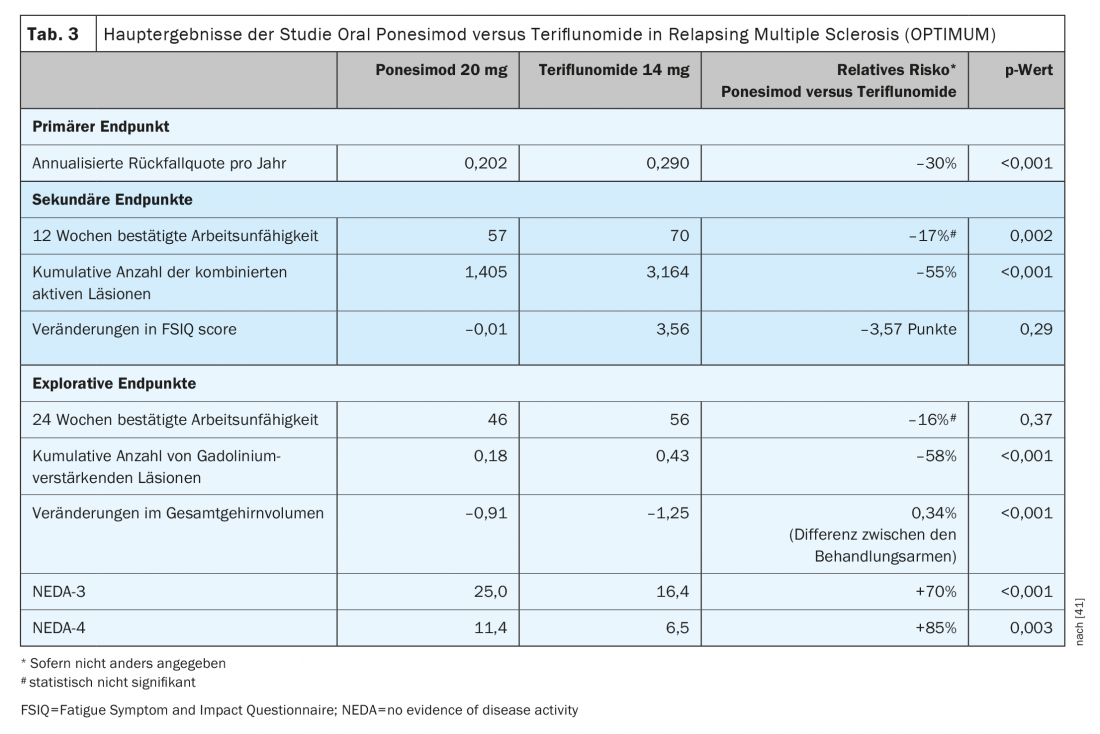
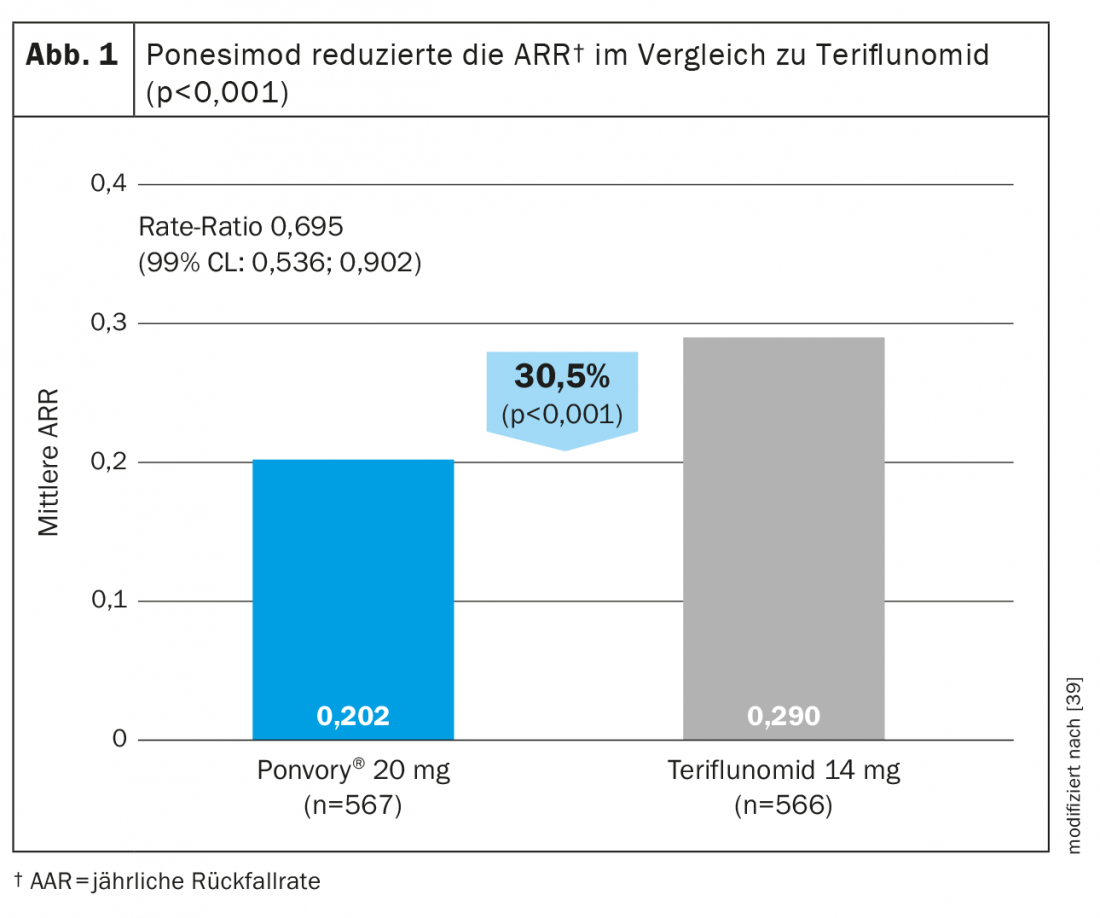
Ponesimod é o primeiro DTM oral aprovado a ser avaliado contra outro agente oral estabelecido para o tratamento da esclerose múltipla recorrente-remitente. Ponesimod 20 mg foi comparado com teriflunomida num estudo de fase III (OPTIMUM) em doentes com esclerose múltipla recorrente-remitente (Tabela 3) [39]. O ponto final primário foi a taxa de recidivas anuladas durante o período de estudo. Os parâmetros secundários incluíram o número de novas lesões T1 com gadolínio e o número de lesões T2 novas ou hiperintensas, desde a linha de base até à semana 108, e o tempo até 3 meses de progressão confirmada da incapacidade. Os parâmetros exploratórios considerados foram pacientes sem recaída e variação percentual média no volume cerebral da linha de base para a semana 108.
O estudo mostrou que o ponesimod conseguiu uma redução 30,5% maior na ARR em comparação com a teriflunomida (Fig. 1) . Para além da actividade de ressonância magnética e da perda de volume cerebral, a fadiga foi também melhor reduzida com o ponesimod em comparação com o teriflunomida comparador activo [38]. Em termos de redução da progressão confirmada da deficiência, a eficácia foi comparável em ambos os grupos de teste [39].
A proporção de doentes com pelo menos um evento adverso emergente (TEAE) ou evento adverso grave (SAE) foi também comparável em ambos os grupos de tratamento. A maioria das ETE eram leves a moderadas e não levaram à descontinuação do tratamento. Os efeitos secundários mais comuns no grupo ponesimod foram: A elevação de ALT, nasofaringite, dor de cabeça, infecção do tracto respiratório superior e hipertensão. O efeito benéfico de ponesimod 20 mg na doença de EM foi mantido durante cerca de oito anos sem que fossem detectados quaisquer novos efeitos secundários [40].
Globalmente, os efeitos de tratamento de ponesimod parecem ser consistentes com os de outros moduladores de receptores S1P, sem preocupações de segurança inesperadas, mas isto deve ser interpretado com cautela na ausência de estudos comparativos cabeça a cabeça.
Ao contrário do fingolimod, mas semelhante ao ozanimod e ao siponimod, o regime de up-titration de ponesimod minimiza o efeito no ritmo cardíaco e no ritmo AES na primeira dose de modo a que não seja necessária uma monitorização cardiovascular prolongada no início do tratamento. Além disso, a característica de uma meia-vida mais curta de ponesimod em comparação com o fingolimod pode ser uma vantagem em caso de vacinação ou gravidez e no tratamento dos efeitos secundários [41].
Conclusão
A classe de moduladores S1PR oferece uma nova opção eficaz e excitante para a gestão do tratamento da EM. Embora os preparativos actualmente aprovados se baseiem no mesmo mecanismo de acção, diferem no seu tratamento e perfil. A fim de tomar uma decisão terapêutica individualmente adaptada, informações tais como farmacodinâmica, farmacocinética, medidas necessárias antes e no início da terapia, bem como durante a terapia e possíveis interacções medicamentosas devem, portanto, ser tidas em conta.
Mensagens Take-Home
- A modulação dos receptores S1P é um alvo terapêutico importante e interessante devido à sua diversidade funcional.
- Actualmente, estão disponíveis três moduladores de receptores S1P para pacientes com RRMS e um para pacientes com SPMS.
- Fingolimod actua em S1P1, S1P2, S1P3 e S1P5.
- Siponimod, ozanimod e ponesimod actuam especificamente sobre S1PR1 e S1PR5.
- Em doentes com EM sem sintomas cardíacos actuais/preexistentes, não é necessária qualquer observação com a administração inicial de ozanimod e ponesimod.
- A semi-vida mais curta do siponimod, ozanimod e ponesimod ajuda os linfócitos a recuperar mais rapidamente após a interrupção do tratamento.
- Os moduladores dos receptores S1P acima mencionados não demonstraram afectar negativamente a cognição e a fadiga.
Literatura:
- Aktas O, et al: Diagnosis of multiple sclerosis: revision of the McDonald criteria 2017. Neurologist 2018; 89: 1344-1354.
- www.nationalmssociety.org/What-is-MS/Types-of-MS/Relapsing-remitting-MS (último acesso 01.09.2022)
- Thompson AJ, Banwell BL, Barkhof F, et al: Diagnóstico de esclerose múltipla: revisões de 2017 dos critérios McDonald. Lancet Neurol 2018;1 7(2): 162-173.
- Lassmann H: Lesões corticais na esclerose múltipla: inflamação versus neurodegeneração. Cérebro. 2012; 135(Pt 10):2904-2905.
- Tobin WO, Kalinowska-Lyszczarz A, Weigand SD, et al: Clinical correlation of multiple sclerosis immunopathologic subtypes. Neurologia. 2021; 97(19): e1906-e1913.
- Baecher-Allan C, et al: Esclerose Múltipla: Mecanismos e Imunoterapia. Neuron 2018; 97(4): 742-768.
- Penner IK: Avaliação da cognição e fadiga na esclerose múltipla: prática diária e direcções futuras. Acta Neurologica Scandinavica 2016; 134 (Sup. 200): 19-23.
- Kobelt, et al: Novos conhecimentos sobre o fardo e os custos da esclerose múltipla na Europa. Mult Scler. 2017; 23(8): 1123-1136.
- Penner IK, Warnke C: Desordens cognitivas na esclerose múltipla. DGNeurologia 2021; 3: 184-186.
- Pitteri et al: A deficiência cognitiva prevê a progressão da deficiência e o desbaste cortical na EM: Um estudo de 8 anos. Mult Scler. 2017; 23(6):848-854.
- Gilenya® SmPC, a partir de: Novembro de 2020. www.swissmedicinfo.ch
- Zeposia® SmPC, em: Julho de 2020. www.swissmedicinfo.ch
- Ponvory® informação sobre o produto, a partir de Novembro de 2021. www.swissmedicinfo.ch
- Mayzent® informação sobre o produto, a partir de: Outubro de 2020. www.swissmedicinfo.ch
- Rosen H, Germana Sanna M, Gonzalez-Cabrera PJ, Roberts E: A organização do sistema de sinalização de 1-fosfato de esfingosina. Curr Top Microbiol Immunol 2014; 378: 1-21.
- Kunkel GT, Maceyka M, Milstien S, Spiegel S: Atingir o eixo de esfingosina-1-fosfato no cancro, inflamação e mais além. Nat Rev Drug Discov 2013; 12(9): 688-702.
- Cartier A, Hla T: Esfingosina 1-fosfato: sinalização lipídica em patologia e terapia. Ciência. 2019;366(6463):eaar5551.
- Maceyka M, Harikumar KB, Milstien S, Spiegel S. Sphingosine-1-phosphate sinalização e o seu papel na doença. Trends Cell Biol 2012; 22(1): 50-60.
- Subei AM, Cohen JA: Moduladores de receptores de 1-fosfato de esfingosina em esclerose múltipla. CNS Drugs 2015; 29(7): 565-575.
- Chaudhry BZ, Cohen JA, Conway DS: Moduladores de receptores de esfingosina 1-fosfato para o tratamento da esclerose múltipla. Neurother J Am Soc Exp Neurother 2017; 14(4): 859-873.
- Pérez-Jeldres T, Alvarez-Lobos M, Rivera-Nieves J: Apontar a sinalização de esfingosina-1-fosfato em doenças imunomediadas: para além da esclerose múltipla. Drogas. 2021; 81(9):985-1002.
- Zecca C, et al: Meia dose de fingerolimod para o tratamento da esclerose múltipla recorrente-remitente: Estudo observacional. Mult Scler 201; 24: 167-174.
- Yamout BI, Zeineddine MM, Sawaya RA, Khoury SJ: Segurança e eficácia do tratamento com dosagem reduzida de dedoimodo. J Neuroimmunol 2015; 285: 13-15.
- Kappos L, et al: Um ensaio controlado por placebo de dedo indicador oral em recidiva de esclerose múltipla. N Engl J Med 2010; 362: 387-401.
- Calabresi PA, et al: Segurança e eficácia do dedoimodo em pacientes com esclerose múltipla recorrente-remitente (FREEDOMS II): um ensaio de fase 3 duplo-cego, aleatorizado, controlado por placebo. Lancet Neurol 2014; 13: 545-556.
- Cohen JA, et al: Interferão oral ou intramuscular para recidiva de esclerose múltipla. N Engl J Med 2010; 362: 402-415.
- Langdon DW et al: Características de base e efeitos do dedo mindinho no desempenho cognitivo em pacientes com esclerose múltipla recorrente-remitente. Eur J Neurol 2021; 28(12):4135-4145.
- Fischer-Barnicol B, et al.: Combinação de teriflunomida e interferão como terapia de seguimento após a LPM associada ao dedo. Neurol Neuroimmunol Neuroinflamm 2021; 8. doi: 10.1212/NXI.0000000000000927
- Kappos L, et al: Siponimod versus placebo em esclerose múltipla progressiva secundária (EXPAND): um estudo duplo-cego, aleatorizado, fase 3. Lancet 2018; 391: 1263-1273.
- Selmaj K, et al: Siponimod para doentes com esclerose múltipla recorrente (BOLD): um estudo adaptativo, dose-ranging, randomizado, fase 2. Lancet Neurol 2013; 12: 756-767.
- Gajofatto A: Destaque para o siponimod e o seu potencial no tratamento da esclerose múltipla progressiva secundária: as provas até à data. Drug Des Devel Ther 2017; 11: 3153-3157.
- Huth F, Gardin A, Umehara K, He H: Prediction of the Impact of Cytochrome P450 2C9 Genotypes on the Drug-Drug Interaction Potential of Siponimod With Physiologically-Based Pharmacokinetic Modeling: A Comprehensive Approach for Drug Label Recommendations. Clin Pharmacol Ther 2019; 106:1113-1124.
- Gold, et al: Siponimod vs placebo em esclerose múltipla progressiva secundária activa: uma análise post hoc do estudo fase 3 EXPAND.J Neurol 2022; 269(9): 5093-5104.
- Lamb YN: Ozanimod: Primeira Aprovação. Drogas 2020; 80:841-848.
- Comi G, et al: Segurança e eficácia de ozanimod versus interferon beta-1a na esclerose múltipla recorrente (SUNBEAM): um ensaio multicêntrico, aleatório, mínimo de 12 meses, fase 3. Lancet Neurol 2019; 18: 1009-1020.
- De Luca J et al: Efeito de Ozanimod nas modalidades de Teste de Dígitos de Símbolo na Relapsing MS. Mult Scler Relat Disordord. 2021; 48:102673.
- D’Ambrosio D, Freedman MS, Prinz J: Ponesimod, um modulador selectivo de receptores S1P1: um tratamento potencial para a esclerose múltipla e outras doenças imuno-mediadas. Ther Adv Adv Chronic Dis 2016; 7: 18-33.
- Olsson T, et al: Oral ponesimod in relapsing-remitting multiple sclerosis: a randomised phase II trial. J Neurol Neurosurg Psychiatry 2014; 85: 1198-1208.
- Kappos L, Fox RJ, Burcklen M, et al: Ponesimod comparado com Teriflunomida em Pacientes com Esclerose Múltipla Relapsante na Fase 3 de Comparação Activa OPTIMUM Study: A Randomized Clinical Trial. JAMA Neurol 2021; 78(5): 558-567.
- Freedman MS, Pozzilli C, Havrdova EK, et al: Long-term Treatment With Ponesimod in Relapsing-Remitting Multiple Sclerosis: Results from Randomized Phase 2b Core and Extension Studies. Neurologia 2022 Jun 6;10.1212/WNL.00000000000000200606.
- Ruggieri S, Quartuccio ME, Prosperini L: Ponesimod no Tratamento de Formas de Esclerose Múltipla: Uma Actualização sobre os Dados Clínicos Emergentes. Degener Neurol Neuromuscul Dis 2022; 12: 61-73.
InFo NEUROLOGIA & PSYCHIATry 2022; 20(5): 12-18.