Os dados do atual estudo SEQUENCE foram apresentados na Semana Europeia Unida de Gastroenterologia (UEGW), que decorreu de 14 a 17 de outubro de 2023, e foram entretanto publicados [1,2]. In der randomisierten Phase-III-Head-to-Head-Studie wurde Risankizumab (SKYRIZI®) mit Ustekinumab zur Behandlung erwachsener Patient:innen mit mittelschwerem bis schwerem aktivem Morbus Crohn (CD, Crohn’s Disease) verglichen, bei denen eine oder mehrere Anti-TNF-Therapien versagt hatten [1]. O risankizumab atingiu todos os endpoints primários e secundários em comparação com o ustekinumab e demonstrou superioridade [1]. O SEQUENCE é, por conseguinte, o único estudo comparativo na doença de Crohn a demonstrar a superioridade de um medicamento biológico em relação a outro medicamento biológico.
A doença de Crohn é extremamente stressante para as pessoas afectadas: a inflamação subjacente pode causar lesões intestinais permanentes e restringir significativamente a qualidade de vida das pessoas afectadas [3, 4]. Na Suíça, estão disponíveis dois inibidores aprovados da interleucina (IL)-23 e da IL-12/-23, o risankizumab e o ustekinumab, respetivamente, para o tratamento da doença de Crohn [5, 6]. O risankizumab está aprovado na Suíça desde 14.09.2023 para o tratamento de doentes adultos com doença de Crohn ativa moderada a grave que tenham respondido inadequadamente à terapêutica convencional ou a um medicamento biológico, que tenham deixado de responder ou que não tenham tolerado a terapêutica [5]. Uma vez que o risankizumab conduz a uma remissão clínica e endoscópica significativa e pode, por conseguinte, contribuir para a cicatrização da mucosa, constitui um marco importante no panorama terapêutico da doença de Crohn [7, 8].
O estudo SEQUENCE em pormenor [1]
Mais de 500 doentes com incapacidade de resposta a um ou mais inibidores do TNF foram aleatorizados para 48 semanas de tratamento aberto com risankizumab (N=255, 3x 600 mg i.v. nas semanas 0, 4 e 8; 5x 360 mg s.c. nas semanas 12, 20, 28, 36 e 44) ou ustekinumab (N=265, 1x 260/390/520 mg i.v. na semana 0; 5x 90 mg s.c. nas semanas 8, 16, 24, 32 e 40) [1]. O primeiro endpoint primário foi a remissão clínica de acordo com o Índice de Atividade da Doença de Crohn < (CDAI), definido como CDAI 150 após 24 semanas, testado para não inferioridade. O segundo endpoint primário foi a remissão endoscópica de acordo com o Simple Endoscopic Score for Crohn’s Disease (SES-CD), definido como SES-CD ≤ 4 e pelo menos 2 pontos abaixo do valor basal após 48 semanas, testado para superioridade. Os resultados endoscópicos foram analisados numa leitura central cega. Os dados demográficos de base foram equilibrados em ambos os braços de tratamento [1].
O risankizumab cumpriu ambos os objectivos primários [1]
No ponto de leitura das 48 semanas, 90,2% dos doentes com risankizumab ainda estavam a participar no estudo, em comparação com 72,8% dos doentes com ustekinumab. Uma das principais razões para a descontinuação precoce no braço do ustekinumab foi a falta de eficácia em 13,2% dos doentes, enquanto apenas 2,0% dos doentes com risankizumab abandonaram o estudo por esta razão [1]. Ambos os endpoints primários do estudo foram atingidos (Fig. 1). Após 24 semanas, 58,6% dos pacientes no grupo do risankizumabe alcançaram remissão clínica em comparação com 39,5% dos pacientes com ustekinumabe, demonstrando a não-inferioridade do risankizumabe em relação ao ustekinumabe com uma margem de não-inferioridade de 10% [1]. < Para além disso, o risankizumab já mostrou uma indicação de superioridade em relação ao ustekinumab após 24 semanas (p 0,01, análise post-hoc para superioridade) [2]. No segundo endpoint co-primário, a remissão endoscópica, o risankizumab foi considerado superior ao ustekinumab após 48 semanas. < Quase o dobro dos doentes que receberam risankizumab alcançaram a remissão endoscópica em comparação com o ustekinumab (31,8% vs. 16,2%, p 0,0001) [1].
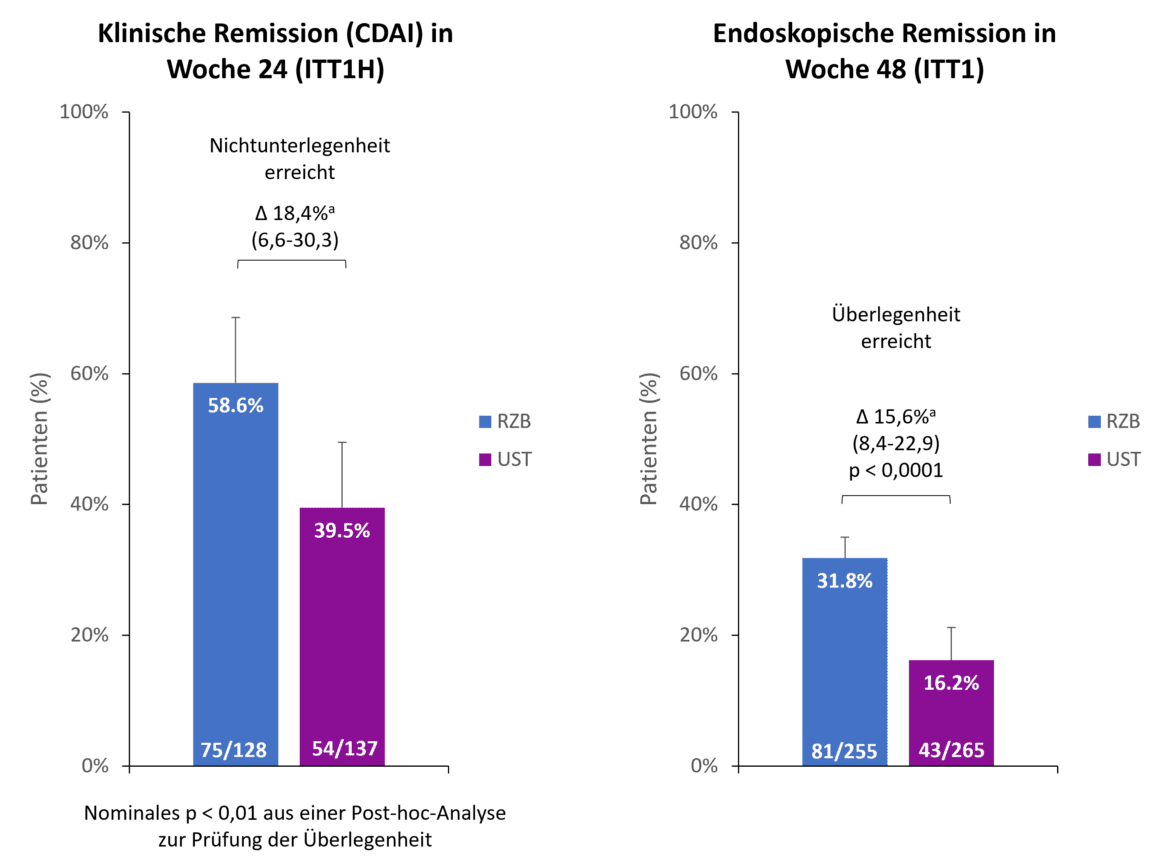
Fig. 1. Desfechos primários: > O risankizumab (RZB) demonstrou não inferioridade em relação ao ustekinumab (UST) na obtenção de remissão clínica à semana 24 e superioridade em relação ao UST na obtenção de remissão endoscópica à semana 48. a As diferenças são ajustadas para factores de estratificação (número de terapêuticas anti-TNF anteriores sem sucesso [≤ 1, 1] e utilização de esteróides no início do estudo [sim, não]). ITT1H: doentes tratados aleatoriamente que foram tratados durante pelo menos 24 semanas no momento da análise (análise interina na semana 24); ITT1: doentes aleatorizados que receberam pelo menos 1 dose de RZB resp. UST; CDAI: Índice de Atividade da Doença de Crohn; RZB: Risankizumab; UST: Ustekinumab. Adaptado de [1, 2].
O risankizumab mostrou superioridade em relação ao ustekinumab em todos os parâmetros secundários [1]
O risankizumab também mostrou superioridade em comparação com o ustekinumab nos endpoints secundários do estudo SEQUENCE, remissão clínica após 48 semanas, resposta endoscópica após 24 e 48 semanas e remissão endoscópica e clínica sem esteróides após 48 semanas (Fig. 2). <Por exemplo, 60,8% dos doentes com risankizumab estavam em remissão clínica após 48 semanas, em comparação com 40,8% dos doentes com ustekinumab (p 0,0001). <A diferença na resposta endoscópica entre risankizumab e ustekinumab foi ainda mais pronunciada após 48 semanas do que após 24 semanas (45,1 % vs. 21,9 %, p 0,0001) [1].
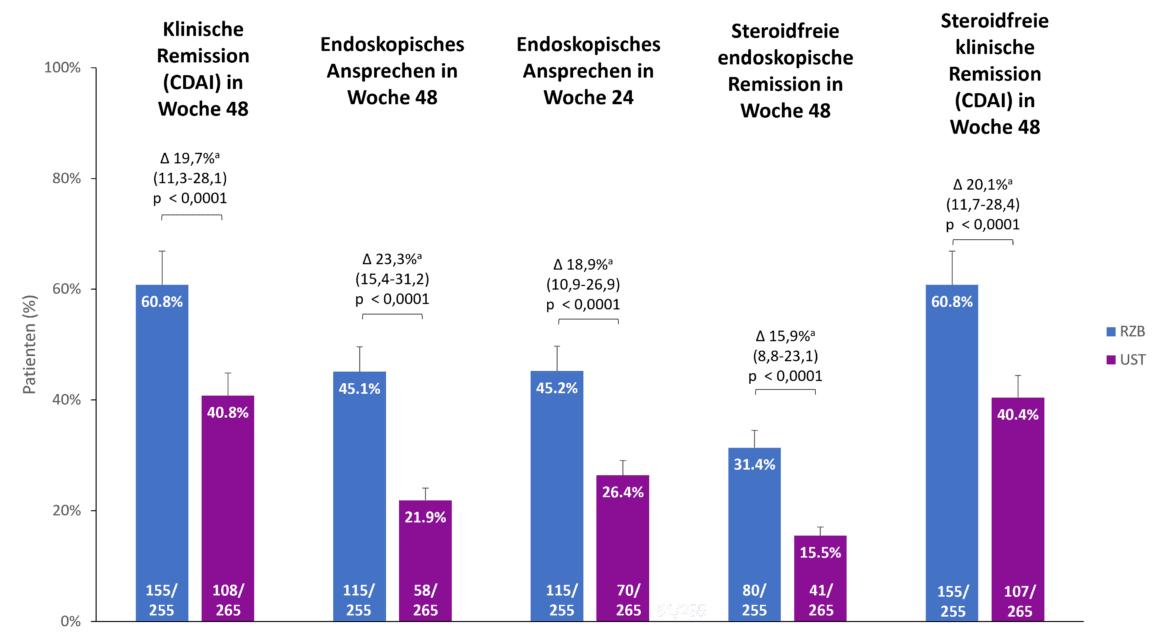
Fig. 2. > O risankizumab (RZB) demonstrou superioridade em relação ao ustekinumab (UST) em todos os endpoints secundários. a As diferenças são ajustadas utilizando os factores de estratificação (número de terapêuticas anti-TNF anteriores sem sucesso [≤ 1, 1] e utilização de esteróides no início do estudo [sim, não]). CDAI: Índice de Atividade da Doença de Crohn; RZB: Risankizumab; UST: Ustekinumab. Adaptado de [1, 2].
Perfil de segurança do risankizumab
A incidência global de eventos adversos emergentes do tratamento (TEAEs) foi baixa para risankizumab e ustekinumab (27,9% vs. 21,9%). 16,0% dos pacientes no braço do risankizumab tiveram eventos adversos graves, em comparação com 19,2% no braço do ustekinumab. Em ambos os braços de tratamento, houve poucos TEAEs que levaram à descontinuação do medicamento em estudo (risankizumab 3,8% vs. ustekinumab 4,9%) [1]. Em comparação com os estudos pivotais, não foram identificados novos sinais de segurança com o risankizumab [1, 7, 8].
Conclusão
Os dados mais recentes do estudo SEQUENCE confirmam que o risankizumab, um medicamento biológico recentemente aprovado, é uma opção de tratamento eficaz para os doentes com doença de Crohn. Numa comparação frente a frente com ustekinumab em doentes refractários aos anti-TNF, o risankizumab provou ser superior e todos os endpoints primários e secundários foram atingidos [1]. A remissão clínica e endoscópica e a cicatrização da mucosa como objectivos terapêuticos estão, assim, a aproximar-se e os doentes com doença de Crohn podem esperar uma menor atividade da doença e contar com uma nova e promissora terapêutica.
Breve informação técnica SKYRIZI® SKYRIZI
Literatura
- Peyrin-Biroulet, L., et al. Risankizumab versus ustekinumab para a doença de Crohn moderada a grave. N Engl J Med, 2024. 391(3): p. 213-223.
- Peyrin-Biroulet, L., et al. Risankizumab versus Ustekinumab para doentes com doença de Crohn moderada a grave: resultados do estudo SEQUENCE de fase 3b. UEGW; Copenhaga, 14-16 de outubro de 2023.
- Jairath, V. e B.G. Feagan, Global burden of inflammatory bowel disease (Peso global da doença inflamatória intestinal). Lancet Gastroenterol Hepatol, 2020. 5(1): p. 2-3.
- O peso global, regional e nacional da doença inflamatória intestinal em 195 países e territórios, 1990-2017: uma análise sistemática para o Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol, 2020. 5(1): p. 17-30.
- Resumo atual das caraterísticas do produto para SKYRIZI® (risankizumab) doença de Crohn em www.swissmedicinfo.ch.
- Resumo atual das caraterísticas do produto para o ustekinumab em www.swissmedicinfo.ch.
- D’Haens, G., et al, Risankizumab como terapia de indução para a doença de Crohn: resultados dos ensaios de indução de fase 3 ADVANCE e MOTIVATE. Lancet, 2022. 399(10340): p. 2015-2030.
- Ferrante, M., et al, Risankizumab as maintenance therapy for moderately to severe active Crohn’s disease: results from the multicentre, randomised, double-blind, placebo-controlled, withdrawal phase 3 FORTIFY maintenance trial.Lancet, 2022. 399(10340): p. 2031-2046.
As referências podem ser solicitadas por especialistas em medinfo.ch@abbvie.com.
Relatório: Dr. sc. nat. Stefanie Jovanovic
Este artigo foi produzido com o apoio financeiro da AbbVie AG, Alte Steinhauserstrasse 14, Cham.
CH-SKZG-240059 09/2024
Este artigo foi publicado em alemão.











