A radioterapia de tumores torácicos, especialmente o carcinoma pulmonar, está presa entre o objectivo de alcançar a maior probabilidade possível de controlo de tumores e a prevenção de toxicidade. Um efeito secundário relevante é a pneumonite radiogénica. Isto ocorre com uma latência de tempo de semanas a meses após a conclusão do tratamento.
A radioterapia de tumores torácicos, especialmente o carcinoma pulmonar, está presa entre o objectivo de alcançar a maior probabilidade possível de controlo de tumores e a prevenção de toxicidade.
Um efeito secundário relevante é a pneumonite radiogénica. Isto ocorre com uma latência temporal de semanas a meses após a conclusão do tratamento, aparecendo a maioria dos casos dentro das primeiras 8 semanas após a radiação [1]. Clinicamente, existe frequentemente uma tríade sintomática de esforço/dinésia, tosse não produtiva e hipoxia, que contribuem para o sentimento subjectivo pronunciado de doença do paciente. Em contraste com as infecções bacterianas ou virais, as temperaturas febris são bastante raras, mas também podem ser secundárias a superinfecções. Na fase aguda, a morfologia da TC mostra edema intersticial. Esta condição inflamatória aguda pode subsequentemente curar espontaneamente ou através da intervenção de drogas. Contudo, a longo prazo, também é possível a fibrose do tecido pulmonar afectado com a consequente retracção. Dependendo da extensão destas em relação ao pulmão ainda funcional, as perturbações restritivas da função pulmonar podem permanecer como resíduos irreversíveis. Felizmente, os cursos fatais da doença são raros e são relatados na literatura como sendo inferiores a 2% [2].
O patomecanismo subjacente à radiopneumonite ainda não foi totalmente decifrado na sua complexidade. O sistema alveolar é composto por pneumócitos de tipo I e II. Enquanto que os pneumócitos tipo I, como células diferenciadas, fornecem cerca de 90% da superfície alveolar, as células tipo II sintetizam o surfactante e servem de repovoamento para as células danificadas do tipo I [3]. O esgotamento destas células induzido por radiação resulta na perda da função de barreira no alvéolo e redução da integridade microvascular. Estes processos levam à formação de edema e desencadeiam, entre outras coisas, a migração de macrófagos e a libertação de citocinas pró-inflamatórias [4]. Os pneumócitos sobreviventes podem também diferenciar-se em miofibroblastos e secretar o factor de crescimento transformador beta (TGF-beta), o que acaba por promover o desenvolvimento da fibrose.
Classificação de Pneumonite
A gravidade da pneumonite é classificada de acordo com os Critérios Terminológicos Comuns para Eventos Adversos (CTCAE), versão 4.0: assintomática (grau 1); sintomática, necessidade de medicação, deficiência de actividades diárias (grau 2), sintomas graves, necessidade de oxigénio, deficiência de actividades diárias (grau 3) ou disfunção respiratória com risco de vida (grau 4). Em estudos clínicos, o risco de pneumonite de grau 2 ou 3 é particularmente relevante.
A probabilidade de pneumonite de qualquer grau no tratamento primário definitivo do cancro do pulmão avançado é dada como 15 a 40%, dependendo da fonte da literatura [1]. No entanto, este efeito secundário relacionado com a terapia também desempenha um papel na irradiação de outras entidades. Uma meta-análise de Tonison et al. [5], por exemplo, identificados 19 estudos com 874 doentes que receberam radioterapia para o cancro do esófago. Isto mostrou uma taxa de pneumonite ≥2 de 6,6%. Uma análise retrospectiva por Pinnix et al. [6] registaram a toxicidade pulmonar de 150 pacientes que foram submetidos a radioterapia consolidante ou de salvamento, incluindo o mediastino devido a linfoma. A incidência de pneumonite independente do estádio foi de 14%, com graus clinicamente relevantes ≥2 ocorrendo em 8% dos doentes. A radioterapia adjuvante do carcinoma da mama também pode resultar em exposição à radiação relevante dos pulmões, especialmente durante a radiação electiva dos gânglios linfáticos internacionais da mamária, parasternamente. O ensaio EORTC 22922/10925 [7] comparou os resultados do tratamento de radioterapia adjuvante apenas à glândula mamária ou à parede torácica com o tratamento adicional das vias de drenagem linfática supraclavicular interna mamária e medial. A análise da toxicidade mostra uma taxa aumentada de pneumonite de 0,7% vs. 0,1% (p<0,0012) com irradiação prolongada. Mesmo que estes valores pareçam numericamente baixos, deve ter-se em conta que a radioterapia adjuvante do cancro da mama é uma indicação padrão absoluta em muitas instituições de radiooncologia. Só na Alemanha, 70.000 mulheres são diagnosticadas anualmente com cancro da mama, uma grande parte das quais é submetida a irradiação como parte do conceito terapêutico.
Existem relações dose-resposta tanto para o controlo de tumores como para a pneumonite radiogénica. Teoricamente, os carcinomas brônquicos grandes e locoregionalmente avançados requerem, em particular, uma dose elevada de radiação no volume alvo, cuja aplicação, no entanto, está também associada a um aumento das doses em tecido pulmonar saudável e a um risco acrescido de pneumonite. Tradicionalmente, os oncologistas de radiação utilizam os dados da revisão QUANTEC (Análise Quantitativa dos Efeitos de Tecidos Normais na Clínica) como orientação para avaliar a segurança de um plano de radiação [8]. Neste, a literatura sobre a reacção de radiação induzida pela terapia em tecidos normais foi sistematicamente revista. Para a avaliação do pulmão de órgão de risco, recomenda-se limitar a dose média do pulmão a 20 Gy, a fim de manter a taxa de pneumonite clinicamente manifesta abaixo de 20%.
Risco com carboplatina/paclitaxel
No entanto, para além destes valores-guia dosimétricos, existem outros factores de risco relacionados com o paciente e a terapia que são relevantes. Numa meta-análise abrangente de Palma et al. [2], foram incluídos e analisados dados de um total de 836 pacientes de 12 estudos relativamente a preditores para a ocorrência de penumonite de grau ≥2. Todos os doentes receberam radiochemoterapia simultânea no diagnóstico de NSCLC (cancro do pulmão não pequeno) e a dose mediana aplicada foi de 60 Gy. O volume pulmonar que recebeu ≥20 Gy (o chamado V20) pôde ser identificado como um parâmetro dosimétrico relevante. Isto mostrou um OR de 1,03 por cento de aumento em V20 (p=0,008). Poderia ser demonstrado um aumento significativo do risco de quimioterapia simultânea combinada com as substâncias carboplatina e paclitaxel (OR 3,33 em comparação com a quimioterapia com cisplatina/etoposida, p<0,001). Em relação à idade dos pacientes, havia apenas uma tendência para um risco acrescido (OR 1,24 por década de vida, p=0,09). Contudo, a análise multivariada mostrou que o maior risco de desenvolvimento de pneumonite (>50%) estava na combinação de idade >65 anos e administração simultânea de carboplatina/paclitaxel.
Numa comparação moderna e aleatória de dois níveis de dose para radioterapia do cancro do pulmão de células não pequenas (NSCLC), a pneumonite ≥ grau 3 ocorreu em 7% (braço terapêutico 60 Gy) e de 4% (braço terapêutico 74 Gy) [9]. A sobrevivência significativamente mais pobre no braço de alta dose não é assim explicada por uma taxa de pneumonite mais elevada documentada, mas sugere no entanto uma influência de consequências terapêuticas não registadas em combinação com comorbilidades.
As modernas técnicas de radiação, especialmente os métodos de radioterapia modulada por intensidade (IMRT), permitem uma redução relevante da dose pulmonar com uma dose constante no volume alvo em comparação com o planeamento convencional em 3D. Num estudo prospectivo da fase 1 por Boyle et al. [10] 24 pacientes foram tratados com IMRT definitivo no diagnóstico de NSCLC avançado e foi calculado um plano de radiação correspondente com técnica de conformidade 3D para comparação. Isto mostrou uma vantagem dosimétrica do IMRT tanto em termos da dose média pulmonar (11,9 vs. 14,9 Gy, p
Outra possibilidade de redução de dose em tecidos normais saudáveis é o planeamento do volume alvo baseado no 18F-fluorodeoxiglicose–(18F-FDG) PET/CT. Este procedimento tornou-se um padrão para a encenação do NSCLC e detecta com alta sensibilidade a actividade biológica de um primarius, mas também possíveis gânglios linfáticos mediastinais afectados. No planeamento convencional da radiação, dependendo da localização do tumor, as estações de drenagem dos gânglios linfáticos mediastinais são geralmente também eletivamente irradiadas, o que por vezes resulta em grandes volumes alvo. Da mesma forma, é por vezes difícil diferenciar entre tumor primário e atelectasia consecutiva na imagem convencional por TC (por exemplo, no caso de obstrução das vias aéreas), de modo que em caso de dúvida, o contorno é muitas vezes um pouco mais generoso.
Um estudo de planeamento italiano [11] comparou a exposição por dose nos órgãos de risco para 18 pacientes que iriam receber radioterapia primária para NSCLC localmente avançado. Foram criados vários planos de tratamento individuais para cada paciente, em que uma versão incluía apenas as estruturas PET-positivas e outra versão também irradiava os níveis de gânglios linfáticos electivos. Em 33% dos doentes, a redução foi conseguida com base na imagem PET, em particular porque o envolvimento do Ln mediastinal já não podia ser detectado. Ao concentrar a radioterapia nos focos PET-positivos, a dose pulmonar média poderia ser reduzida de 20,5 para 15,5 Gy. O mesmo se aplica ao V20, que caiu de 34 para 26%.
Num estudo prospectivo randomizado, Nestle et al. [12]se a radioterapia por si só das estruturas PET-positivas também conduz aos mesmos resultados oncológicos. Um total de 205 pacientes com NSCLC localmente avançados foram randomizados para o planeamento de radiochemoterapia primária com base em PET ou convencional. Com um tempo médio de seguimento de 29 meses, nenhuma desvantagem da radioterapia baseada em PET em termos de sobrevivência sem progressão pôde ser demonstrada. O risco de progressão local após um ano era de apenas 14% vs. 29% no braço padrão (HR 0,57, CI 0,3-1,06). Por conseguinte, é seguro adaptar individualmente o volume alvo para um paciente com base no PET-CT e, assim, reduzi-lo significativamente se necessário.
Em última análise, levanta-se a questão de saber se a melhoria dos parâmetros dosismétricos resulta efectivamente numa redução da taxa de expressão clínica da pneumonite. No estudo de comparação de doses já mencionado por Bradley et al. [9], IMRT, bem como a técnica mais antiga de conformidade 3D era permitida em ambos os braços. O IMRT foi utilizado em doentes com maiores volumes de alvos tumorais (mediana 486 vs 427 ml), mas foi associado a uma menor taxa de pneumonite ≥ grau 3 (3,5% vs 7,9%) e tendeu a ter uma sobrevida global de 2 anos ainda melhor (53,2% vs 49,4%) [13].
Redução das costuras de segurança graças aos portões
Outra inovação técnica no campo da radioterapia é a implementação de procedimentos de portões. Ao registar e/ou corrigir a mobilidade respiratória do tumor, estes permitem uma redução das margens de segurança para o volume alvo de planeamento (PTV), o que tem em conta não só a extensão clínica de um primarius mas também as imprecisões posicionais diárias. Tal abordagem é utilizada, por exemplo, no Isto é possível através da realização da irradiação em inspiração profunda, frequentemente referida na literatura como DIBH (Deep Inspiration Breath Hold). Para o perceber, a curva respiratória do paciente é registada digitalmente através de um espirómetro ou com scanners de superfície e tornada visível num visor. Os pacientes são então levados a respirar fundo através de um sinal visual ou acústico. Se um valor limite previamente definido for excedido, o ar é parado nesta posição durante cerca de 15 segundos. Só durante este tempo é que o dispositivo de tratamento, o chamado acelerador linear, recebe a luz verde para irradiação, através da qual os próprios pacientes podem interromper a terapia em qualquer altura. Após uma curta “pausa para respirar”, o procedimento é continuado até ao final da sessão de tratamento diário. Após apenas uma curta fase de familiarização, muitos pacientes estão tão familiarizados com a manipulação do procedimento que inspiram independentemente no momento certo acima do limiar. Aprendem assim, por assim dizer, a controlar a radiação eles próprios com o seu próprio fôlego. Um estudo comparativo de Josipovic et al. [14] investigou as diferenças dosimétricas entre o tratamento “respiração livre” e DIBH para 10 pacientes com NSCLC avançado e radioterapia primária. Dependendo da técnica de irradiação utilizada, tanto a dose pulmonar média como o V20 poderiam ser significativamente reduzidos em cerca de 20% cada um por meio de DIBH. Numa outra análise, o mesmo grupo de trabalho investigou a questão de saber se os pacientes com NSCLC avançados são adequados para tratamento com paragem respiratória, apesar da sua doença subjacente e possivelmente de outras doenças pulmonares secundárias (por exemplo, DPOC) [15]. Numa análise intercalar de um estudo prospectivo, chegou-se à conclusão de que aproximadamente 70% dos pacientes examinados são capazes de realizar uma DIBH durante 20 segundos e, adicionalmente, beneficiar dosimetricamente desta técnica.
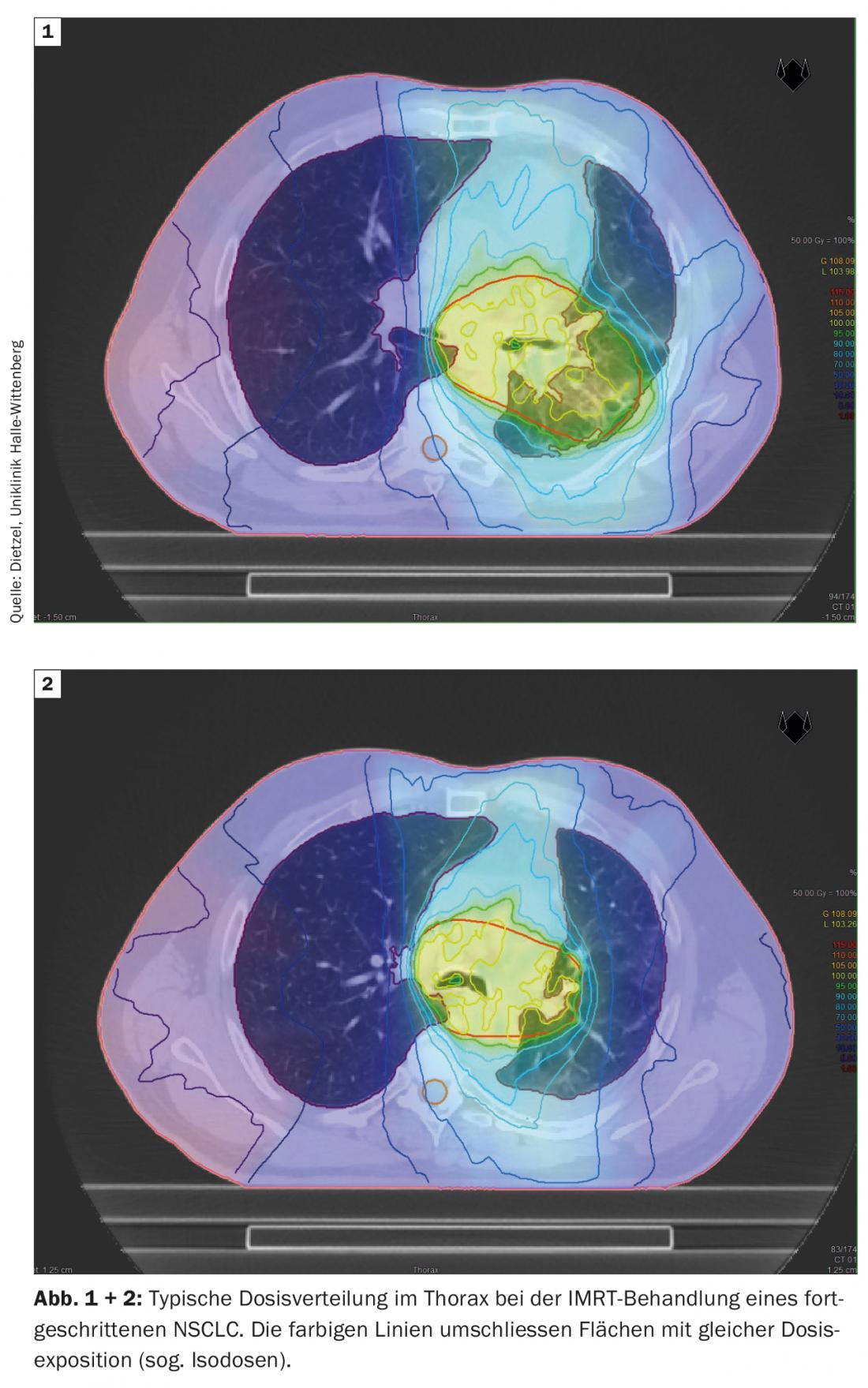
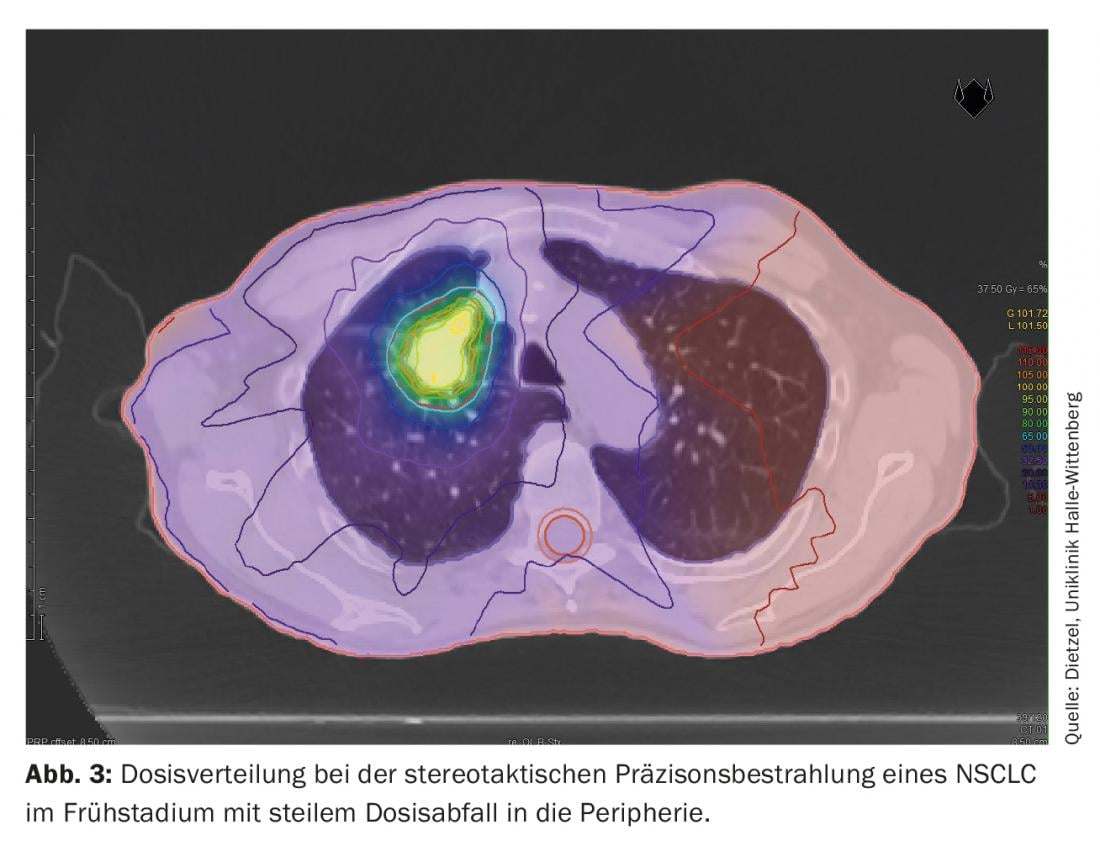
A técnica DIBH também desempenha um papel decisivo na radioterapia adjuvante do cancro da mama, especialmente no caso de tumores do lado esquerdo, a fim de evitar doses desnecessárias de radiação nos órgãos circundantes em risco. Aqui, o efeito da insipração profunda é principalmente utilizado para poupar estruturas cardíacas, levantando a parede torácica do pericárdio e baixando o coração caudalmente. No entanto, como efeito secundário positivo, o aumento e mudança no volume também protege os pulmões. Com base num estudo de planeamento da Universidade Técnica de Munique, tendo em conta 31 pacientes com cancro da mama, foi demonstrado que a DIBH pode reduzir a dose média para o pulmão esquerdo em 19 ± 9% e o V20 em 24 ± 10% [16]. Considerando que na fase III NSCLC, grandes volumes pulmonares são expostos a doses superiores e intermédias (Fig. 1 e 2), Na radioterapia estereotáxica do NSCLC em fase inicial, apenas pequenas secções do pulmão são expostas a doses de radiação relevantes. (Fig. 3), razão pela qual o método é utilizado principalmente para pacientes inoperáveis internamente – frequentemente com DPOC de alto grau e, por vezes, com O2-obrigação – é utilizada. Mesmo neste grupo de doentes negativamente seleccionados, apenas foram observadas taxas de pneumonite de grau 2 e grau 3 de 7% e 2%, respectivamente, com regimes de dose padrão [17].
A imunoterapia abre novas perspectivas
A introdução da imunoterapia no tratamento do NSCLC abriu novas perspectivas clínicas nos últimos anos, que contribuíram para uma melhoria significativa no prognóstico. Por exemplo, para a combinação sequencial de radiochemoterapia seguida de durvalumab como terapia primária, como investigado no ensaio PACIFIC, foi possível mostrar uma redução significativa no número de pacientes tratados com durvalumab. foi demonstrada uma melhoria na sobrevivência de 2 anos de 55,6% para 66,3% (p=0,005) [18]. No entanto, especialmente no que diz respeito à toxicidade adicional da imunoterapia, a experiência bem fundamentada a longo prazo só está actualmente a ser recolhida. Na avaliação do ensaio PACIFIC, apenas foi relatada uma baixa taxa de pneumonite ≥ grau 3 de 3,4%, em comparação com 2,6% no braço de controlo (radiochemoterapia seguida de placebo) [18]. Em combinação do tratamento de NSCLC com radioterapia e imuno-oncologia, a pneumonite deve ser considerada como uma toxicidade sobreposta. Os dados iniciais de um estudo de fase II sobre a administração simultânea de nivolumabe com radiochemoterapia mostraram uma taxa de pneumonite de grau 3 de 10,3%, que foi considerada aceitável pelos autores, mas provavelmente aumentada em comparação com a radiochemoterapia apenas [19].
Opções terapêuticas
De acordo com as recomendações para a terapia da pneumonia radiogénica na actual directriz S3 “Supportive Therapy in Oncological Patients” [20], o tratamento deve ser com esteróides. Os regimes de dosagem típicos incluem uma dose diária de prednisona de 60-100 mg/tgl. inicial, que é lentamente reduzida durante um período de 8-12 semanas [1]. Esta é uma terapia sintomática da fase inflamatória aguda da doença, que presumivelmente não tem influência sobre o desenvolvimento posterior da fibrose [21]. Após uma decisão caso a caso (por exemplo, em caso de alívio insuficiente), a administração de esteróides pode ser suplementada ou substituída por azatioprina ou ciclosporina. A administração profiláctica de antibióticos só é recomendada para doentes com factores de risco (por exemplo, supressão imunitária, processos de estenosing, etc.). Se a febre for pronunciada, a antibioticoterapia calculada pode ser administrada. Se isto não tiver efeito, deve ser procurada confirmação microbiológica, por exemplo através de lavagem brônquica, a fim de iniciar uma terapia baseada em resistograma ou para excluir pneumonia fúngica. Na profilaxia de drogas, discute-se a administração de amifostina, que actua como um necrófago radical. De acordo com a directriz, a aplicação pode ser realizada como uma utilização não rotulada em pacientes com radiochemoterapia planeada. Não existe actualmente nenhuma opção de tratamento eficaz para a fibrose pré-existente.
Em resumo, a pneumonite radiogénica é um efeito secundário relevante da radioterapia, que pode levar a uma fibrose pulmonar crónica e, portanto, a uma carga a longo prazo para o doente. No entanto, o conhecimento das relações dose-efeito relevantes e dos factores de risco relacionados com os pacientes, em conjunto com a constante inovação técnica no campo da oncologia da radiação, levou a que se possa falar de um risco calculável.
Mensagens Take-Home
- A pneumonite radiogénica é um efeito secundário relevante após a irradiação de tumores torácicos e ocorre tipicamente apenas após várias semanas a meses.
- Para além de uma fase inflamatória aguda, pode desenvolver-se fibrose com sintomas crónicos que a acompanham no decurso da doença.
- Para além da carga pulmonar radiogénica (dose pulmonar média e V20), os factores relacionados com o doente (idade, comorbilidades) e a aplicação simultânea de terapias de sistema também têm influência na probabilidade de expressão.
- As modernas técnicas de radioterapia, tais como a radioterapia modulada por intensidade (IMRT), os canais de respiração e o planeamento baseado em PET permitem uma redução significativa da dose indesejada na área pulmonar.
Literatura:
- Jain V, et al: Radiation Pneumonitis: Old Problem, New Tricks. Cancers 2018; 10 (7).
- Palma DA, et al: Previsão de pneumonia por radiação após quimiorradiação para o cancro do pulmão: uma meta-análise internacional de dados individuais de doentes. Int J Radiat Oncol Biol Phys 2013; 85 (2): 444-450.
- Giuranno L, et al: Lesão Pulmonar Induzida por Radiação (RILI). Front Oncol 2019; 9: 877.
- Citrin DE, et al: Papel da senescência pneumocitária de tipo II na fibrose pulmonar induzida por radiação. J Natl Cancer Inst 2013; 105 (19): 1474-1484.
- Tonison JJ, et al: Pneumonite por radiação após radioterapia de intensidade modulada para o cancro do esófago: dados institucionais e uma revisão sistemática. Rep. Sci 2019; 9 (1): 2255.
- Pinnix CC, et al: Preditores de pneumonia por radiação em pacientes que recebem terapia por radiação modulada de intensidade para linfoma de Hodgkin e não-Hodgkin. Int J Radiat Oncol Biol Phys 2015; 92 (1): 175-182.
- Matzinger O et al: Toxicidade aos três anos com e sem irradiação da cadeia linfonodal mamária interna e supraclavicular medial na fase I a III do cancro da mama (ensaio EORTC 22922/10925). Acta Oncol 2010; 49 (1): 24-34.
- Bentzen, et al: Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC): uma introdução às questões científicas. Int J Radiat Oncol Biol Phys 2010; 76 (3 Suplemento): 3-9.
- Bradley JD, et al: radioterapia de dose padrão versus radioterapia de alta dose com carboplatina concorrente e de consolidação mais paclitaxel com ou sem cetuximab para doentes com cancro do pulmão de fase IIIA ou IIIB não de pequenas células (RTOG 0617): um estudo aleatório, dois por dois, fase 3 factorial. Lancet Oncol 2015; 16 (2): 187-199.
- Boyle J, et al: Vantagens dosimétricas da radioterapia de intensidade modulada no cancro do pulmão localmente avançado. Adv Radiat Oncol 2017; 2 (1): 6-11.
- Ceresoli GL, et al.: Role of computed tomography and [18F] fluorodeoxyglucose positron emission tomography image fusion in conformal radiotherapy of non-small cell lung cancer: a comparison with standard techniques with and without elective nodal irradiation. Tumori 2007; 93 (1): 88-96.
- Nestlé U, et al: Redução do volume alvo de quimioradioterapia baseada em imagens para o cancro do pulmão não pequeno de células localmente avançado (PET-Plan): um ensaio multicêntrico, aberto, aleatório, controlado. Lancet Oncol 2020; 21 (4): 581-592.
- Chun SG, et al: Impact of Intensity-Modulated Radiation Therapy Technique for Locally Advanced Non-Small-Cell Lung Cancer: A Secondary Analysis of the NRG Oncology RTOG 0617 Randomized Clinical Trial. J Clin Oncol 2017; 35 (1): 56-62.
- Josipovic M, et al: Radioterapia de inspiração profunda para o cancro do pulmão localmente avançado: comparação de diferentes técnicas de tratamento sobre a cobertura do alvo, dose pulmonar e tempo de entrega do tratamento. Acta Oncol 2013; 52 (7): 1582-1586.
- Persson GF, et al: Conformidade com a Inspiração Profunda em Terapia por Radiação para Cancro do Pulmão Localmente Avançado. Int J Radiat Oncol Biol Phys 2017; 99 (2): Suplemento 2017: E491.
- Oechsner M, et al.: Respiração profunda para irradiação do lado esquerdo da mama: Análise de histogramas de massa dose-massa e o impacto da expansão pulmonar. Radiat Oncol 2019; 14 (1): 109.
- Guckenberger M, et al.: Existe um limite inferior da função pulmonar pré-tratamento para a radioterapia estereotáxica do corpo segura e eficaz para o cancro do pulmão em fase precoce e não de pequenas células? J Thorac Oncol 2012; 7 (3): 542-551.
- Antonia SJ, et al: Sobrevivência Global com Durvalumab após Quimioradioterapia na Fase III do NSCLC. N Engl J Med 2018; 379 (24): 2342-2350.
- Peters S, et al: Avaliação da segurança do nivolumab acrescentado simultaneamente à radioterapia num regime padrão de quimio-radioterapia de primeira linha na fase III de cancro do pulmão de células não pequenas – o ensaio ETOP NICOLAS. Cancro do pulmão 2019; 133: 83-87.
- Programa de orientação em oncologia (Sociedade Alemã contra o Cancro, AWMF): terapia de apoio em doentes oncológicos – versão longa 1.3, 2020, AWMF número de registo: 032/054OL, www.leitlinienprogramm-onkologie.de/leitlinien/supportive-therapie; último acesso: 24.08.2020.
- Sekine I, et al: Análise retrospectiva da terapia com esteróides para lesões pulmonares induzidas por radiação em doentes com cancro do pulmão. Radiother Oncol 2006; 80 (1): 93-97.
InFo PNEUMOLOGIA & ALERGOLOGIA 2020; 2(4): 6-10