A doença das pequenas vias respiratórias (SAD) é uma característica central da doença pulmonar obstrutiva crónica (DPOC). Mais de metade de todos os doentes com asma também sofrem dela. Uma equipa de autores analisou estudos recentes sobre a relação entre a SAD e o enfisema.
As pequenas e mais pequenas vias aéreas por definição têm um diâmetro <2 mm e têm origem na 4ª-13ª geração de ramificações de vias aéreas, sendo a traqueia a 1ª geração que se estende até ao alvéolo como a 23ª geração. Normalmente, no entanto, só ocorrem até à 8ª geração. Estima-se que cerca de 20% das pequenas vias aéreas com menos de 2 mm de diâmetro têm brônquios com elementos de cartilagem nas suas paredes, os restantes são bronquíolos ou alveolares de ducto.
Relação entre a SAD e o enfisema
O enfisema centrilobular está fortemente associado ao tabagismo crónico do cigarro. Ataca os lóbulos secundários dos pulmões, que são unidades poliédricas irregulares da estrutura pulmonar (Fig. 1). Os lóbulos pulmonares secundários contêm 3-10 acini, como o Dr. Andrew Higham, da Universidade de Manchester, e os seus colegas escrevem no seu artigo de revisão [1]. Cada acinus inclui os bronquíolos respiratórios, condutas alveolares e espaços alveolares. A destruição enfisematosa, que normalmente resulta do fumo, tem origem no centro do lóbulo. No centro situam-se os bronquíolos respiratórios, que são principalmente afectados por enfisema centrilobular. Em contraste, o enfisema panlobular ataca todas as estruturas, desde os alvéolos distais até aos bronquíolos das vias aéreas. O enfisema parasseptal afecta os alvéolos e os alvéolos ducti alveolares enquanto poupa as estruturas proximais.
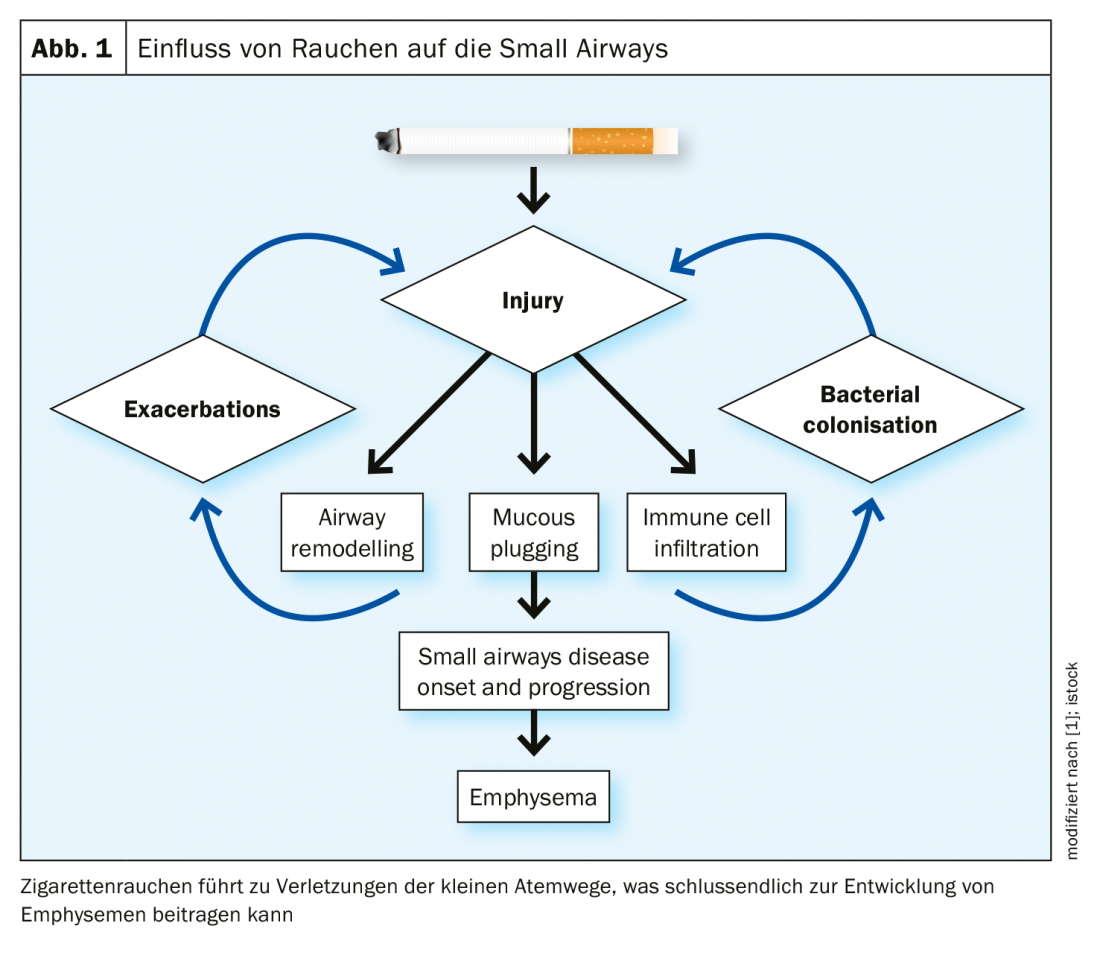
Como é que a remodelação de pequenas vias aéreas, especialmente fibrose, está relacionada com o enfisema? Por um lado, há um espessamento do tecido, mas, por outro lado, há uma perda de tecido. Como Higham et al. Num estudo [2], a expressão de 54 genes de reparação de tecidos nas pequenas vias respiratórias e parênquima circundante foi investigada utilizando microdissecções de captura a laser. O que foi encontrado foi a expressão diferencial destes genes entre as duas áreas, com expressão favorecendo a degradação parenquimatosa que envolve as pequenas vias respiratórias. Os autores do estudo sugerem que algumas pequenas vias respiratórias são destruídas de forma semelhante ao parênquima, enquanto outras têm um perfil mais espesso.
Ligação de apoio aos estudos
Vários estudos recentes mostraram uma redução no número total de bronquíolos respiratórios (transitórios) terminais e de primeira ordem em pacientes com DPOC em comparação com os controlos que utilizam a tomografia microcomputada. 90% dos bronquíolos terminais foram obliterados nos pulmões do COPD da fase IV. Em pacientes GOLD 1, a redução nos bronquíolos terminais e respiratórios foi de 29 e 41%, respectivamente, e em pacientes GOLD 2, 40 e 53%, respectivamente. As restantes pequenas vias respiratórias tinham paredes espessas e lúmenes estreitos causados por obstruções mucóides e depósitos de colagénio. A perda e remodelação de bronquíolos terminais e transitórios no tecido pulmonar não afectado pelo enfisema fornece mais provas de que o SAD precede as lesões enfisematosas.
A SAD, de acordo com o Dr. Higham e os seus colegas, está presente em todas as fases da COPD. O facto de ser também de grande importância nas fases iniciais da doença está agora cada vez mais em foco. As novas investigações e os resultados obtidos fornecem informações sobre a progressão da SAD, bem como a importância das exacerbações na promoção de processos inflamatórios e de remodelação associados à doença das pequenas vias respiratórias. O SAD parece ser um precursor do desenvolvimento do enfisema, e as estratégias terapêuticas que visam as pequenas vias respiratórias na DPOC podem reduzir a taxa de progressão do enfisema. Com base nisto, os investigadores aconselham a utilização da focalização farmacológica mais cedo do que mais tarde no desenvolvimento da COPD.
Literatura:
- Higham A, et al: A patologia da doença das pequenas vias respiratórias na COPD: aspectos históricos e direcções futuras. Investigação Respiratória 2019; 20: 49
(https://doi.org/10.1186/s12931-019-1017-y) - Gosselink JV, Hayashi S, Elliott WM, et al: Expressão diferencial de genes reparadores de tecidos na patogénese da doença pulmonar obstrutiva crónica. Am J Respir Crit Care Med. 2010; 181(12): 1329-1335.
InFo PNEUMOLOGIA & ALERGOLOGIA 2019; 1(2): 28