Nos últimos anos, o espectro de tratamento para doentes com doença inflamatória intestinal (DII) expandiu-se significativamente. Com base no conhecimento de que a inflamação crónica e não tratada tem uma influência desfavorável no curso da doença, a intervenção medicamentosa precoce e a monitorização intensiva são hoje em dia propagadas de modo a evitar complicações.
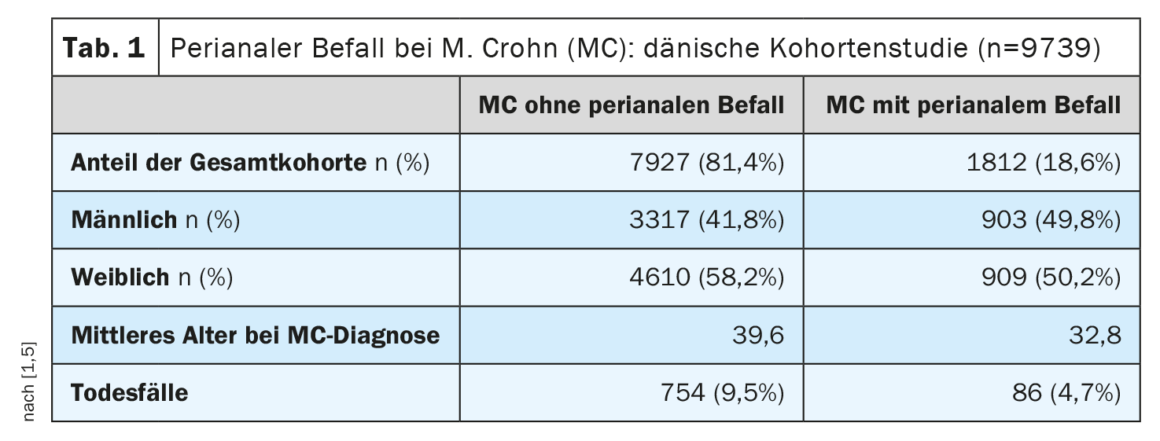
A doença de Crohn (DC) caracteriza-se por um quadro heterogéneo de diferentes fenótipos [1]. A avaliação da actividade e da gravidade da MC baseia-se principalmente em parâmetros laboratoriais, bem como em informações clínicas e anamnésticas (por exemplo, frequência das fezes, estado, dor). Estes parâmetros foram resumidos em várias pontuações clínicas, sendo o Índice de Actividade da Doença de Crohn (CDAI) o mais comum [2]. O valor de corte para MC moderada a grave de acordo com a FDA/EMA é CDAI ≥220 [3]. O Professor David T. Rubin, médico da Universidade de Chicago, salientou que os doentes com MC ligeira mas com doença perianal também devem ser classificados como moderados a graves em termos de tratamento. [4,5]A infestação perianal ocorre em cerca de 20% dos doentes com MC durante o curso da doença. Este facto é demonstrado, entre outros, por um estudo de coorte dinamarquês em grande escala (Tab. 1).
Acompanhamento da evolução da doença e do tratamento
A terapia tem como objectivo inicial induzir a remissão. A longo prazo, o objectivo é manter a remissão. O controlo da doença é entendido como uma construção multidimensional na MC (caixa) . A gama de opções de tratamento medicamentoso expandiu-se consideravelmente. A introdução de anticorpos contra o factor de necrose tumoral (TNF)-α foi seguida pelo anticorpo α4β7 vedolizumab e pelo anticorpo (IL)-12/ IL-23 ustekinumab. É importante avaliar o curso da doença e o tratamento no contexto da dimensão temporal, diz o Prof. Rubin. [1,6,7]Várias análises post-hoc demonstraram que a resposta dos doentes com MC com uma duração de doença mais curta ao tratamento com anticorpos contra o TNF-α, ustekinumab e vedolizumab, é melhor do que com uma duração de doença mais longa.
| Decisão de terapia baseada em evidências A escolha da terapêutica baseia-se numa avaliação risco-benefício, na qual devem ser tidos em conta vários factores e situações especiais de tratamento. Uma interpretação adequada dos dados é um pré-requisito para tomar decisões de tratamento baseadas em provas. Os ensaios controlados aleatorizados são classificados como evidência empírica forte, seguidos, por ordem decrescente de evidência, de estudos comparativos, dados pós-comercialização, metanálises de rede, dados do mundo real, relatos de casos e, por último, opinião de peritos. |
Por exemplo, uma meta-análise publicada em 2020 que incluiu 18 471 doentes mostrou que a utilização precoce de medicamentos biológicos (ou seja, no prazo de dois anos após o diagnóstico) estava associada a uma probabilidade duas a três vezes maior de remissão clínica aos 6-12 meses. A utilização precoce de biológicos (ou seja, no prazo de dois anos após o diagnóstico) foi associada a uma probabilidade duas a três vezes maior de remissão clínica aos 6-12 meses (OR 2,10 [IC 95%: 1,69-2,60], n=2763, p<0,00001) e a taxas mais elevadas de cicatrização da mucosa (OR 2,37 [IC 95%: 1,78-3,16], n=994, p<0,00001) [8].
Vedolizumab e ustekinumab: dados de estudos actuais
No estudo SEAVUE, o ustekinumab e o adalimumab foram comparados frente a frente [9]. Trata-se de um ensaio aleatório, em dupla ocultação, com controlo activo e com um desenho de grupos paralelos. No total, estavam disponíveis resultados avaliáveis de 386 doentes sem antecedentes biológicos tratados com ustekinumab (n=191) ou adalimumab (n=195). Não houve diferenças significativas entre os dois biológicos no endpoint clínico na semana 52: as taxas de resposta para adalimumab e ustekinumab foram 61,0% e 64,9%, respectivamente (p=0,417), com remissão clínica operacionalizada como CDAI <150 na semana 52. No entanto, em termos de tolerabilidade, o ustekinumab teve um desempenho ligeiramente superior.
Numa análise secundária publicada em 2022, o ustekinumab demonstrou ser superior ao vedolizumab na segunda linha (após a terapêutica anti-TNF). A análise baseou-se em 5 estudos (4 retrospectivos e 1 prospectivo) em doentes com MC que falharam o tratamento anti-TNF. [10]Na fase de manutenção, o ustekinumab teve um melhor desempenho do que o vedolizumab, e na fase de indução, os dois anticorpos monoclonais apresentaram efeitos de tratamento semelhantes.
Opções de tratamento de exaustão
Outras terapêuticas biológicas estão actualmente a ser investigadas em ensaios de registo, incluindo o risankizumab, por exemplo. Este anticorpo liga-se à subunidade p19 da interleucina-23 humana (IL-23), inibindo a interacção com o seu receptor. [11]Em ensaios clínicos, o risankizumab demonstrou ser eficaz tanto em doentes de primeira linha como em doentes com experiência em biológicos. Foi também observada uma boa resposta ao risankizumab em doentes que tinham sido previamente tratados com ustekinumab. De acordo com o orador, o risankizumab é adequado numa fase inicial do tratamento devido à sua boa segurança e tolerabilidade. De acordo com os dados actuais, também faz sentido utilizá-lo em sequências de tratamento posteriores.
O controlo da doença como uma construção multidimensionalOs factores importantes relacionados com os doentes para a avaliação do controlo da doença são, por exemplo, o IMC, o sexo, a nutrição, a farmacogenómica, a adesão e o tabagismo. Para além da gravidade e da actividade da doença, os factores relacionados com a doença também incluem a latência do diagnóstico, o fenótipo, factores extra-intestinais e tentativas de tratamento anteriores. Os factores relacionados com a terapêutica referem-se às propriedades farmacocinéticas e farmacodinâmicas da substância activa, bem como à via de administração e ao perfil global benefício-risco. Os preditores de um curso complexo de MC em termos de factores de risco independentes no momento do diagnóstico (Tabela 2) incluíram idade mais jovem, manifestações perianais e a necessidade de terapia esteróide precoce. |
| de acordo com [3] |
No que diz respeito à sequência da terapêutica biológica e da intervenção cirúrgica, as actuais recomendações das directrizes aconselham a não descontinuar a terapêutica biológica a longo prazo, mas sim a programar a cirurgia no final do intervalo normal de administração dos biológicos, desde que a actividade da doença o permita [1].
Nas pequenas moléculas, o inibidor da Janus quinase (JAK) tofacitinib só foi aprovado até à data para a colite ulcerosa. [12]O upadacitinib, também um inibidor da JAK, está actualmente a ser investigado em ensaios clínicos de fase III para o tratamento da doença de Crohn.
Congresso: Organização Europeia de Crohns e Colite
Literatura:
- “Diagnóstico e terapia da doença de Crohn”, Sociedade Alemã de Gastroenterologia, Doenças Digestivas e Metabólicas (DGVS), diretriz S3 atualizada, agosto de 2021 – número de registo AWMF: 021-004.
- Best WR, et al: Desenvolvimento de um índice de actividade da doença de Crohn. National Cooperative Crohn’s Disease Study. Gastroenterologia 1976; 70: 439-444.
- “Treatment Sequencing in moderate-to-severe CD: Who’s first and who’s last?”, Prof. David T. Rubin, MD, ECCO, Copenhaga, 1-4 de Março de 2023.
- Eglinton TW, et al: Factores de risco clínicos e genéticos para a doença de Crohn perianal numa coorte de base populacional. Am J Gastroenterol 2012; 107: 589-596.
- Wewer MD, et al: The Incidence and Disease Course of Perianal Crohn’s Disease: A Danish Nationwide Cohort Study, 1997-2015 J Crohns Colitis 2020; 15: 5-13.
- Alric H, et al: A eficácia de ustekinumab ou vedolizumab em 239 doentes com doença de Crohn refractária ao factor de necrose tumoral. Aliment Pharmacol Ther 2020; 51: 948-957.
- Hamdeh S, et al: Uso precoce vs tardio da terapia anti-TNFa em pacientes adultos com doença de Crohn: uma revisão sistemática e meta-análise. Inflamm Bowel Dis 2020; 26: 1808-1818.
- ngaro RC, et al: Revisão sistemática e meta-análise: eficácia e segurança do tratamento biológico precoce em doentes adultos e pediátricos com doença de Crohn. Aliment Pharmacol Ther 2020; 51(9): 831-842.
- Sands BE, et al: Grupo de Estudo SEAVUE. Ustekinumab versus adalimumab para terapêutica de indução e manutenção em doentes virgens de tratamento biológico com doença de Crohn moderada a gravemente activa: um ensaio multicêntrico, aleatório, em dupla ocultação, de grupo paralelo, de fase 3b. Lancet 2022; 399(10342): 2200-2211.
- Parrot L, et al: Revisão sistemática com meta-análise: a eficácia do ustekinumab ou do vedolizumab em doentes com doença de Crohn refractária ao factor de necrose tumoral. Aliment Pharmacol Ther 2022; 55(4): 380-388.
- Farrante M, et al: Apresentado na UEGW. Outubro de 2022. OP128.
- Chugh R, et al: Experiência Multicêntrica no Mundo Real do Upadacitinib no Tratamento da Doença de Crohn. J Crohns Colitis 2023; 17(4): 504-512.
- (ACG) Lichtenstein GR, et al: Directrizes Clínicas ACG: Gestão da doença de Crohn em adultos. Am J Gastroenterol 2018; 113: 481-517.
HAUSARZT PRAXIS 2023; 18(5): 37-38 (publicado em 25.5.23, antes da impressão).