A deficiência de ferro em doentes cardio-renais não é uma questão trivial. A insuficiência cardíaca crónica, por exemplo, não é apenas uma doença comum, mas também frequentemente associada à deficiência de ferro. Isto, por sua vez, tem um impacto sobre a previsão. Isto porque a hospitalização e as taxas de mortalidade estão estreitamente ligadas ao estado de ferro destes pacientes. É indicada a substituição precoce e em conformidade com as orientações.
A insuficiência cardíaca (CHF) é principalmente uma doença de velhice e a razão mais comum para o tratamento em regime de internamento. As limitações funcionais do coração andam muitas vezes de mãos dadas com a função renal reduzida – e vice versa. A razão é a estreita ligação tanto através do sistema nervoso simpático como do sistema renina-angiotensina-aldosterona. Este último controla, por exemplo, o equilíbrio dos fluidos e electrólitos do corpo e, portanto, também influencia a pressão sanguínea. O volume de sangue arterial eficaz, por sua vez, é relevante para a perda de potássio através do rim. Tanto a insuficiência renal crónica como a insuficiência cardíaca estão também estreitamente associadas à deficiência de ferro, que por sua vez é um factor prognóstico desfavorável em termos de capacidade de exercício, hospitalização e mortalidade.
Fisiopatologia da deficiência de ferro
A patofisiologia da deficiência de ferro na insuficiência cardíaca é provavelmente multifactorial. Por conseguinte, é importante não esquecer outras causas, tais como úlceras gastrointestinais ou doenças malignas. Pode haver factores simples, como a perda de sangue devido à terapia antiplaquetária ou anticoagulante, que levam à perda de ferro. A má absorção pode também desempenhar um papel. Além disso, o edema intestinal intersticial pode levar a uma reduzida absorção oral de ferro.
O estado inflamatório crónico associado à insuficiência cardíaca leva ao aumento dos níveis de citocinas pró-inflamatórias como a interleucina-6 (IL-6). A inflamação induz a síntese de hepcidina, o que reduz a libertação de ferro armazenado. Embora a maioria das doenças inflamatórias crónicas estejam associadas a níveis mais elevados de hepcidina, estudos em doentes com IH demonstraram que a IH avançada está associada a níveis mais baixos de hepcidina e não parece estar correlacionada com a IL-6 neste grupo de doentes. Isto pode dever-se em parte ao aumento dos níveis de eritropoietina associados à hepicidina avançada e à supressão da hepicidina.
A deficiência de ferro é amplamente subestimada, embora possa ser detectada em quase todos os segundos pacientes. No entanto, o ferro é essencial para a respiração celular e o desempenho físico. Além disso, foi demonstrado que a deficiência de ferro afecta directamente a função cardiomiocitária humana, prejudicando a respiração mitocondrial e reduzindo a contractilidade e o relaxamento. Isto deve, portanto, ser sempre equilibrado desde o início.
Substituir cedo
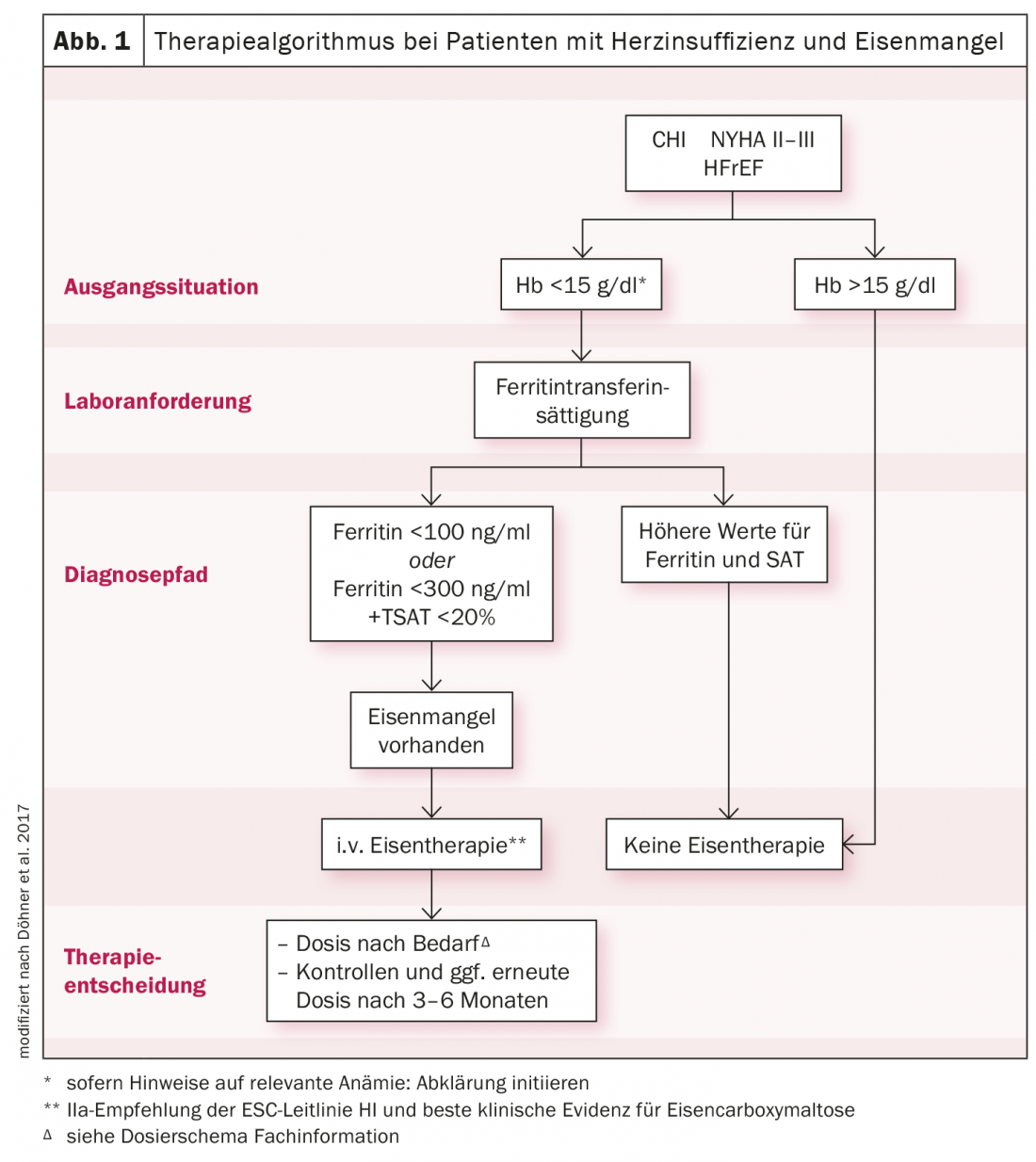
Para diagnósticos básicos, deve ser utilizado um hemograma com ferritina, saturação de transferrina (TSAT), CRP e taxa de filtração glomerular. Num doente com insuficiência cardíaca, os níveis de ferritina sérica <100 μg/l, ou níveis entre 100-300 μg/l e TSAT <20% já indicam uma deficiência de ferro que necessita de tratamento. Uma vez que a substituição oral do ferro deve ser dada durante vários meses, é apenas absorvida de forma reduzida enteralmente e não tem influência no desempenho físico, i.v. a administração de carboximaltose de ferro deve ser considerada de acordo com as directrizes do CES (Fig. 1). Desta forma, os armazéns de ferro podem ser reabastecidos de forma eficaz, eficiente e controlada durante um curto período de tempo. Os sintomas são melhorados e as taxas de hospitalização e mortalidade são reduzidas. Uma imagem semelhante é vista no paciente cardio-renal. Na fase III-IV, a deficiência de ferro pode ser diagnosticada em até 70%. Um estudo mostrou um reabastecimento significativamente mais rápido de reservas de ferro e um maior aumento dos níveis de TSAT com carboximaltose férrica do que com ferro oral.
Carboxymaltose férrica rápida eficaz
A carboximaltose férrica tem alta estabilidade complexa e pode por isso ser aplicada em doses elevadas (até 1000 mg/aplicação e semana) e num curto espaço de tempo (1000 mg em pelo menos 15 minutos com pelo menos 30 minutos de seguimento). Uma vez que o composto complexo é livre de dextrano, não são ligados quaisquer anticorpos anti-dextrano. Por conseguinte, não há um risco acrescido de reacções anafiláticas induzidas por dextrans.
Leitura adicional:
- Klip IT, et al: Am Heart J 2013; 165: 575-582.
- Ponikowski P, et al: Eur J Heart Fail 2016; 18: 891-975.
- Okonko DO, et al: J Am Coll Cardio 2011; 58: 1241-1251.
- Jankowska EA, et al: Eur Heart J 2013; 34: 816-826
- Hastka J, et al: Guidelines Iron Deficiency and Iron Deficiency Anaemia 2018.
- Hoes MF, et al: Eur J Heart Fail 2018; 20: 910-919.
- Cappellini MD, et al: Am J Hematol 2017; 92: 1068-1078.
- Lewis GD, et al: JAMA 2017; 317: 1958-1966.
- Laufs U, et al: DGK 2016; 1: 1-65.
- Anker SD, et al: Eur J Heart Fail 2018; 20: 125-133.
- Qunibi W, et al: Nephrol Dial Transplant 2011; 26: 1599-1607.
- Geisser P: Port J Nephrol Hyperert 2009; 23: 11-16.
- Neiser S, et al: Int J Mol Sci 2016; 17: 1185.
- Doehner W, et al.: Dtsch Med Wochenschr 2017; 142: 752-757.
- Ronco C, et al: J Am Coll Cardiol 2008; 52 (19): 1527-1539.
- Kovesdy CP: Rev Endocr Metab Discord 2017; 18 (1): 41-47.
- Dunn JD, et al: Am J Manag Care 2015; 21 (15 Suppl): s307-s315.
- Bushinsky DA, et al: Kidney Int 2015; 88 (6): 1427-1433.
CARDIOVASC 2021; 20(1): 18-19