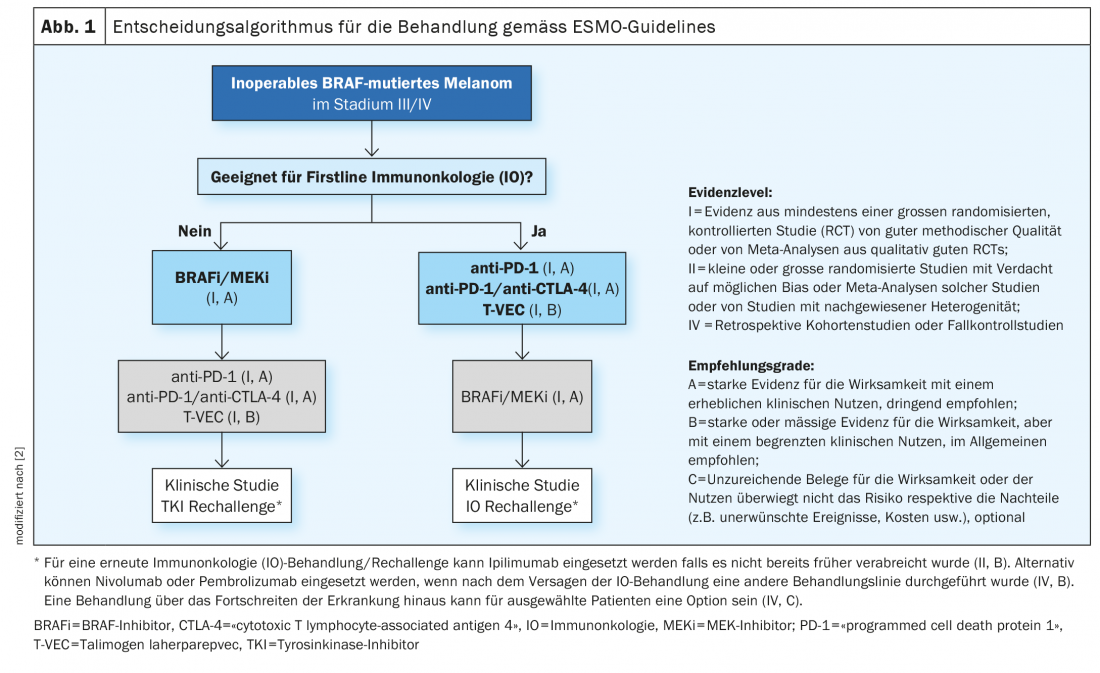
Los pacientes con melanoma metastásico no resecable con mutación BRAFV600 deben ser evaluados en primer lugar para determinar su idoneidad para la inmunoterapia. Además de la inhibición de los puntos de control, la terapia dirigida con inhibidores de BRAF-MEK también es una opción de tratamiento establecida en la actualidad. En Suiza se dispone actualmente de tres combinaciones de inhibidores de BRAF y MEK. Tanto en términos de eficacia como de tolerabilidad, el uso combinado ha demostrado ser superior a la monoterapia.
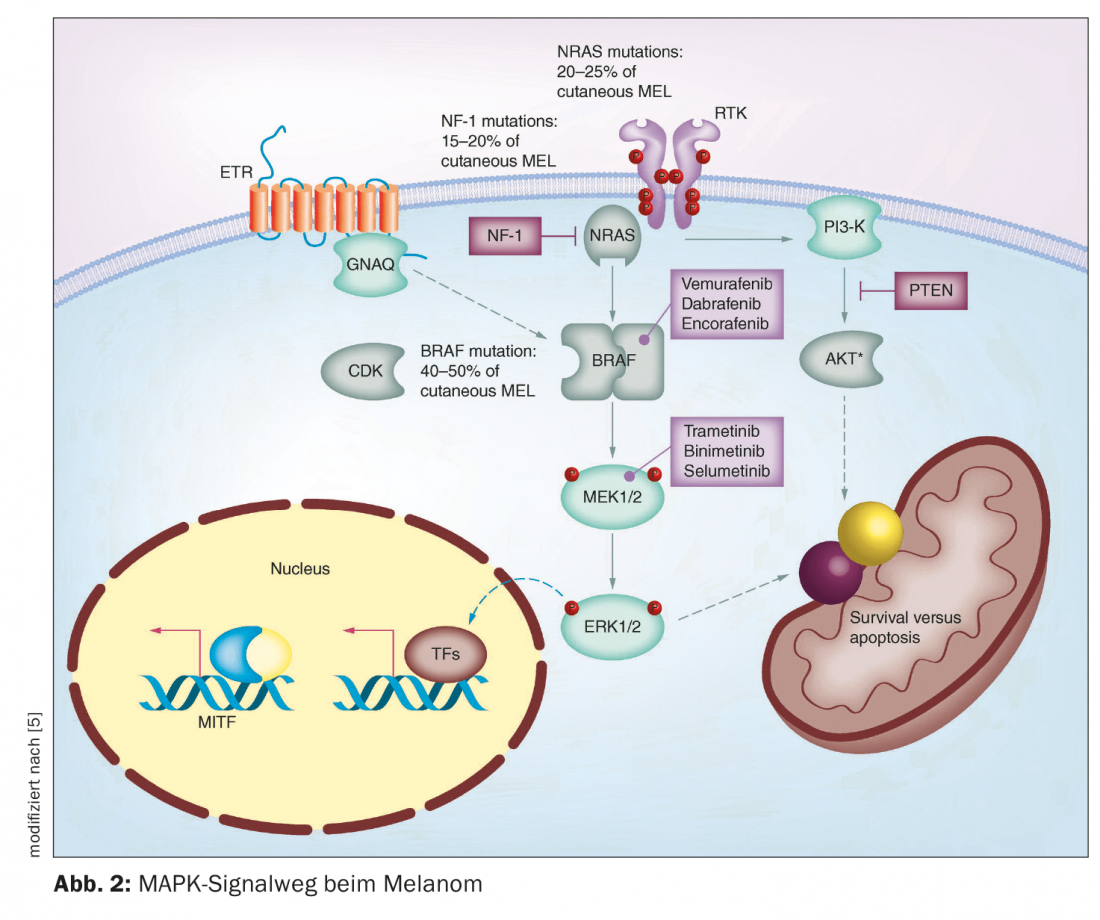
En los últimos años se han logrado varios avances en el campo de la terapia del melanoma maligno. Hasta mediados de la década de 1990, sólo se disponía de quimioterapias. Éstos impiden el crecimiento o la división celular de forma relativamente inespecífica, por lo que a veces provocan efectos secundarios considerables [1]. La aprobación en el mercado de terapias inmuno-oncológicas y dirigidas ha cambiado de forma decisiva las opciones de tratamiento del melanoma metastásico inoperable. En los pacientes con melanoma con metástasis no resecables, debe considerarse en primer lugar la opción de la inmunoterapia con inhibidores de los puntos de control. Si los pacientes son aptos para la inmunoterapia, las directrices actuales de la ESMO recomiendan la inmunoterapia con inhibidores de los puntos de control como terapia de primera línea (Fig. 1) [2]. En el melanoma metastásico no resecable con mutación de BRAF, sin embargo, también es posible el uso de una terapia dirigida con inhibición de BRAF/MEK. Tanto la inhibición de los puntos de control como la terapia dirigida tienen ventajas e inconvenientes [3]. Prof. Dr. med. Reinhard Dummer, Subdirector del Departamento. Director de la Clínica Dermatológica y Jefe del Centro de Tumores Cutáneos del Hospital Universitario de Zúrich, resumió datos importantes sobre la inhibición de BRAF/MEK en las Jornadas de Formación Dermatológica de Zúrich de este año [4]. Esta terapia combinada dirigida inhibe la vía de señalización de la “proteína quinasa activada por mitógenos” (MAPK) que se activa continuamente en las mutaciones de BRAFV600 (Fig. 2) [5].
Análisis de mutaciones para la detección de un estado de mutación BRAFV600E/K
El estado de mutación BRAFV600E/K es un requisito previo para el uso de inhibidores de BRAF/MEK. La mutación BRAF es la más común en el melanoma y suele darse en pacientes jóvenes con melanoma. A menudo se trata de pacientes que tienen muchos nevus. En particular, los nevos melanocíticos más pequeños y adquiridos tienen una frecuencia muy alta de mutaciones BRAF, afirma el Prof. Dummer. En el melanoma localmente avanzado o metastásico en estadios III y IV, debe realizarse un diagnóstico de patología molecular para determinar el estado de BRAF. [6]. El análisis de la mutación BRAF puede realizarse en material de biopsia o punch de las zonas cutáneas afectadas, así como en material tumoral fijado e incluido en parafina [7]. Mediante la técnica PCR, las regiones relevantes del gen BRAF pueden amplificarse a partir del ADN genómico y analizarse mediante secuenciación del ADN [8]. Según la Clasificación Genómica del Melanoma Cutáneo, puede hacerse una subdivisión en cuatro subtipos, que tienen prevalencias diferentes: Melanoma con mutación BRAF (50%), mutación N-Ras, K-Ras o H-Ras (25%), mutación NF1 (15%) y melanoma triple de tipo salvaje (10%) [9]. El gen BRAF codifica la serina-treonina-proteína quinasa BRAF. Esto desempeña un papel en la regulación del crecimiento celular a través de las vías de señalización MAP quinasa y Ras-Raf. Una mutación con intercambio del aminoácido valina en la posición V600 por glutamina (V600E) o por lisina (V600K) en la proteína BRAF aumenta de forma constitutiva la actividad de la quinasa BRAF [7]. Como resultado, se activa permanentemente una cascada de señalización que conduce a un crecimiento celular descontrolado.
¿Qué terapias con inhibidores de BRAF/MEK están disponibles en Suiza?
Antes de que las combinaciones de inhibidores de BRAF y MEK llegaran al mercado, los inhibidores de BRAF se probaron por primera vez en ensayos clínicos como monoterapia en comparación con la quimioterapia. Los inhibidores de la quinasa fueron muy superiores, con un cociente de riesgos instantáneos (CRI) de 0,37 a favor del dabrafenib y de 0,38 a favor del vemurafenib. “Esto supone una mejora de más del 60% en el intervalo libre de progresión con estos inhibidores. Es una diferencia enorme”, explicó el profesor Dummer. El siguiente paso fue combinar los inhibidores de BRAF y MEK en ensayos clínicos. La administración adicional de un inhibidor de MEK a un inhibidor de BRAF debería prevenir el desarrollo precoz de resistencia a través de la reactivación de la cascada MAPK y la activación paradójica de estas vías de señalización en células sanas sin mutación del gen BRAF [10].
Se llevaron a cabo estudios clínicos, en cada caso según el principio de monoterapia frente a terapia combinada, en los que siempre hubo una clara ventaja a favor de la aplicación combinada. Las terapias combinadas BRAF-i/MEK-i tienen una tolerabilidad similar o mejor que la monoterapia con BRAF-i, explica el ponente [4]. Actualmente, hay tres combinaciones BRAF-i/MEK-i disponibles en Suiza: Dabrafenib/trametinib, vemurafenib/cobimetinib, encorafenib/binimetinib. “Para el tratamiento triple, utilizamos principalmente vemurafenib/cobimetinib. Para los pacientes que se vuelven progresivos directamente después de la inmunoterapia, encorafenib/binimetinib y en el entorno adyuvante, tenemos muy buenos datos para dabrafenib/trametinib”, explica el Prof. Dummer y añade: “También tenemos muy buenos resultados para la combinación dabrafenib/trametinib para las metástasis cerebrales” [4].
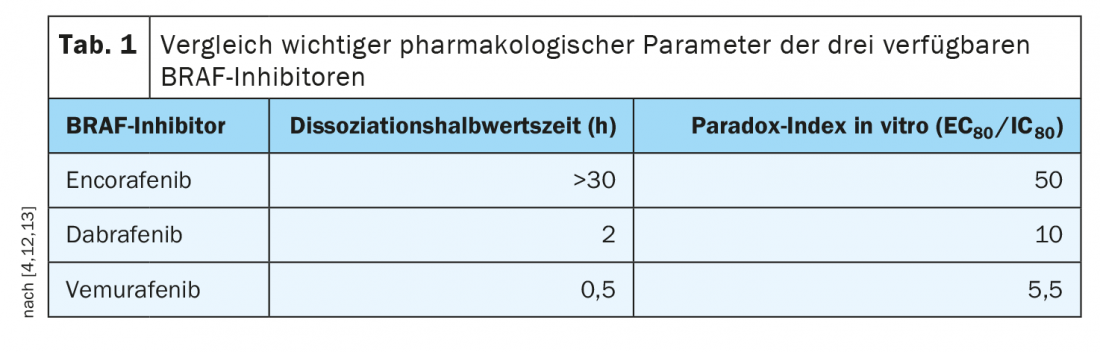

El encorafenib tiene propiedades farmacológicas beneficiosas
Los perfiles de tolerabilidad de las distintas terapias combinadas difieren algo; esto debe discutirse con los pacientes. Por ejemplo, hay pruebas de que el riesgo de pirexia (fiebre) y fotosensibilidad es menor con encorafenib/binimetinib, y existe una buena experiencia de uso a largo plazo. Mientras que con el vemurafenib la inhibición de la vía está muy estrechamente correlacionada con el nivel sérico, con el encorafenib el nivel sérico puede descender pero la inhibición permanece. Esto se prolonga durante más de 30 horas. Esta semivida de disociación especialmente larga del encorafenib (Tab. 1), significa un bloqueo estable de la vía de señalización y esto es clínicamente relevante, subraya el Prof. Dummer [4]. Además, los valores del índice Paradox, que es una medida de los efectos secundarios en las células sanas (es decir, aquellas sin mutación del gen BRAF), fueron favorables para el encorafenib, afirmó el ponente. El uso combinado de encorafenib con el inhibidor de MEK binimetinib permite aumentar la dosis de encorafenib y aumentar aún más la eficacia. “Dado que el inhibidor de MEK mejora la tolerabilidad, la dosis de encorafenib puede aumentarse en combinación con binimetinib”, explica el Prof. Dummer [4]. Esto se investigó en el ensayo de fase III COLUMBUS de tres brazos [11]. Se comparó encorafenib 450 mg (1×/d) más binimetinib 45 mg (2×/d) con encorafenib 300 mg (1×/d) más vemurafenib 960 mg (2×/d). Se incluyó a un total de 577 pacientes con melanoma con mutación BRAFV600 avanzado/metastásico recién diagnosticado o con progresión tras inmunoterapia de primera línea. La terapia combinada dirigida de encorafenib más binimetinib (COMBO450) demostró ser significativamente superior a la monoterapia con vemurafenib o encorafenib, con una mediana de SLP de 14,9 meses. En cuanto a los riesgos de efectos secundarios, ahora se sabe que la retinopatía asociada a MEK-i es completamente regresiva y no se producen daños permanentes en la retina, ni siquiera con un uso prolongado, afirma el Prof. Dummer. Si los pacientes experimentan efectos secundarios, éstos pueden tratarse localmente con agentes antiinflamatorios y suelen desaparecer al cabo de poco tiempo.
Congreso: Jornadas de formación dermatológica de Zúrich
Literatura:
- “Präzisionsonkologie – Entwicklung der medikamentösen Krebstherapie bis hin zur personalisierten Krebstherapie”, Dr Thomas Kubin, www.kliniken-suedostbayern.de/files/PDF-Dokumente/oz/Newsletter_OnkoKrebszentr_3_2021_web.pdf, (última consulta: 14.09.2022)
- Michielin O, et al: Melanoma cutáneo: Guía de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimientodagger. Ann Oncol 2019; 30(12): 1884-1901.
- Reschke R, et al: Comprensión de la terapia y calidad de vida relacionada con la salud en pacientes con melanoma en estadio III/IV tratados con nuevas terapias adyuvantes. J Dtsch Dermatol Ges 2021; 19(2): 215-222.
- “¿Qué deben saber los dermatólogos sobre los inhibidores de BRAF y MEK en el melanoma?”, Prof. Reinhard Dummer, MD, Jornadas de Formación Dermatológica de Zúrich, 16/17 de junio de 2022.
- Koelblinger P, Dornbierer J, Dummer R: Una revisión del binimetinib para el tratamiento del melanoma cutáneo mutante. Futuro Oncol 2017; 13(20): 1755-1766.
- Hoffmann M, Özdemir B: Melanoma maligno : terapia adyuvante: estado de la técnica, DERMATOLOGIE PRAXIS 2022; 32(1): 11-16.
- “Análisis de mutaciones del melanoma maligno: el camino hacia la terapia individual”, www.wisplinghoff.de/fileadmin/user_upload/Redakteure/Drucksachen/Laborinformationen/LabInfo_Mutationsanalyse_des_malignen_Melanoms_web.pdf, (última consulta: 14.09.2022)
- “Determinación del estado de mutación BRAF”, www.ukaachen.de/fileadmin/files/institute/pathologie/Bestimmung_des_BRAF-Mutationsstatus_v2022.pdf, (última consulta: 14.09.2022)
- Akbani R, et al: Clasificación genómica del melanoma cutáneo. Cell 2015; 161(7): 1681-1696.
- Hermann RM, Christiansen H: Melanoma metastásico con mutación de BRAF: Primeros datos sobre la eficacia a largo plazo de las terapias dirigidas. Radiation Oncol 2019; 195: 940-942.
- Dummer R, et al: Encorafenib más binimetinib frente a vemurafenib o encorafenib en pacientes con melanoma mutante para BRAF (COLUMBUS): un ensayo de fase 3 multicéntrico, abierto y aleatorizado. Lancet Oncol 2018; 19(5): 603-615.
- Koelblinger P, Thuerigen O, Dummer R: Desarrollo del encorafenib para el melanoma avanzado con mutación de BRAF. Curr Opin Oncol. 2018;30(2): 125-133.
- Adelmann C, et al.: Perfiles comparativos de los inhibidores de BRAF: el índice de paradoja como predictor de la toxicidad clínica. Oncotarget 2016; 7: 30453-30460.
PRÁCTICA DERMATOLÓGICA 2022; 32(5): 43-45