La lévodopa (L-dopa) est toujours considérée comme le traitement de référence de la maladie de Parkinson. Elle permet au patient d’obtenir un bon contrôle des symptômes sur une longue période, avec en parallèle une bonne qualité de vie. Que peut-on faire ?
La lévodopa (L-dopa) est toujours considérée comme le traitement de référence de la maladie de Parkinson. Elle permet au patient d’obtenir un bon contrôle des symptômes sur une longue période, avec en parallèle une bonne qualité de vie [1]. Cependant, après un succès thérapeutique initial, les fluctuations d’efficacité sont quasiment inévitables au cours du traitement. Les complications qui en résultent sont avant tout des fluctuations motrices (FM) et des dyskinésies.
Traitement «state-of-the-art» de la maladie de Parkinson
La maladie de Parkinson est aujourd’hui considérée comme un spectre de maladies, le terme Parkinson englobant un groupe de maladies hétérogènes qui présentent un large éventail de symptômes moteurs et non moteurs. Alors que les symptômes non moteurs – tels que les troubles du sommeil, les douleurs ou les changements d’humeur – étaient autrefois considérés comme des symptômes accessoires, force est de constater aujourd’hui qu’ils constituent l’un des principaux problèmes de la maladie de Parkinson, du moins à long terme. Ces symptômes montrent une réponse variable au traitement de substitution dopaminergique. Il est aujourd’hui estimé que jusqu’à 15% des maladies de Parkinson ont une origine génétique (tout au moins comme facteur de risque pour le développement d’une maladie de Parkinson). La progression de la neurodégénérescence et l’évolution clinique de la maladie sont variables, ce qui rend particulièrement difficile l’établissement de pronostics cliniques; la relation entre le phénotype clinique et la pathologie est faible, voire inexistante. Les tentatives cliniques ou basées sur des données d’identifier des sous-types de la maladie de Parkinson en vue d’estimer ensuite le pronostic clinique échouent souvent. Le syndrome parkinsonien à prédominance de tremblements, qui présente la plupart du temps un bon pronostic, constitue souvent une exception [2]. Même les syndromes parkinsoniens monogéniques peuvent avoir une présentation clinique variable.
La base du traitement de la maladie de Parkinson reste à ce jour la substitution dopaminergique par lévodopa, toujours en association avec les inhibiteurs de la décarboxylase carbidopa ou bensérazide. Les inhibiteurs de la décarboxylase inhibent la dégradation périphérique de la L-dopa et augmentent ainsi sa biodisponibilité [3]. La L-dopa est transformée en dopamine dans le cerveau et est captée par les terminaisons dopaminergiques, elle est sécrétée sous forme de dopamine et stimule en particulier les récepteurs dopaminergiques D1 et D2 postsynaptiques. Cela a pour effet de rétablir la fonction physiologique de la boucle de régulation ganglions de la base-cortex moteur-thalamus, qui régule la motricité [4]. Lorsque le système de régulation est stimulé avec trop peu de dopamine, il en résulte un effet de freinage, alors qu’un excès de dopamine tend à accélérer les mouvements. C’est également la base de la survenue de dyskinésies ou de dystonies et de troubles moteurs hyperkinétiques. La courte demi-vie de la L-dopa, qui entraîne une stimulation pulsatile non physiologique des récepteurs de la dopamine, est en outre responsable des fluctuations d’efficacité du traitement de substitution. Enfin, les vésicules dopaminergiques qui ne sont pas bien remplies jouent également un rôle majeur dans les fluctuations d’efficacité du traitement.
Initiation du traitement
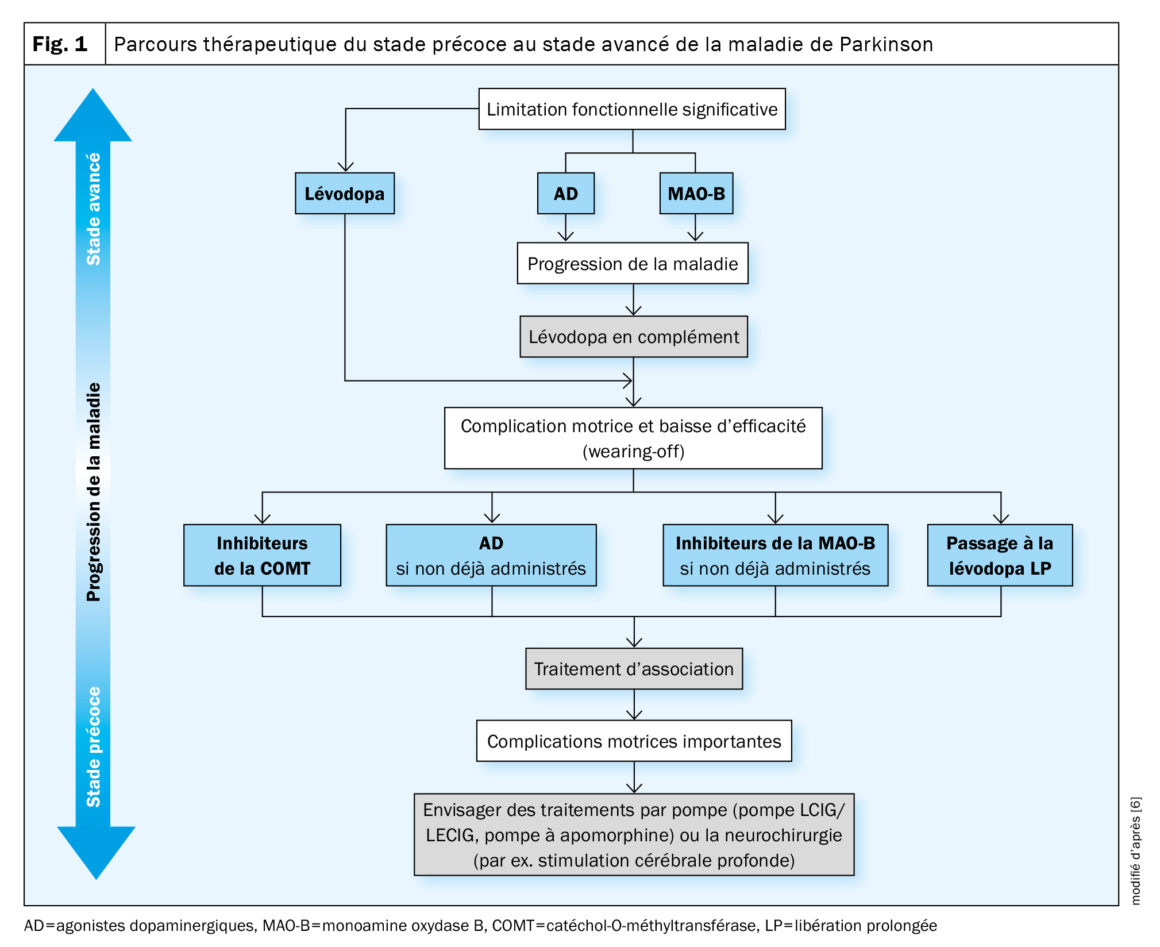
Chez les patients âgés de >70 ans et/ou présentant des comorbidités, le traitement de la maladie de Parkinson commence généralement par la lévodopa. Les personnes plus jeunes et/ou sans comorbidités ou présentant des symptômes légers débutent souvent le traitement avec un inhibiteur de la MAO-B et/ou un agoniste dopaminergique (Fig. 1) [5,6]. Cependant, les patients qui débutent avec un inhibiteur de la MAO-B requièrent presque toujours de la L-dopa en complément au cours de leur traitement.
L’avantage des agonistes dopaminergiques par rapport à la lévodopa est qu’ils ont une demi-vie plus longue et sont mis à la disposition du cerveau de manière plus homogène. Cependant, des effets indésirables neuropsychiatriques, une fatigue diurne ou des accès de sommeil soudains et des œdèmes peuvent survenir. En particulier l’apparition de troubles du contrôle des impulsions est typique et doit être évitée [6].
Une fois la lune de miel terminée
En plus du recueil de l’anamnèse avec un interrogatoire ciblé des patients et des aidants sur les fluctuations d’efficacité, il est possible de recourir à des questionnaires (Wearing-off Questionnaire de Mark Stacy et al.), qui aident à mettre en évidence nettement plus de fluctuations d’efficacité que le simple interrogatoire. Au cours des dernières années, il est apparu que le traitement par lévodopa, qui semble si efficace au début de la maladie (phase de lune de miel), a finalement une influence défavorable sur la motricité. La fenêtre thérapeutique de la L-dopa devient de plus en plus étroite en raison de la progression de la neurodégénérescence et de la sensibilisation des récepteurs de la dopamine qui en découle. La maladie de Parkinson se caractérise donc d’une part par une évolution neurodégénérative naturelle, mais son traitement est d’autre part rendu encore plus compliqué par l’apparition, au fil du temps, de complications liées au traitement. Un à deux ans seulement après le début du traitement par lévodopa, on observe des fluctuations motrices chez 20–30% des patients, ce pourcentage atteignant même ≥50% après 5 ans [7].
Avec la progression de la maladie, il se produit une diminution des terminaisons dopaminergiques dans le système nerveux central. D’autres types de neurones, qui sont également en mesure de métaboliser la lévodopa, doivent compenser ce phénomène, comme par ex. les neurones sérotoninergiques. Ces neurones ne produisent pas seulement de la sérotonine, mais aussi de la dopamine, mais ne peuvent recapter que la sérotonine, ce qui signifie que la dopamine sécrétée reste dans la fente synaptique, s’y accumule et entraîne des taux de dopamine fluctuants, qui ne sont plus stables, dans le striatum. Ces derniers provoquent à leur tour une sensibilisation des récepteurs postsynaptiques et des neurones dopaminergiques postsynaptiques en aval, ce qui entraîne diverses modifications, notamment une sensibilité accrue dans le système moteur avec l’apparition de dyskinésies. En outre, il se produit également des perturbations des circuits dopaminergiques de la régulation cognitive et émotionnelle, ce qui peut être à l’origine de troubles psychiatriques et comportementaux chez les patients. De plus, la pathologie de l’alpha-synucléine s’étend également aux noyaux non dopaminergiques du cerveau et entraîne des troubles fonctionnels de ces derniers (Aperçu 1).
Lévodopa: pas d’effet modificateur de la maladie
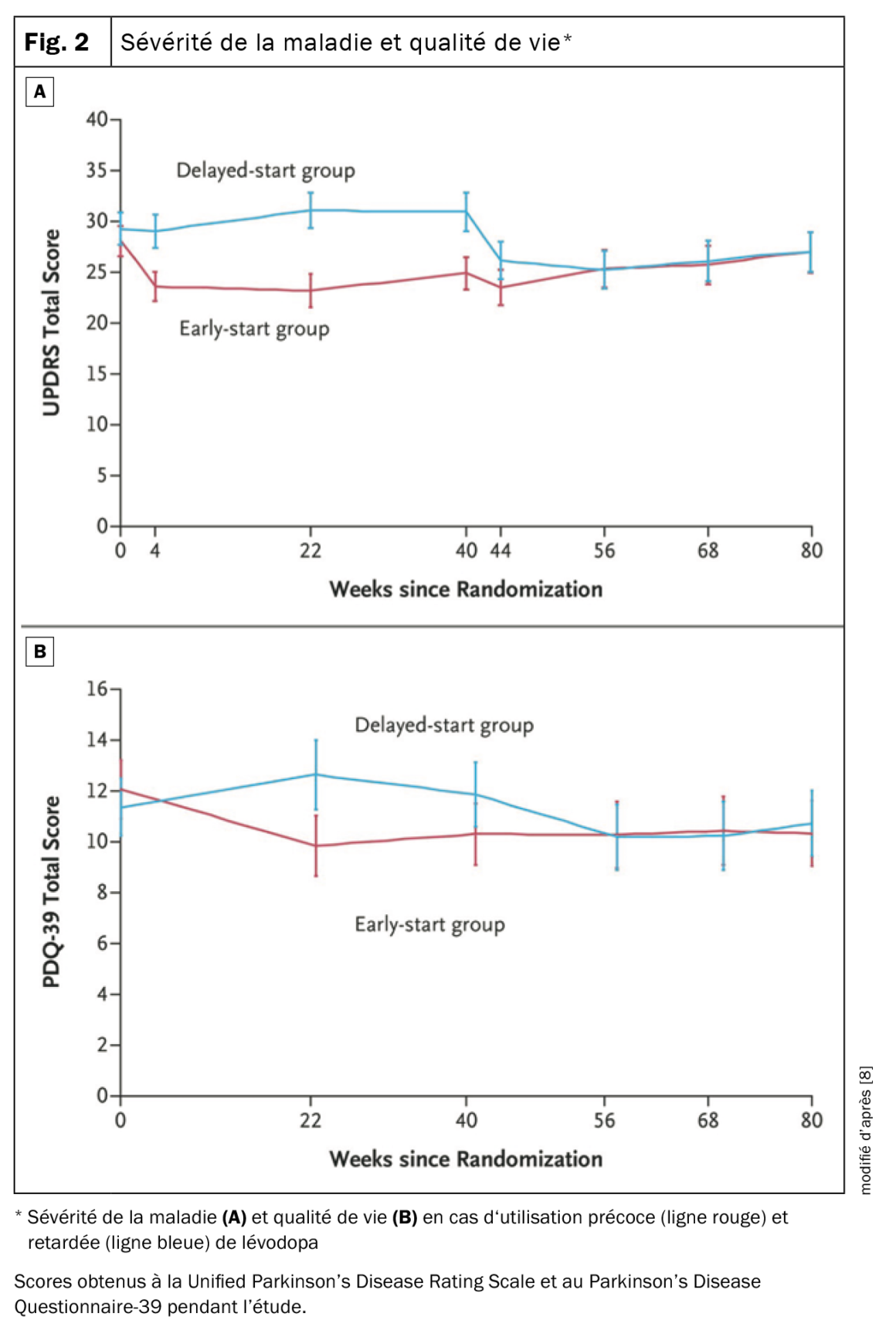
Une étude néerlandaise de 2019 a confirmé que la lévodopa n’est ni neurotoxique ni neuroprotectrice [8]. Dans le cadre d’un plan d’étude à début différé, un groupe est traité immédiatement et un autre de manière différée avec une substance dont il est supposé qu’elle pourrait avoir un effet modificateur de la maladie. Si le traitement avait effectivement un effet modificateur de la maladie, les courbes indiquant l’évolution de la maladie auraient dû évoluer parallèlement après l’utilisation différée. Au lieu de cela, les courbes ont convergé: il y avait un effet symptomatique – les patients sous lévodopa dans l’étude décrite avaient une maladie moins sévère sur l’échelle UPDRS (Fig. 2A). Le groupe ayant reçu de la lévodopa en différé a présenté le même effet, mais plus tard, et à la fin, tous les patients étaient au même niveau. Cela s’est également exprimé en termes de qualité de vie (Fig. 2B) – le décalage dans le temps a eu pour conséquence que les patients de ce groupe ont eu une moins bonne qualité de vie pendant une plus longue période. En termes de qualité de vie et de réduction des symptômes, il n’y a donc aucune raison de priver les patients de L-dopa. C’est la substance la plus puissante et c’est celle qui apporte la meilleure qualité de vie dans les stades précoces. L’utilisation retardée ne présente aucun avantage en termes d’efficacité de la substance.
En ce qui concerne les complications à long terme, une étude a été menée sur une période de suivi allant jusqu’à 14 ans afin de déterminer si l’initiation du traitement avec un agoniste dopaminergique présentait un avantage à long terme par rapport à la lévodopa seule ou à la sélégiline [9]. La bromocriptine a certes montré un petit avantage pendant une courte période, mais celui-ci a rapidement disparu. Par la suite, l’agoniste dopaminergique n’a présenté aucun avantage d’efficacité par rapport à la lévodopa dans le cadre d’un traitement à long terme. La plupart des patients requièrent de toute façon de la lévodopa en complément au bout de quelques années au cours d’un traitement de longue durée. De même, aucune différence n’a été constatée au niveau de l’apparition de fluctuations d’efficacité (avant tout dyskinésies).
Privation de qualité de vie
Des chercheurs italiens, en collaboration avec des collègues ghanéens, ont apparié des cas de maladie de Parkinson en Italie et dans ce pays africain, en partant du principe qu’en Europe, dans un système de santé bien développé, l’initiation d’un traitement n’est pas retardée, alors qu’au Ghana, cela n’est pas garanti [10]. Au Ghana, les patients atteints de la maladie de Parkinson ne peuvent pas être diagnostiqués facilement et le traitement ne peut être mis en place que tardivement en raison du manque de neurologues et de moyens financiers.
En se basant sur le début présumé de la maladie, les chercheurs ont comparé la durée pendant laquelle les patients sont restés non diagnostiqués, à partir de quand ils ont ensuite été traités par lévodopa en Italie et au Ghana, et à partir de quand des complications secondaires telles que le wearing-off ou les dyskinésies sont apparues. Les patients italiens ont été diagnostiqués en moyenne 3,5 ans après le début des symptômes et ont ensuite reçu de la L-dopa. Des wearing-offs sont survenus après environ 5,5 ans. Les patients ghanéens, en revanche, sont restés très longtemps non diagnostiqués, suite à quoi ils ont été diagnostiqués mais n’ont pas reçu de médicaments (obligation de faire des économies) jusqu’à ce que leur état se détériore. La lévodopa leur a été administrée après 5,9 ans en moyenne, mais un wearing-off et des dyskinésies sont apparus après quelques mois seulement. Cette économie n’a donc eu pour effet que de raccourcir la période de lune de miel et de priver les patients d’une période de bonne qualité de vie.
Les résultats de cette étude ont notamment conforté l’hypothèse selon laquelle en particulier le degré de neurodégénérescence dans le striatum est décisif pour déterminer quand les fluctuations et les dyskinésies apparaissent dans le cadre d’un traitement par L-dopa.
Contrer les complications motrices
Les fluctuations motrices (FM) sont associées à une moins bonne qualité de vie [11]. Comme déjà expliqué, elles sont dues en particulier à l’effet pulsatile de la lévodopa et à son dosage trop élevé. Pour y remédier, il est recommandé de choisir la dose de L-dopa la plus faible possible avec une durée d’action la plus longue possible (stimulation dopaminergique continue, SDC) [12]. Une option pour réduire les FM consiste à utiliser des substances entraînant une stimulation prolongée des récepteurs de la dopamine en complément de la L-dopa [13]. Il existe cependant un risque d’effets indésirables, avec un bénéfice global sur les troubles moteurs plus faible qu’avec la L-dopa.
Le problème avec la sécrétion de dopamine: en cas de maladie de Parkinson avancée, la capacité de stockage de la dopamine est épuisée, les pics et les creux des concentrations plasmatiques de L-dopa entraînent plus rapidement des dyskinésies et des temps off en raison du manque de vésicules dopaminergiques. Pour les praticiens, cela signifie qu’il ne faut pas augmenter la dose de lévodopa, car cela augmente également le risque de dyskinésies, et qu’il faut également éviter d’augmenter la fréquence d’administration de la L-dopa, car cela ne change rien au problème des pics de concentration plasmatique sans adaptation de la dose de lévodopa (réduction), avec en plus une influence croissante des repas sur la concentration de lévodopa.
La première fluctuation motrice qui se manifeste au cours de la maladie est souvent ce que l’on appelle le «early-morning off», dans lequel l’efficacité du traitement ne suffit plus dans la deuxième moitié de la nuit ou le matin [14]. La raison en est la diminution de la sécrétion endogène de dopamine (env. 40%) pendant la nuit en raison du rythme circadien [15]. Au fur et à mesure de l’évolution de la maladie, le wearing-off se produit également pendant la journée, ce qui s’explique par la courte demi-vie de la lévodopa et le déclin de la capacité de stockage des neurones présynaptiques [16]. Le début d’action retardé de la lévodopa (delayed-on) résulte d’une vidange gastrique retardée et d’une absorption intestinale limitée de la lévodopa. Le temps off se compose donc du wearing-off et du delayed-on, ce dernier pouvant être nettement prédominant [6].
Inhibiteurs de la DDC, de la COMT et de la MAO-B
Afin d’optimiser le mécanisme d’action de la lévodopa, plusieurs principes actifs puissants complémentaires sont aujourd’hui disponibles: inhibiteurs de la dopa-décarboxylase (inhibiteurs de la DDC, carbidopa, bensérazide), inhibiteurs de la catéchol-O-méthyltransférase (inhibiteurs de la COMT, tolcapone, entacapone, opicapone) et inhibiteurs de la monoamine oxydase B (inhibiteurs de la MAO-B, sélégiline (non disponible en Suisse), rasagiline, safinamide) [17]. Une double inhibition, avec l’ajout d’un inhibiteur de la DDC et d’un inhibiteur de la COMT à la lévodopa, peut permettre une réduction de 30–50% de la variabilité plasmatique [18]. Un effet supplémentaire bienvenu de la double inhibition est en outre la possibilité de réduire la dose de L-dopa, ce qui est associé à une diminution du risque de FM.
Les objectifs thérapeutiques primaires dans la prise en charge des FM incluent une bonne mobilité constante, une absence maximale de symptômes moteurs et non moteurs, ainsi que le maintien de l’autonomie. Parmi les options d’adaptation thérapeutique possibles en cas de wearing-off figurent:
- l’administration d’agonistes dopaminergiques,
- le fractionnement accru des doses de L-dopa,
- l’utilisation de préparations à base de lévodopa à libération prolongée (principalement pour la nuit) et
- l’association avec des inhibiteurs de la COMT ou des inhibiteurs de la MAO-B [5].
Tout comme les inhibiteurs de la décarboxylase, les inhibiteurs de la COMT agissent au niveau périphérique: en inhibant la catéchol-O-méthyltransférase (COMT), ils empêchent la dégradation de la lévodopa en 3-O-méthyldopa (3-OMD) et augmentent ainsi sa biodisponibilité dans le plasma [6]. Contrairement à l’entacapone et à l’opicapone, la tolcapone a également un faible effet sur la COMT dans le cerveau, mais elle ne joue plus qu’un rôle secondaire en raison de son hépatotoxicité potentielle. Les inhibiteurs de la MAO-B augmentent les concentrations striatales de dopamine en bloquant la dégradation cérébrale de la dopamine par la monoamine-oxydase B. Comme décrit, il est toutefois important pour l’efficacité des inhibiteurs de la MAO-B qu’une quantité minimale de dopamine striatale soit disponible [6].
Le choix de l’inhibiteur de la COMT doit se faire individuellement et être adapté à la situation pathologique du patient. Le statut d’autorisation doit également être pris en compte: l’opicapone et l’entacapone peuvent être utilisées comme traitement complémentaire à la lévodopa et à un inhibiteur de la DDC chez les patients présentant des fluctuations motrices de fin de dose [19,20]. En revanche, en raison de sa toxicité hépatique, la tolcapone est autorisée en association avec la lévodopa et un inhibiteur de la DDC uniquement chez les patients qui présentent des fluctuations de la mobilité et qui ne répondent pas aux autres inhibiteurs de la COMT ou ne les tolèrent pas [21].
L’opicapone a une demi-vie très courte, de 1,0–1,4 h, mais une longue durée d’action en raison de sa longue demi-vie d’inhibition de >100 heures [22]. Après 24 h, l’activité de la COMT est encore réduite d’env. 65%. Cette durée d’action présente l’avantage d’une inhibition stable et durable de la COMT et permet une administration quotidienne unique, alors que la tolcapone est prise 3 fois par jour et que pour l’entacapone, jusqu’à 6 prises par jour ne sont pas rares [22]. L’entacapone possède également une courte demi-vie (environ 2,5 h) et en plus une courte demi-vie d’inhibition et doit donc être prise avec chaque dose de lévodopa. Comme l’effet de l’inhibition de la COMT varie en raison de la courte demi-vie, il y a un risque que la plage de fluctuation des concentrations de lévodopa soit moins réduite que prévu avec l’entacapone, contrairement à l’opicapone [6].
Les inhibiteurs de la COMT peuvent augmenter et lisser les concentrations plasmatiques de L-dopa. L’étude randomisée en double aveugle STRIDE-PD a donc examiné si l’initiation d’un traitement combiné par lévodopa/carbidopa/entacapone (LCE) par rapport à un traitement par lévodopa/carbidopa seul permettait de retarder l’apparition de dyskinésies en lissant les concentrations actives (stimulation pulsatile réduite) [23]. Le critère d’évaluation primaire de l’étude n’a cependant pas été atteint: on a même constaté un délai d’apparition des dyskinésies significativement plus court (hazard ratio, HR, 1,29; p=0,04) et des dyskinésies significativement plus fréquentes (42% vs. 32%; p=0,02) chez les patients sous LCE par rapport à ceux sous lévodopa/carbidopa [24]. De plus, les complications motrices et les dyskinésies n’étaient pas associées à la durée du traitement par lévodopa, mais à une durée plus longue de la maladie et à des doses plus élevées de lévodopa [10].
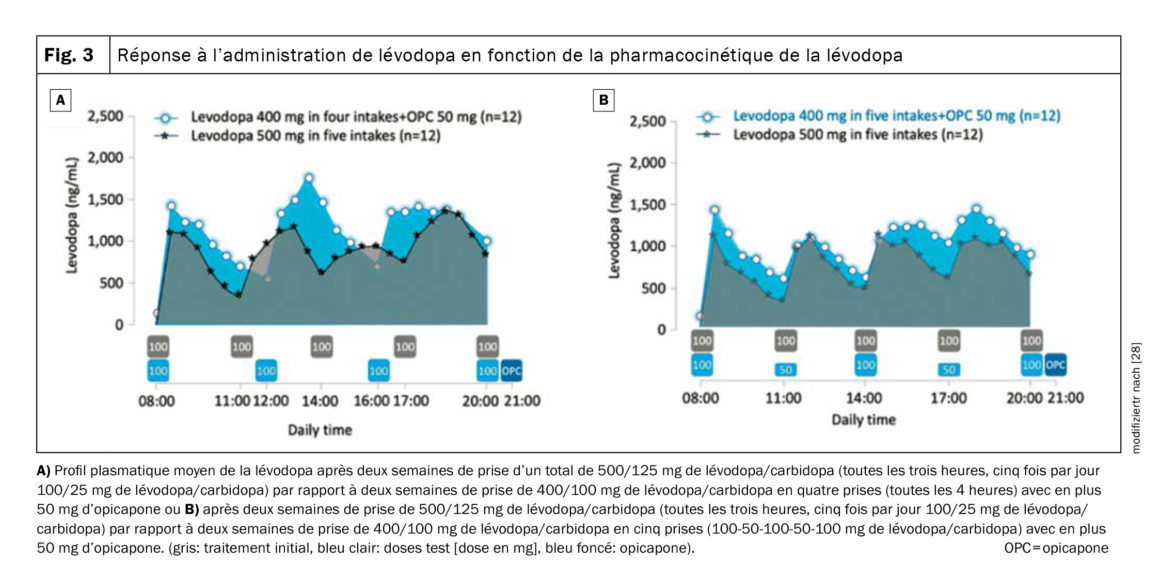
Pour l’utilisation des inhibiteurs de la COMT dans la pratique, cela signifie que la lévodopa devrait être administrée uniquement à la dose nécessaire pour obtenir un effet satisfaisant. Le sexe et le poids du patient doivent être pris en compte pour déterminer la dose. Cela a été démontré récemment dans une étude de Ferreira et al. [26] (Fig. 3). Dans cette étude, les auteurs ont pu démontrer qu’après un traitement initial par 5× 100 mg de L-dopa/carbidopa, les patients qui ont reçu 400 mg de L-dopa/carbidopa en cinq prises (100-50-100-50-100 mg) avec en plus 50 mg d’opicapone avaient la pharmacocinétique la plus stable et donc probablement aussi la meilleure stimulation continue des récepteurs de la dopamine. La pharmacocinétique, c’est-à-dire les pics et les creux de concentration plasmatique, était un peu moins bonne sous 4× 100 mg de L-dopa/carbidopa avec en plus 50 mg d’opicapone. Cette étude nous apprend donc que chez certains patients recevant de l’opicapone en raison de symptômes de wearing-off, il faut réduire la L-dopa/carbidopa et trouver la répartition optimale de la L-dopa/carbidopa. Des données issues d’études cliniques montrent en outre que chez les patients présentant des fluctuations motrices débutantes (FM <1 an) et des stades moins avancés de la maladie (stade Hoehn & Yahr <2,5), l’opicapone est associée à une réduction du temps off plus importante que la moyenne dans les études [27]. Des visites de contrôle du patient dans les premières semaines après l’initiation d’un traitement par un inhibiteur de la COMT sont conseillées afin de pouvoir ajuster la dose de L-dopa si nécessaire [6].
Conclusion
La lévodopa est le traitement de référence dans la maladie de Parkinson et elle est administrée à pratiquement tous les patients atteints de la maladie de Parkinson au cours de leur maladie. La survenue de fluctuations motrices sous ce traitement est toutefois fréquente. Pour traiter ces fluctuations, il existe différents principes actifs (inhibiteurs de la DDC, de la COMT et de la MAO-B) qui doivent être utilisés pour optimiser le traitement par L-dopa. Il faut souligner ici la capacité des inhibiteurs de la COMT, comme le montre notamment l’étude récente de Ferreira et al. avec l’opicapone [26], de lisser les concentrations plasmatiques de L-dopa et de rétablir ainsi la stimulation dopaminergique continue. L’adaptation thérapeutique la plus appropriée doit être déterminée individuellement.
Take-Home-Messages
- Le traitement de la maladie de Parkinson doit être individualisé en fonction de l’effet attendu sur les symptômes invalidants.
- La probabilité d’effets indésirables doit être prise en compte en considérant l’âge, le stade de la maladie, les comorbidités et la médication concomitante du patient.
- Le choix et l’escalade des médicaments ou des interventions doivent être effectués dans le but de maintenir un état fonctionnel optimal le plus longtemps possible (phase de lune de miel).
- Un traitement à long terme par L-dopa est associé à des fluctuations d’efficacité, mais il n’existe cependant pas de meilleure option thérapeutique et les patients ne devraient dès lors pas en être privés.
Références:
- Oertel WH, Berardelli A, Bloem BR, et al.: European handbook of neurological management 2011, Bd. 1, 217–236.
- Espay AJ, et al.: Nat Rev Neurol 2019; 15: 189–190;
doi: 10.1038/s41582-019-0153-9. - Tambasco N, Romoli R, Calabresi P.: Curr Neuropharmacol 2018; 16(8): 1239–1252.
- Poewe W, et al.: Nat Rev Dis Primers 2017; 3: 17013.
- AWMF S3-Leitlinie Idiopathisches Parkinson-Syndrom 2016.
AWMF-Register-Nummer: 030-010 - Jost WH, Buhmann C, Classen J, et al.: Der Nervenarzt 2022; 93: 1035–1045; doi: 10.1007/s00115-021-01237-3.
- Stocchi F, Antonini A, Barone P, et al.: Park Relat Disord 2014; 20: 204–211.
- Verschuur CVM, et al.: N Engl J Med 2019; 380: 315–324; doi: 10.1056/NEJMoa1809983.
- Katzenschlager R, et al.: Neurology 2008; 71: 474–480.
- Cilia R, et al.: Brain 2014; 137: 2731–2742; doi: 10.1093/brain/awu195.
- Hechtner MC, et al.: Park Rel Disord 2014; 20: 969–974.
- Fahn S: J Neural Transm Suppl 2006; 70: 419–426.
- Olanow CW, et al.: Mov Disord 2020; 35: 1731–1744.
- Stocchi F, Coletti C, Bonassi S, et al.: Eur J Neurol 2019; 26(5): 821–826.
- Richter D, Bartig D, Jost WH, et al.: J Neural Transm 2019; 126(7): 879–888.
- Chaudhuri KR, Poewe W, Brooks D: Mov Disord 2018; 33: 909–919.
- Carta M, Carlsson T, Muñoz A, et al.: Mov Disord 2010; 1: 174–179.
- Cattaneo C, La Ferla R, Bonizzoni E, et al.: J Parkinsons Dis 2015; 5(3): 475–481.
- Orion Pharma, Fachinformation Comtess 2019.
- Bial – Portela & Ca, Fachinformation Ongentys 2020.
- MEDA Pharma, Fachinformation Tasmar 2020.
- Rocha F, Almeida L, Falcão A, et al.: Br J Clin Pharmacol 2013; 76(5): 763–775.
- Seemann P: Synapse 2015; 69: 183–189.
- Stocchi F, Rascol O, Kieburtz K, et al.: Ann Neurol 2010; 68(1): 18–27.
- Olanow CW, et al.: Mov Disord 2013; 28: 1064–1071.
- Ferreira JJ, Poewe W, Rascol O, et al.: Mov Disord 2022; 37(11): 2272–2283; doi: 10.1002/mds.29193.
- Rocha JF, Ebersbach G, Lees A, et al.: Frontiers in neurology 2021; 12: 754016; doi: 10.3389/fneur.2021.754016.
- EMJ 2022; 7(4): 20–27; doi: 10.33590/emj/10022165.