La thrombocytémie essentielle apparaît généralement après l’âge de 50 ans, bien qu’il existe également des personnes de moins de 40 ans. Plusieurs sous-types peuvent être distingués sur la base d’analyses génétiques moléculaires. Les complications typiques de la maladie sont les thromboses et les hémorragies. Une stratification des risques est nécessaire pour que les patients puissent bénéficier à temps d’un traitement adéquat. Il existe aujourd’hui différents modèles de pronostic qui ont été testés dans des études de cohorte à grande échelle.
Les néoplasies myéloprolifératives (NMP) sont des maladies des cellules souches hématopoïétiques et présentent un éventail varié de manifestations cliniques et d’anomalies moléculaires [1,2]. La thrombocytémie essentielle (TE) est un MPN qui se développe à partir d’une cellule souche hématopoïétique. Une mutation JAK2 est présente chez environ la moitié des patients atteints de TE, une mutation dans le gène CALR ou MPL est moins fréquente et aucune de ces mutations n’est détectable chez 10 à 15% des patients atteints de TE. Bien que l’ET soit considéré comme le MPN le plus indolent, il est associé à des symptômes vasomoteurs pénibles et à des complications potentiellement mortelles telles que des thromboses, des hémorragies et la progression de la maladie vers une myélofibrose et des néoplasmes myéloïdes agressifs [3]. L’évaluation pronostique du risque est importante pour une intervention opportune et adaptée au risque avec les options de traitement disponibles. Cependant, la prédiction du risque s’avère difficile car il s’agit d’une maladie chronique rare et cliniquement hétérogène [4].
Plusieurs modèles de pronostic ont été développés pour évaluer le risque de thrombose ou la survie globale (SG) en cas d’ET. La plupart des systèmes de pronostic permettant d’identifier les patients à risque de thrombose et d’hémorragie reposent sur l’identification de facteurs de risque tels que les complications thromboemboliques ou les hémorragies graves, l’âge ≥60 ans, les plaquettes ≥1,5 million/µl [5]. L’IPSET (International Prognostic Score for Thrombosis in Essential Thrombocythemia) ou IPSET-Survival prend également en compte les facteurs de risque cardiovasculaire et la présence d’une mutation JAK2 V617F [6–8].
Les patients porteurs d’une mutation CALR présentent un risque de thrombose plus faible que les patients porteurs d’une mutation JAK2 [9]. Dans le modèle de pronostic actuel “triple AAA” pour la survie globale, l’âge (Age), le nombre absolu de neutrophiles (Absolute neutrophil count , ANC) et le nombre absolu de lymphocytes (Absolute lymphocyte count, ALC) sont utilisés pour stratifier le risque de TE [10]. Les “mutations non inductrices” peuvent également avoir une influence sur le pronostic et sont utilisées par exemple dans le MIPSS-ET (mutation-enhanced international prognostic system for essential thrombocythaemia) [11].
Quels sont les principaux facteurs de risque ?
Deux grandes cohortes rétrospectives de TE ont récemment été publiées par des chercheurs de la Mayo Clinic américaine (Gangat et al.) et du Centre de recherche et d’innovation sur les néoplasmes myéloprolifératifs (Loscocco et al.), situé en Italie [12,13]. Les deux études ont confirmé les facteurs de risque de thrombose, de progression et/ou de décès précédemment identifiés dans la TE, dont les suivants :
- un âge plus avancé (âge ≥60),
- sexe masculin,
- un nombre élevé de globules blancs (WBC >11 × 109/L),
- une augmentation du nombre absolu de neutrophiles (ANC ≥8 × 109/L),
- un faible taux de lymphocytes absolus (ALC <1,7 × 109/L) au moment de la présentation.
Erdos et al. ont évalué ces paramètres et les modèles de risque actuels dans une cohorte de 328 patients adultes atteints de TE traités au Weill Cornell Medicine à New York (États-Unis) sur une période médiane de 6 ans [14]. Cette cohorte a été strictement définie selon les critères diagnostiques de l’Organisation mondiale de la santé de 2022, de sorte qu’une biopsie de moelle osseuse diagnostique a été réalisée chez tous les patients et que les diagnostics alternatifs ont été soigneusement exclus [15]. Comme le soulignent Gangat et al. [12] et Loscocco et al. [13] Erdos et al. ont également constaté que les patients atteints d’ET mutée par JAK2 avaient une survie sans thrombose (TFS) significativement plus courte que les patients atteints d’ET mutée par CALR. Au total, 33 thromboses sont survenues (15 veineuses, 18 artérielles), dont 27 (12 veineuses, 15 artérielles) concernaient des patients mutés JAK2. Dans les modèles multivariables, l’augmentation du risque de thrombose chez les ET mutés JAK2 par rapport aux CALR/MPL était principalement due à des événements thrombotiques veineux. Comme pour le CRIMM, l’IPSET a montré que le TFS distinguait principalement les ET à très faible et à haut risque, tandis que le TFS différenciait mal les groupes intermédiaires, avec une aire sous la courbe (AUC) de la courbe d’optimisation du récepteur (ROC) de seulement 0,63.
Conclusion de plusieurs études indépendantes
L’étude d’Erdos et al. publiée en 2023 est en accord avec les principaux résultats des deux grandes cohortes de Gangat et al. et Loscocco et al. et confirme que le risque à long terme d’événements liés à l’ET peut être stratifié sur la base d’informations cliniques facilement disponibles telles que l’âge, les mutations pilotes et l’hémogramme [12–15].
Ensemble, ces études indépendantes démontrent ce qui suit :
- La TE mutée JAK2 est associée à un risque accru de thrombose par rapport aux autres types de TE
- Les événements thrombotiques sont rares chez les patients atteints d’ET mutée CALR.
- Les mutations CALR et MPL augmentent significativement le risque de progression de la myélofibrose
- la mutation du pilote n’est pas prédictive de l’OS
- le score de thrombose IPSET révisé stratifie le risque de thrombose à long terme très faible et élevé, mais obtient globalement de moins bons résultats que les données réelles
- L’AAA et, dans une moindre mesure, la survie IPSET sont pronostiques pour la survie globale (OS), l’âge ayant la plus grande influence sur le risque.
En résumé, ces études soulignent le besoin de modèles dynamiques de thrombose, de progression et de survie dans l’ET, qui incluent des facteurs modifiables pouvant être ciblés pour réduire le risque.
Objectif thérapeutique prioritaire : prophylaxie de la thrombose adaptée au risque
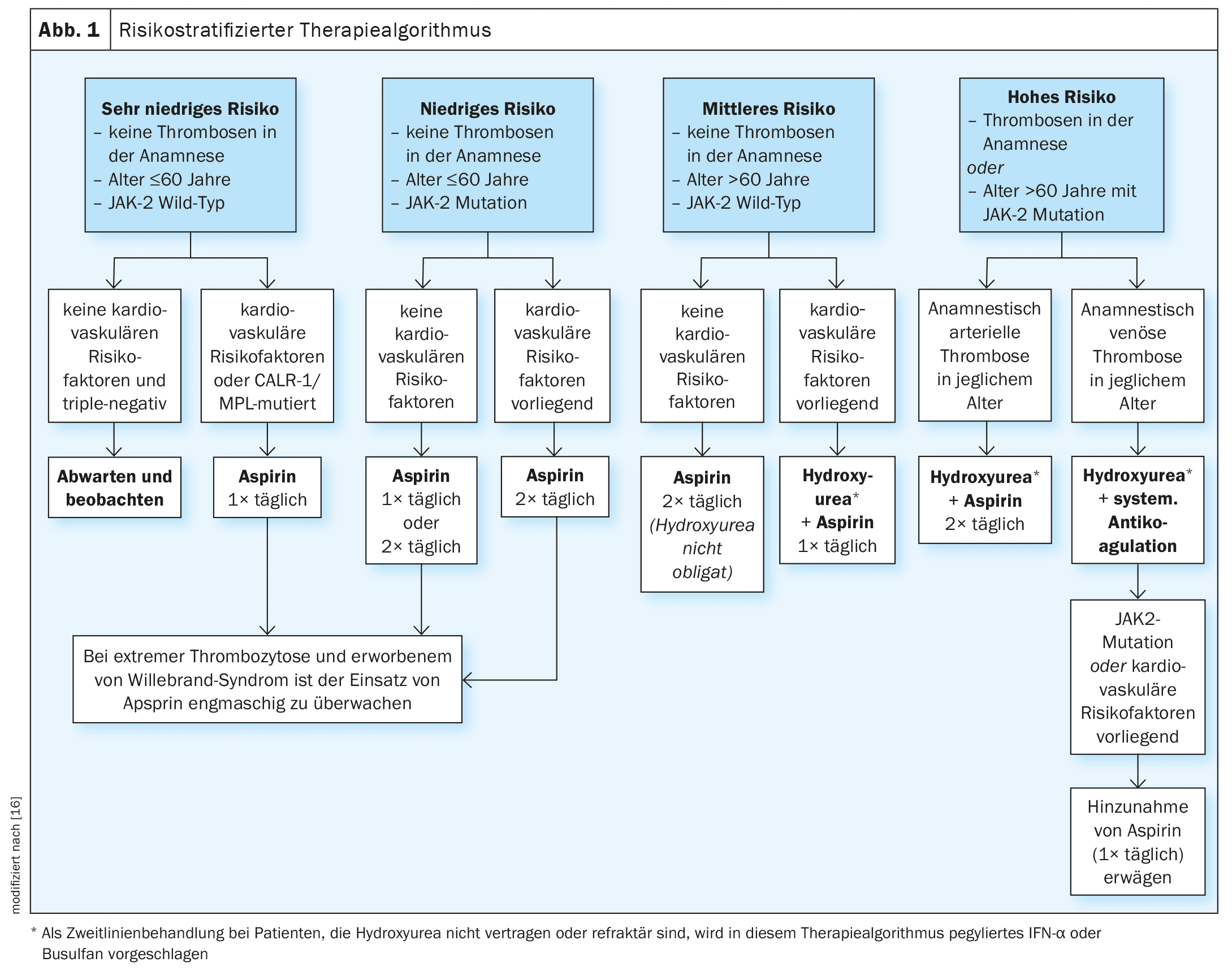
Il n’existe actuellement aucun traitement curatif de l’ET. Les principaux objectifs du traitement sont la réduction des symptômes et des complications liés à la maladie, ainsi que la réduction du risque thromboembolique et des facteurs de risque cardiovasculaire. Dans une publication de Tefferi et al. publiée en 2024, une stratégie de traitement de l’ET stratifiée en fonction du risque est esquissée (figure 1), avec une classification en quatre niveaux de risque [16].
- très faible (âge ≤60 ans, pas d’antécédents de thrombose, JAK2 de type sauvage)
- faible (comme très faible, mais présence d’une mutation JAK2)
- moyen (âge >60 ans, pas d’antécédents de thrombose, JAK2 sauvage)
- élevé (antécédents de thrombose ou âge >60 ans avec mutation JAK2).
Le risque de thrombose chez les patients à très faible risque et présentant un statut de mutation triple négatif serait trop faible pour justifier une quelconque forme de traitement. Toutefois, en présence de facteurs de risque cardiovasculaire ou de mutations CALR/MPL, la prise d’acide acétylsalicylique (aspirine, une fois par jour) est recommandée [12,13]. Chez les patients à faible risque, l’aspirine est conseillée à la fois en l’absence et en présence de facteurs de risque cardiovasculaire. Pour les patients à risque moyen, l’aspirine est actuellement recommandée deux fois par jour, et l’association d’un médicament cytoréducteur (hydroxyurée) et d’aspirine une fois par jour s’est avérée efficace chez les patients à risque moyen présentant des facteurs de risque cardiovasculaire. Il s’agit de recommandations thérapeutiques fondées sur des preuves. Dans la cohorte de la Mayo Clinic, l’aspirine a eu un effet bénéfique sur les événements thrombotiques artériels et veineux, tandis que dans la cohorte Florence, des effets protecteurs similaires ont été observés pour le traitement cytoréducteur [12,13]. Chez les patients présentant une tendance aux saignements, l’utilisation de l’aspirine doit être étroitement surveillée ou faire l’objet d’un examen hématologique.
Congrès : EHA2024
Littérature :
- Oncopedia : Néoplasies myéloprolifératives, www.onkopedia.com/de/onkopedia/guidelines/myeloproliferative-neoplasien-mpn-frueher-chronische-myeloproliferative-erkrankungen-cmpe/@@guideline/html/index.html, (dernière consultation 22.10.2024).
- Mahmud M, et al : Myeloproliferative Neoplasms : Contemporary Review and Molecular Landscape. Int J Mol Sci 2023 ; 24(24) : 17383.
- Abu-Zeinah G, et al. : Are thrombosis, progression, and survival in ET predictable ? Blood Cancer J 2024 ; 14 : 103, https://doi.org/10.1038/s41408-024-01079-7.
- Tefferi A, et al : Long-term survival and blast transformation in molecularly annotated essential thrombocythemia, polycythemia vera, and myelofibrosis. Blood 2014 ; 124 : 2507-2513.
- “Thrombocytémie essentielle”, www.mll.com/myeloproliferative-neoplasien-mpn/essentielle-thrombozythaemie-et,(dernière consultation 22.10.2024)
- Barbui T, et al. : Développement et validation d’un score pronostique international de la thrombose dans la thrombocythémie essentielle de l’Organisation mondiale de la santé (IPSET-thrombose). Blood 2012 ; 120(26) : 5128-5133.
- Haider M, et al. : Validation de la révision du score pronostique international de thrombose pour la thrombocythémie essentielle (IPSET-thrombosis) chez 585 patients de la Mayo Clinic. Am J Hematol 2016 ; 91(4) : 390-394.
- Barbui T, et al : Practice-relevant revision of IPSET-thrombosis based on 1019 patients with WHO-defined essential thrombocythemia. Blood Cancer J 2015 ; 5 : e369-e36.
- Torregrosa JM et al : L’activation leucocytaire imparfaite souligne le risque thrombotique plus faible des patients atteints de thrombocythémie essentielle avec des mutations CALR par rapport à ceux avec la mutation JAK2. Br J Haematol 2016 ; 172(5) : 813-815.
- Tefferi A et al : modèle de risque “triple A” globalement applicable pour la thrombocythémie essentielle basé sur l’âge, le nombre absolu de neutrophiles, et le nombre absolu de lymphocytes. Am J Hematol 2023 ; 98(12) : 1829-1837.
- Tefferi A, et al : Mutation-enhanced international prognostic systems for essential thrombocythaemia and polycythaemia vera. Br J Haematol 2020 ; 189 : 291-302.
- Gangat N, et al : One thousand patients with essential thrombocythemia : the Mayo Clinic experience. Blood Cancer J 2024 ; 14 : 1-11.
- Loscocco GG, et al : One thousand patients with essential thrombocythemia : the Florence-CRIMM experience. Blood Cancer J 2024 ; 14 : 1-12.
- 14 Erdos K, et al : Les mutations CALR à faible risque de thrombose confèrent un risque plus élevé de progression de la thrombocythémie essentielle. Blood 2023 ; 142 : 1819-1819.
- Abu-Zeinah G, et al : L’interféron-alpha pour le traitement de la polycythémie vera améliore la survie globale et sans myélofibrose. Leucémie 2021 ; 35 : 2592-2601.
- Tefferi A, Vannucchi AM, Barbui T : Thrombocythémie essentielle : mise à jour 2024 sur le diagnostic, la stratification des risques, et la prise en charge. Am J Hematol 2024 ; 99(4) : 697-718.
HAUSARZT PRAXIS 2024 ; 19(11) : 32-33 (publié le 22.11.24, ahead of print)