La trombocitemia essenziale si manifesta di solito dopo i 50 anni, anche se ci sono anche persone colpite al di sotto dei 40 anni. Si possono distinguere vari sottotipi in base alle analisi genetiche molecolari. Le complicazioni tipiche della malattia sono trombosi ed emorragie. La stratificazione del rischio è necessaria per fornire ai pazienti un trattamento adeguato in tempo utile. Attualmente esistono diversi modelli prognostici che sono stati testati in studi di coorte su larga scala.
Le neoplasie mieloproliferative (MPN) sono malattie delle cellule staminali ematopoietiche e presentano un diverso spettro di manifestazioni cliniche e anomalie molecolari [1,2]. La trombocitemia essenziale (ET) è una MPN che ha origine da una cellula staminale ematopoietica. Una mutazione JAK2 si trova in circa la metà dei pazienti ET, meno frequentemente c’è una mutazione nel gene CALR o MPL e nel 10–15% di tutti i pazienti ET nessuna di queste mutazioni è rilevabile. Sebbene l’ET sia considerata la MPN più indolente, è associata a sintomi vasomotori angoscianti e a complicazioni potenzialmente fatali, come trombosi, emorragie e progressione della malattia verso la mielofibrosi e le neoplasie mieloidi aggressive [3]. La valutazione prognostica del rischio è importante per un intervento tempestivo adattato al rischio con le opzioni terapeutiche disponibili. Tuttavia, la previsione del rischio è difficile in quanto si tratta di una malattia cronica rara e clinicamente eterogenea [4].
Sono stati sviluppati diversi modelli prognostici per valutare il rischio di trombosi e la sopravvivenza globale (OS) nell’ET. La maggior parte dei sistemi prognostici per identificare i pazienti a rischio di trombosi ed emorragia si basa sull’identificazione di fattori di rischio come le complicanze tromboemboliche o le emorragie maggiori, l’età ≥60 anni, le piastrine ≥1,5 milioni/µl [5]. [6–8] Nell’IPSET (International Prognostic Score for Thrombosis in Essential Thrombocythemia) o IPSET-Survival, vengono presi in considerazione anche i fattori di rischio cardiovascolare e la presenza di una mutazione JAK2 V617F.
I pazienti con una mutazione CALR presentano un rischio minore di trombosi rispetto ai pazienti con una mutazione JAK2 [9]. Nell’attuale modello prognostico “Triple-AAA” per la sopravvivenza globale, l’età, la conta assoluta dei neutrofili (ANC) e la conta assoluta dei linfociti (ALC) sono utilizzati per la stratificazione del rischio nell’ET [10]. Anche le “mutazioni non-driver” possono avere un’influenza sulla prognosi e sono utilizzate, ad esempio, nel MIPSS-ET (sistema prognostico internazionale per la trombocitemia essenziale potenziato dalle mutazioni) [11].
Quali sono i fattori di rischio più importanti?
[12,13]Recentemente, due grandi coorti retrospettive di ET sono state pubblicate dai ricercatori della Mayo Clinic statunitense (Gangat et al.) e del Centro Ricerca e Innovazione sulle Neoplasie Mieloproliferative con sede in Italia (Loscocco et al.). Entrambi gli studi hanno confermato i fattori di rischio precedentemente identificati per la trombosi, la progressione e/o la morte nell’ET, che includono i seguenti:- un’età più avanzata (età ≥60),
- sesso maschile,
- >un aumento dei globuli bianchi (WBC 11 ×109/L),
- un aumento della conta assoluta dei neutrofili (ANC ≥8 ×109/L),
- <una bassa conta assoluta dei linfociti (ALC 1,7 ×109/L) al momento della presentazione.
Erdos et al. hanno analizzato questi parametri e gli attuali modelli di rischio in una coorte di 328 pazienti adulti affetti da ET trattati presso la Weill Cornell Medicine di New York (USA) per un periodo mediano di 6 anni [14]. Questa coorte è stata definita rigorosamente secondo i criteri diagnostici dell’Organizzazione Mondiale della Sanità del 2022, per cui in tutti i pazienti è stata eseguita una biopsia diagnostica del midollo osseo e sono state accuratamente escluse diagnosi alternative [15]. Come Gangat et al. [12] e Loscocco et al. [13] Erdos et al. hanno anche scoperto che i pazienti con ET mutata in JAK2 avevano una sopravvivenza libera da trombosi (TFS) significativamente più breve rispetto ai pazienti con ET mutata in CALR. Si sono verificate in totale 33 trombosi (15 venose, 18 arteriose), di cui 27 (12 venose, 15 arteriose) hanno coinvolto pazienti con JAK2-mutati. Nei modelli multivariabili, l’aumento del rischio di trombosi nell’ET mutata in JAK2 rispetto alla CALR/MPL era dovuto principalmente agli eventi trombotici venosi. Analogamente a CRIMM, si è riscontrato che IPSET discrimina la TFS principalmente tra ET a rischio molto basso e alto, mentre la TFS discriminava poco tra i gruppi intermedi, con un’area sotto la curva (AUC) della curva caratteristica operativa del ricevitore (ROC ) di solo 0,63.
Conclusione di diversi studi indipendenti
Lo studio di Erdos et al. pubblicato nel 2023 è coerente con i principali risultati delle due grandi coorti di Gangat et al. e Loscocco et al. e conferma che il rischio a lungo termine di eventi correlati all’ET può essere stratificato sulla base di informazioni cliniche facilmente disponibili, come l’età, le mutazioni del driver e l’emocromo [12–15].
Presi insieme, questi studi indipendenti dimostrano quanto segue:
- L’ET mutata in JAK2 è associata a un rischio maggiore di trombosi rispetto ad altri tipi di ET.
- Gli eventi trombotici si verificano raramente nei pazienti con ET mutato in CALR.
- Le mutazioni CALR e MPL aumentano in modo significativo il rischio di progressione della mielofibrosi.
- la mutazione del driver non è prognostica per l’OS
- il punteggio di trombosi IPSET rivisto stratifica il rischio di trombosi a lungo termine molto basso e alto, ma ha un rendimento complessivo peggiore rispetto ai dati reali
- L’AAA e, in misura minore, la sopravvivenza IPSET sono prognostici per la sopravvivenza globale (OS), con l’età che ha la maggiore influenza sul rischio.
In sintesi, questi studi sottolineano la necessità di modelli dinamici di trombosi, progressione e sopravvivenza nell’ET che includano fattori modificabili che possano essere mirati alla riduzione del rischio.
Obiettivo terapeutico primario: profilassi della trombosi adattata al rischio.
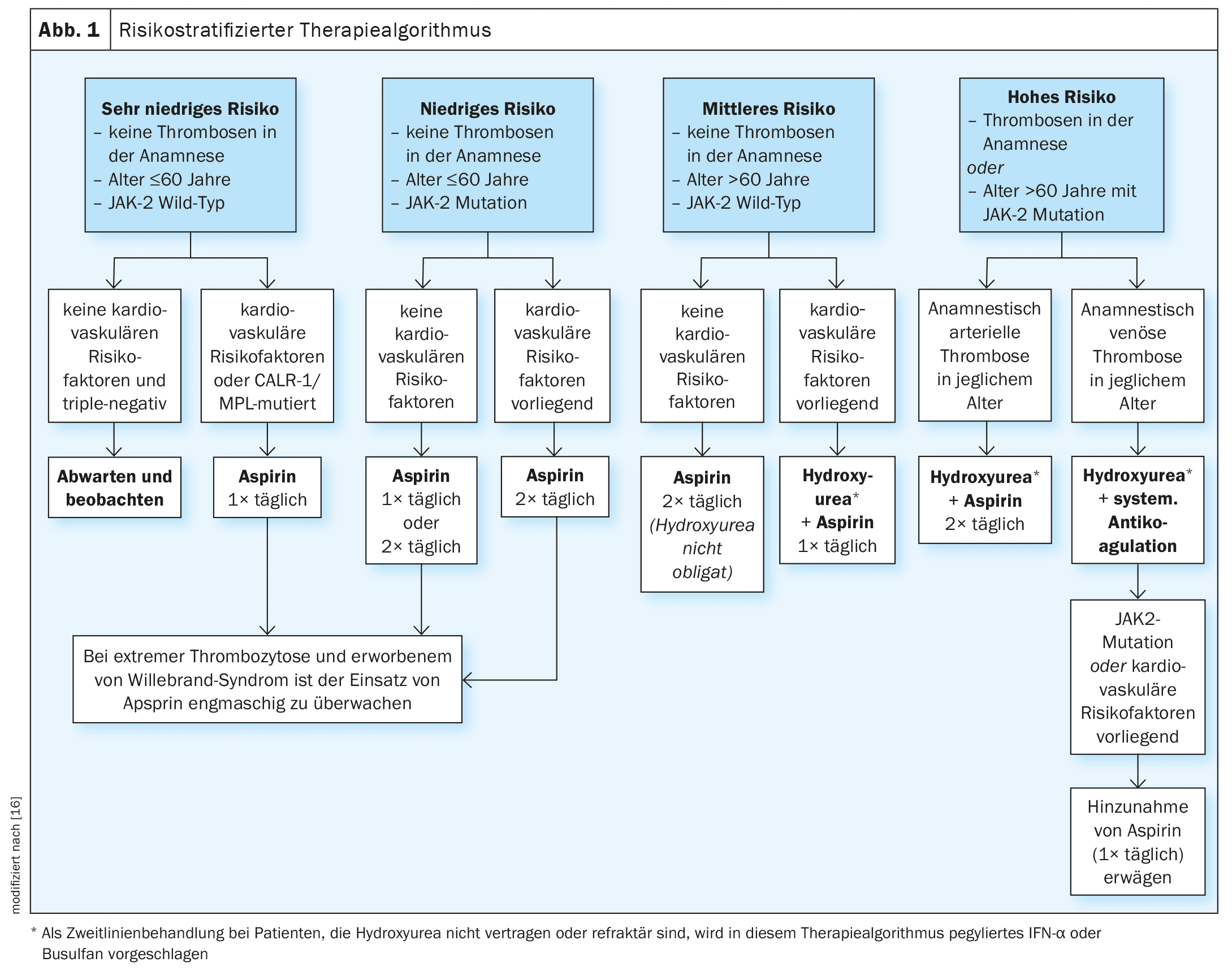
Attualmente non esiste una terapia curativa per l’ET. Gli obiettivi principali del trattamento sono la riduzione dei sintomi e delle complicanze legate alla malattia e la riduzione del rischio di tromboembolismo e dei fattori di rischio cardiovascolare. [16] Una pubblicazione di Tefferi et al. pubblicata nel 2024 delinea una strategia di trattamento stratificata in base al rischio per l’ET (Fig. 1), che è suddivisa in quattro livelli di rischio.
- Molto basso (età ≤60 anni, nessuna storia di trombosi, JAK2 wild type)
- basso (come molto basso, ma mutazione JAK2 presente)
- medio (età >60 anni, nessuna storia di trombosi, JAK2 wild type)
- alta (storia di trombosi o età >60 anni con mutazione JAK2).
Il rischio di trombosi nei pazienti con rischio molto basso e stato di mutazione tripla negativa è troppo basso per giustificare qualsiasi forma di terapia. [12,13] Tuttavia, in presenza di fattori di rischio cardiovascolare o di mutazioni CALR/MPL, si raccomanda l’uso di acido acetilsalicilico (aspirina, una volta al giorno). Nei pazienti a basso rischio, l’aspirina è raccomandata sia in assenza che in presenza di fattori di rischio cardiovascolare. Per i pazienti a rischio intermedio, attualmente si raccomanda l’aspirina due volte al giorno, anche se la combinazione di un farmaco citoriduttivo (idrossiurea) con l’aspirina una volta al giorno si è dimostrata efficace nei pazienti a rischio intermedio con fattori di rischio cardiovascolare. Si tratta di raccomandazioni terapeutiche basate sull’evidenza. [12,13] Nella coorte della Mayo Clinic, l’aspirina ha avuto un effetto favorevole sugli eventi trombotici sia arteriosi che venosi, mentre effetti protettivi simili sono stati osservati per la terapia citoriduttiva nella coorte di Firenze. Nei pazienti con tendenza al sanguinamento, l’uso dell’aspirina deve essere strettamente monitorato o chiarito ematologicamente.
Congresso: EHA2024
Letteratura:
- Onkopedia: Neoplasie mieloproliferative, www.onkopedia.com/de/onkopedia/guidelines/myeloproliferative-neoplasien-mpn-frueher-chronische-myeloproliferative-erkrankungen-cmpe/@@guideline/html/index.html, (ultimo accesso 22 ottobre 2024).
- Mahmud M, et al: Neoplasie mieloproliferative: revisione contemporanea e panorama molecolare. Int J Mol Sci 2023; 24(24): 17383.
- Abu-Zeinah G, et al: Trombosi, progressione e sopravvivenza nell’ET sono prevedibili? Blood Cancer J 2024; 14: 103, https://doi.org/10.1038/s41408-024-01079-7.
- Tefferi A, et al: Sopravvivenza a lungo termine e trasformazione dei blasti nella trombocitemia essenziale con annotazione molecolare, nella policitemia vera e nella mielofibrosi. Sangue 2014; 124: 2507-2513.
- “Trombocitemia essenziale”, www.mll.com/myeloproliferative-neoplasien-mpn/essentielle-thrombozythaemie-et,(ultimo accesso 22.10.2024)
- Barbui T, et al: Sviluppo e validazione di un punteggio prognostico internazionale di trombosi nella trombocitemia essenziale dell’Organizzazione Mondiale della Sanità (IPSET-trombosi). Sangue 2012; 120(26): 5128-5133.
- Haider M, et al: Validazione del punteggio prognostico internazionale rivisto della trombosi per la trombocitemia essenziale (IPSET-thrombosis) in 585 pazienti della Mayo Clinic. Am J Hematol 2016; 91(4): 390-394.
- Barbui T, et al: Revisione rilevante per la pratica dell’IPSET-trombosi basata su 1019 pazienti con trombocitemia essenziale definita dall’OMS. Blood Cancer J 2015; 5: e369-e36.
- Torregrosa JM et al: L’attivazione leucocitaria compromessa è alla base del minor rischio trombotico dei pazienti affetti da trombocitemia essenziale con mutazioni CALR rispetto a quelli con la mutazione JAK2. Br J Haematol 2016; 172(5): 813-815.
- Tefferi A et al: Modello di rischio “tripla A” applicabile a livello globale per la trombocitemia essenziale basato su età, conta assoluta dei neutrofili e conta assoluta dei linfociti. Am J Hematol 2023; 98(12): 1829-1837.
- Tefferi A, et al: Sistemi prognostici internazionali potenziati dalle mutazioni per la trombocitemia essenziale e la policitemia vera. Br J Haematol 2020; 189: 291-302.
- Gangat N, et al: Mille pazienti con trombocitemia essenziale: l’esperienza della Mayo Clinic. Blood Cancer J 2024; 14: 1-11.
- Loscocco GG, et al: Mille pazienti con trombocitemia essenziale: l’esperienza di Firenze-CRIMM. Blood Cancer J 2024; 14: 1-12.
- 14 Erdos K, et al: Le mutazioni CALR a basso rischio di trombosi conferiscono un rischio maggiore di progressione della trombocitemia essenziale. Sangue 2023; 142: 1819-1819.
- Abu-Zeinah G, et al: L’interferone-alfa per il trattamento della policitemia vera produce un miglioramento della sopravvivenza libera da mielofibrosi e della sopravvivenza globale. Leucemia 2021; 35: 2592-2601.
- Tefferi A, Vannucchi AM, Barbui T: Trombocitemia essenziale: aggiornamento 2024 su diagnosi, stratificazione del rischio e gestione. Am J Hematol 2024; 99(4): 697-718.
HAUSARZT PRAXIS 2024; 19(11): 32-33 (pubblicato il 22.11.24, prima della stampa)