Lors du congrès de l’European Association of Dermato-Oncology (EADO) de cette année, les recommandations actuelles sur la prise en charge du carcinome épidermoïde cutané (cSCC) ont été expliquées. Le traitement de première intention reste l’excision complète avec contrôle histologique du bord de coupe. Une radiothérapie adjuvante peut être envisagée en fonction du risque de récidive. Dans le cas du CSCN avancé non résécable, l’inhibition du point de contrôle immunitaire est considérée comme un traitement de première ligne. En cas de contre-indications, des agents chimiothérapeutiques ou des inhibiteurs de l’EGFR peuvent être utilisés. Le suivi doit être adapté au risque et inclure une échographie des ganglions lymphatiques pour les patients à haut risque.
Le carcinome épidermoïde de la peau – une néoplasie maligne des kératinocytes épidermiques – est la tumeur maligne de la peau la plus fréquente chez l’homme après le carcinome basocellulaire. Le professeur Alexander J. Stratigos, MD, Département de dermatologie-vénéréologie, Hôpital Andreas Sygros, Université nationale et capodistrienne d’Athènes (Grèce) a résumé de manière concise les connaissances actuelles sur le diagnostic et le traitement du carcinome épidermoïde cutané(cSCC) en se référant à diverses lignes directrices internationales [1]. Les lignes directrices européennes (EDF/EADO/EORTC), publiées en 2020, sont actuellement en cours de révision – la nouvelle version devrait être publiée prochainement – et les lignes directrices américaines (NCCN) sont publiées à un rythme annuel [1–4].
Le cSCC est plus fréquent chez les hommes et se produit à 80% dans la région de la tête et du visage ou dans des zones d’exposition chronique aux rayons UV. Le risque de développer la maladie augmente considérablement avec l’âge. Si la présence d’un cSCC est suspectée, il est recommandé d’inspecter l’ensemble du tégument. “Nous devons bien décrire les lésions, documenter les symptômes et également mesurer la taille des lésions”, a souligné le professeur Stratigos [1]. Outre la dermatoscopie, l’utilisation d’autres méthodes de diagnostic non invasives, telles que la microscopie confocale au laser et la tomographie par cohérence optique, est utile, notamment à des fins de diagnostic différentiel.
Le cSCC peut métastaser de manière primaire dans les ganglions lymphatiques régionaux et former des métastases à distance. Un diagnostic précoce et un traitement adapté au risque sont donc essentiels. En cas de suspicion clinique de CCSC, l’obtention d’une histologie doit également être effectuée pour différencier une autre néoplasie bénigne ou maligne. Si le tableau clinique est clair pour un cSCC, une résection complète est recommandée.
L’excision avec examen histologique reste le traitement standard.
L’objectif de l’excision chirurgicale est une résection complète, y compris le retraitement des marges de coupe périphériques et profondes [1]. Le traitement chirurgical local est fortement influencé par la précision du contrôle histologique de l’incision, a expliqué le professeur Stratigos. Dans la mesure du possible, un système de rapport standardisé doit être utilisé pour la lecture histologique des cSCC, avec des informations sur les critères suivants : Sous-type histologique (desmoplastique, acantholytique, etc.), degré de différenciation histologique, épaisseur maximale de la tumeur, profondeur de pénétration de la tumeur (au-dessus ou au-delà du tissu adipeux sous-cutané), invasion périneurale, invasion lymphatique/vasculaire, résection complète possible/non possible, marges de coupe minimales et maximales [1].
Biopsie du ganglion lymphatique sentinelle : utile ?
L’indication d’une biopsie du ganglion lymphatique sentinelle (SLNB) chez les patients atteints de CCSC est controversée, a indiqué le professeur Stratigos [1]. En l’absence de données valides sur la valeur pronostique et thérapeutique, le SLNB n’est pas recommandé par défaut dans les lignes directrices européennes. Il n’existe aucune preuve que les patients dont le ganglion sentinelle est positif ont de moins bons résultats que ceux dont le ganglion est négatif, a expliqué l’orateur.
Quels sont les principaux facteurs pronostiques ?
Entre les lignes directrices européennes publiées en 2020 et les lignes directrices américaines publiées en 2022, il existe un consensus selon lequel, chez les patients atteints de CCSP, outre l’immunosuppression, les facteurs spécifiques à la tumeur suivants augmentent considérablement le risque de métastases et de mortalité spécifique à la maladie [1–4]:
- épaisseur verticale de la tumeur (>6 mm)
- diamètre horizontal de la tumeur (>2 cm ou >4 cm)
- différenciation histologique
- Desmoplasie
- croissance périneurale
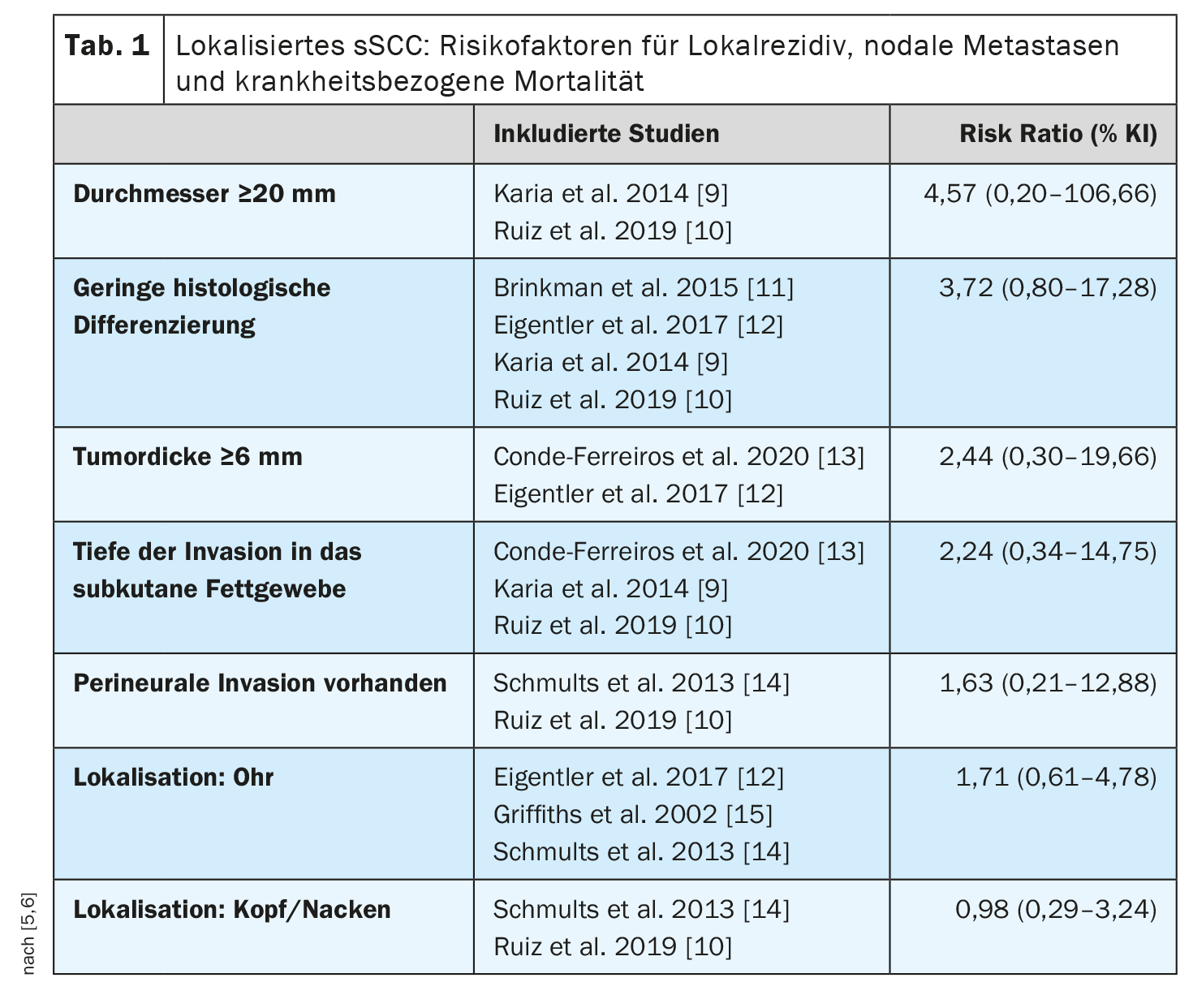
Cela concorde avec une méta-analyse publiée en 2022 qui a identifié les facteurs de risque associés au décès lié à la maladie chez les patients atteints de CCSP localisé (sans métastases locorégionales ou à distance) [5,6] (tableau 1). Neuf études portant sur 5205 patients avec un suivi médian de 18 à 81 mois ont été incluses. Il existait une association globale positive, mais non significative, entre la mort liée à la maladie et le diamètre de la tumeur, l’épaisseur de la tumeur, la présence d’une invasion périneurale, la profondeur de l’invasion dans le tissu adipeux et la localisation. Un risque 4 fois plus élevé a été constaté pour un diamètre de la tumeur ≥20 mm et un risque plus de 2 fois plus élevé pour une épaisseur de la tumeur ≥6 mm par rapport aux cSCC sans ces caractéristiques. Les patients immunodéprimés étaient presque deux fois plus susceptibles de mourir de CCSP que les patients immunocompétents (Risk Ratio 1,85 ; IC 95% : 1,32-2,61). Les auteurs de la méta-analyse indiquent que ces résultats doivent être considérés à la lumière de certaines limites méthodologiques (par exemple, l’hétérogénéité des études).
Radiothérapie : indications recommandées
Le professeur Stratigos a résumé les indications générales de la radiothérapie comme suit [1] : D’une part, comme alternative à l’exérèse chirurgicale pour les tumeurs localement non résécables, les patients inopérables ou les tumeurs difficiles à opérer, ou lorsque la résection n’est pas souhaitée. Et d’autre part, après l’excision, si les marges de coupe sont positives et si une ré-excision n’est pas possible. Ainsi qu’en situation adjuvante après une lymphadénectomie thérapeutique, lorsque le CCSP se trouvait dans la région de la tête et du cou avec des métastases nodales régionales et une extension extracapsulaire. Une question controversée est de savoir si une radiothérapie adjuvante doit être effectuée après une exérèse complète avec des marges de résection sans tumeur. Jusqu’à présent, aucun bénéfice clair n’a pu être démontré. L’orateur recommande d’évaluer cela au cas par cas. Une radiothérapie adjuvante peut éventuellement s’avérer utile en présence de plusieurs facteurs de risque.
Traitement systémique avec anti-PD-1-Ak ou avec chimiothérapie ou EGFR-i
Une récidive locorégionale doit être enlevée chirurgicalement si cela est cliniquement possible localement [7]. Pour le traitement d’une récidive locale ou locorégionale, il convient d’évaluer l’indication d’une thérapie systémique (tableau 2) si aucune option chirurgicale ou radiothérapeutique n’est disponible. L’indication et la détermination du traitement systémique devraient être posées dans le cadre d’un tumorboard multidisciplinaire, a souligné le professeur Stratigos.
Dans les cSCC avancés ou lorsque l’excision chirurgicale et la radiothérapie ne sont pas possibles, les guidelines européennes et américaines proposent une immunothérapie par anti-PD-1-Ak (cemiplimab, pembrolizumab) en première ligne [1–4]. Pour les patients chez qui les inhibiteurs de points de contrôle sont contre-indiqués, il existe des agents qui bloquent le récepteur du facteur de croissance épidermique (“epidermal growth factor receptor”, EGFR) ou différents régimes de chimiothérapie [1–4].
Intervalles de suivi adaptés au risque
Pour le suivi des patients atteints de CCSP, des intervalles de 6 à 12 mois sont recommandés sur une période de 2 à 5 ans pour les patients à faible risque [1]. Chez les patients présentant un risque accru de métastases ou dont la palpation n’est pas claire, les intervalles doivent être plus courts au cours des deux premières années et une échographie des ganglions lymphatiques doit être réalisée à chaque fois. Dans les cas localement avancés ou métastatiques, un schéma de suivi individualisé est utile. Outre la protection solaire comme mesure prophylactique générale, la nicotinamide est préconisée comme intervention chimiopréventive. La nicotinamide (vitamine B3) améliore notamment la réparation des dommages causés à l’ADN par les rayons ultraviolets (UV) [1]. Dans une étude de phase III randomisée et contrôlée en double aveugle, le nicotinamide (500 mg/2×/jour) a permis de réduire de 30 % le nombre de cSCC après 12 mois chez les patients étudiés (n=386) [8].
Congrès : Réunion annuelle de l’EADO
Littérature :
- «Cutaneous squamous cell carcinoma guidelines», Prof. Alexander J. Stratigos, MD, EADO Annual Meeting 20–22 April 2023.
- Stratigos AJ, et al.: European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO) and the European Organization for Research and Treatment of Cancer (EORTC). European interdisciplinary guideline on invasive squamous cell carcinoma of the skin: Part 1. epidemiology, diagnostics and prevention. Eur J Cancer 2020; 128: 60–82.
- Stratigos AJ et al.: European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO) and the European Organization for Research and Treatment of Cancer (EORTC). European interdisciplinary guideline on invasive squamous cell carcinoma of the skin: Part 2. Treatment. Eur J Cancer 2020; 128: 83–102.
- Schmults C, et al.: National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology. Squamous Cell Skin Cancer 2022; Version 2.2022. www.nccn.org, (letzter Abruf 14.07.2023)
- Dessinioti C, Stratigos AJ: Recent Advances in the Diagnosis and Management of High-Risk Cutaneous Squamous Cell Carcinoma. Cancers 2022; 14(14): 3556.
- Dessinioti C, Platsidaki E, Stratigos AJ: A Sensitivity Meta-Analysis of Disease-Specific Death in Localized Cutaneous Squamous Cell Carcinoma. Dermatology 2022; 238(6): 1026–1035.
- AWMF: Aktinische Keratose und Plattenepithelkarzinom der Haut, S3-Leitlinie 032-022OL, Registernummer 032–022OL.
- Chen AC, et al.: A Phase 3 Randomized Trial of Nicotinamide for Skin-Cancer Chemoprevention. N Engl J Med 2015; 373: 1618–1626.
- Karia PS, et al.: Evaluation of American Joint Committee on Cancer, International Union Against Cancer, and Brigham and Women’s Hospital tumor staging for cutaneous squamous cell carcinoma. J Clin Oncol 2014; 32: 327–334.
- Ruiz ES, et al.: Surgery and Salvage Limited-Field Irradiation for Control of Cutaneous Squamous Cell Carcinoma with Microscopic Residual Disease. JAMA Dermatol 2019; 155: 1193–1195.
- Brinkman JN, et al.: The Effect of Differentiation Grade of Cutaneous Squamous Cell Carcinoma on Excision Margins, Local Recurrence, Metastasis, and Patient Survival. Ann Plast Surg 2015; 75: 323–326.
- Eigentler TK, et al.: Survival of Patients with Cutaneous Squamous Cell Carcinoma: Results of a Prospective Cohort Study. J Investig Dermatol 2017; 137: 2309–2315.
- Conde-Ferreirós A, et al.: Patterns of incidental perineural invasion and prognosis in cutaneous squamous cell carcinoma: A multicenter, retrospective cohort study. J Am Acad Dermatol 2020; 84: 1708–1712.
- Schmults CD, et al.: Factors predictive of recurrence and death from cutaneous squamous cell carcinoma: A 10-year, single-institution cohort study. JAMA Dermatol 2013; 149: 541–547.
- Griffiths RW, Feeley K, Suvarna SK: Audit of clinical and histological prognostic factors in primary invasive squamous cell carcinoma of the skin: Assessment in a minimum 5 year follow-up study after conventional excisional surgery. Br J Plast Surg 2002; 55: 287–292.
- Yanofsky VR, Mercer SE, Phelps RG: Histopathological Variants of Cutaneous Squamous Cell Carcinoma: A Review. Journal of Skin Cancer 2011: 1–13.
DERMATOLOGIE PRAXIS 2023; 33(4): 32–33