En el congreso de este año de la Asociación Europea de Dermato-Oncología (EADO), se explicaron las recomendaciones actuales para el tratamiento del carcinoma cutáneo de células escamosas (cSCC). El tratamiento de primera elección sigue siendo la escisión completa con control histológico del margen de incisión. Puede considerarse la radioterapia adyuvante en función del riesgo de recidiva. En el CEC no resecable avanzado, la inhibición de los puntos de control inmunitarios se considera la terapia de primera línea. En caso de contraindicaciones, pueden utilizarse agentes quimioterapéuticos o inhibidores del EGFR. El seguimiento debe adaptarse al riesgo e incluir una ecografía de los ganglios linfáticos en los pacientes de alto riesgo.
El carcinoma de células escamosas de la piel -una neoplasia maligna de los queratinocitos epidérmicos- es el tumor cutáneo maligno más frecuente en humanos después del carcinoma basocelular. El Dr. Alexander J. Stratigos, del Departamento de Dermatología-Venereología del Hospital Andreas Sygros de la Universidad Nacional y Kapodistríaca de Atenas (Grecia) resumió el estado actual de los conocimientos sobre el diagnóstico y la terapia delcarcinoma escamoso cutáneo (CEC) con referencia a diversas directrices internacionales [1]. La directriz europea (EDF/EADO/EORTC) publicada en 2020 se encuentra actualmente en fase de revisión -se espera que la nueva versión se publique en breve- y las directrices estadounidenses (NCCN) se publican anualmente [1–4].
El CCSC se da con más frecuencia en hombres y el 80% de las veces en la zona de la cabeza y la cara o en zonas con exposición crónica a la luz ultravioleta. El riesgo de contraer la enfermedad aumenta significativamente con la edad. Si se sospecha la presencia de un cSCC, se recomienda la inspección de todo el tegumento. “Debemos describir bien las lesiones, documentar los síntomas y medir también el tamaño de las lesiones”, subrayó el Prof. Stratigos [1]. Además de la dermatoscopia, el uso de otros métodos de diagnóstico no invasivos, como la microscopia láser confocal y la tomografía de coherencia óptica, resulta especialmente útil para el diagnóstico diferencial.
El cSCC puede metastatizar principalmente en los ganglios linfáticos regionales y formar metástasis a distancia. Por lo tanto, el diagnóstico precoz y la terapia adaptada al riesgo son cruciales. Si existe una sospecha clínica de cSCC, también debe obtenerse histología para diferenciar entre otras neoplasias benignas o malignas. Si el cuadro clínico es claro para el cSCC, se recomienda la resección completa.
La escisión con aclaración histológica sigue considerándose la terapia estándar
El objetivo de la escisión quirúrgica es la resección completa, incluido el reprocesamiento de los márgenes periféricos y profundos de la incisión [1]. La terapia quirúrgica local está muy influida por la precisión del control histológico de los márgenes de incisión, explicó el Prof. Stratigos. Para la notificación histológica del cSCC debe utilizarse, si es posible, un sistema de notificación normalizado con información sobre los siguientes criterios: Subtipo histológico (desmoplásico, acantolítico, etc.), grado histológico de diferenciación, grosor máximo del tumor, profundidad de la invasión tumoral (por encima frente a más allá de la grasa subcutánea), invasión perineural, invasión linfática/vascular, resección completa posible/no posible, márgenes de incisión mínimos y máximos [1].
Biopsia del ganglio linfático centinela: ¿útil?
La indicación de realizar una biopsia del ganglio linfático centinela (BGC) en pacientes con CEC es objeto de controversia, según informó el Prof. Stratigos [1]. Debido a la falta de datos válidos sobre el valor pronóstico y terapéutico, la BSGC no se recomienda como estándar en la directriz europea. No existen pruebas de que las pacientes con ganglios linfáticos centinela positivos tengan peores resultados que aquellas con hallazgos negativos, explicó el ponente.
¿Cuáles son los factores pronósticos más importantes?
Entre la directriz europea publicada en 2020 y la estadounidense publicada en 2022, existe consenso en que, además de la inmunosupresión, los siguientes factores específicos del tumor aumentan significativamente el riesgo de metástasis y la mortalidad específica de la enfermedad en pacientes con cSCC [1–4]:
- Grosor vertical del tumor (>6 mm)
- Diámetro horizontal del tumor (>2 cm o >4 cm)
- diferenciación histológica
- Desmoplasia
- crecimiento perineural
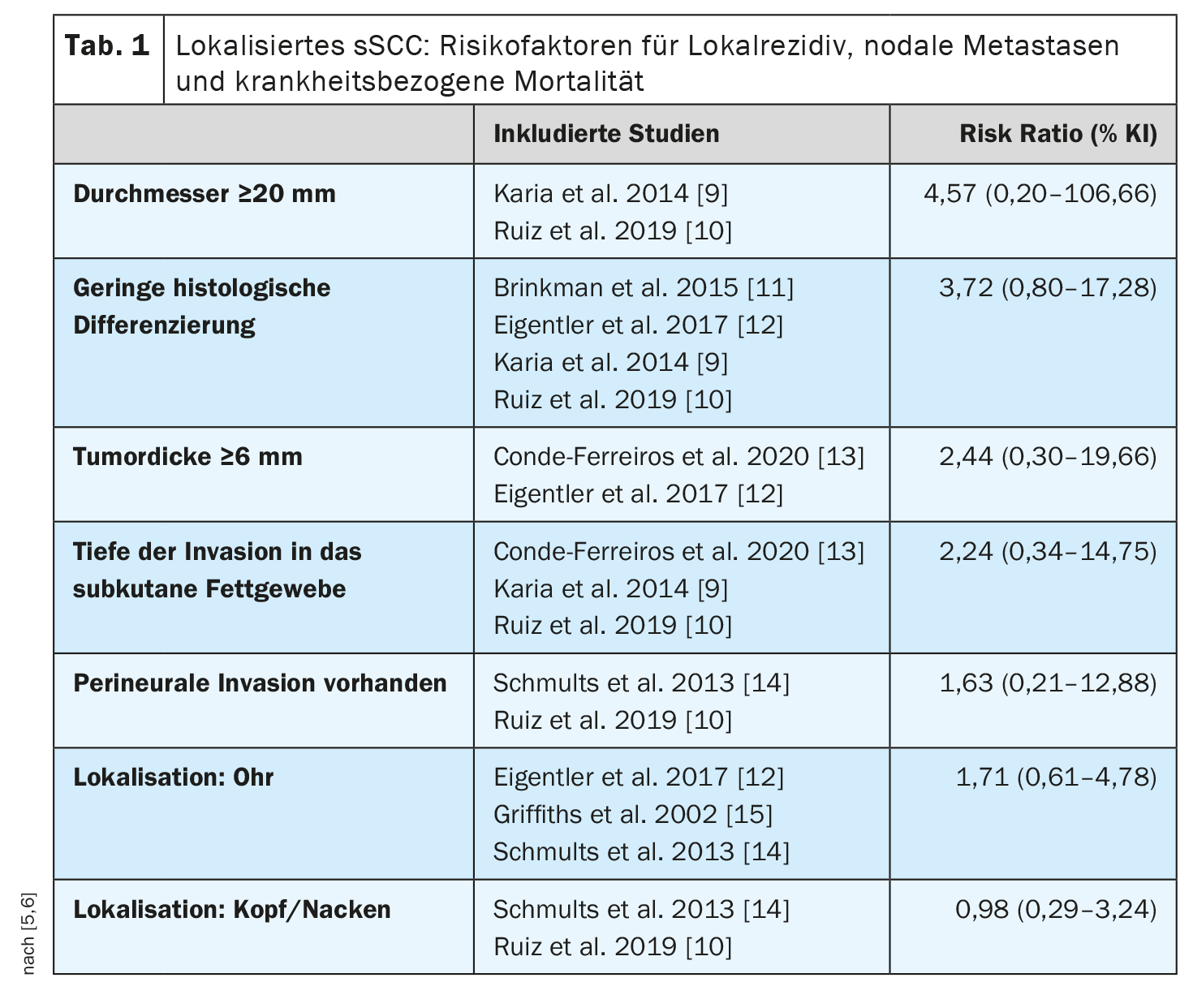
Esto concuerda con un metaanálisis publicado en 2022 que identificó los factores de riesgo asociados a la muerte relacionada con la enfermedad en pacientes con CEC localizado (sin metástasis locorregionales ni a distancia) [5,6] (Tabla 1). Se incluyeron nueve estudios con 5205 pacientes y una mediana de seguimiento de 18-81 meses. Hubo una asociación global positiva pero no significativa entre la muerte relacionada con la enfermedad y el diámetro del tumor, el grosor del tumor, la presencia de invasión perineural, la profundidad de la invasión en el tejido adiposo y la localización. Se encontró un riesgo 4 veces mayor para un diámetro tumoral ≥20 mm y más del doble para un grosor tumoral ≥6 mm en comparación con el CEC sin estas características. Los pacientes con inmunosupresión tenían casi el doble de probabilidades de morir de CCSc que los pacientes inmunocompetentes (cociente de riesgos 1,85; IC 95%: 1,32-2,61). Los autores del metaanálisis señalan que estos resultados deben considerarse en el contexto de ciertas limitaciones metodológicas (por ejemplo, la heterogeneidad de los estudios).
Radioterapia: recomendación de indicación
El Prof. Stratigos resumió las indicaciones generales de la radioterapia del siguiente modo [1] En primer lugar, como alternativa a la escisión quirúrgica para tumores localmente no resecables, pacientes inoperables o tumores difíciles de operar, o cuando no se desea la resección. Y en segundo lugar, después de haber realizado la escisión en caso de márgenes de incisión positivos y si no es posible realizar una nueva escisión. Así como en el contexto adyuvante tras una linfadenectomía terapéutica cuando el cSCC se encontraba en la cabeza y el cuello con metástasis ganglionares regionales y extensión extracapsular. Una cuestión controvertida es si la radioterapia adyuvante debe realizarse tras una escisión completa con márgenes de resección libres de tumor. Hasta ahora, no se ha podido demostrar ningún beneficio claro. El ponente recomienda sopesarlo caso por caso. La radioterapia adyuvante puede ser aconsejable si se dan varios factores de riesgo.
Terapia sistémica con anti-PD-1-Ak o con quimioterapia o EGFR-i
La recidiva locorregional debe extirparse quirúrgicamente si es clínicamente posible a nivel local [7]. Para el tratamiento de una recidiva local o locorregional, debe examinarse la indicación de una terapia sistémica (Tab. 2 ) si no se dispone de opciones quirúrgicas o radioterapéuticas. La indicación y la determinación de la terapia del sistema deben realizarse en una junta tumoral multidisciplinar, subrayó el Prof. Stratigos.
En el CEC avanzado o cuando la escisión quirúrgica y la radioterapia no son posibles, tanto las directrices europeas como las estadounidenses sugieren inmunoterapia de primera línea con anti-PD-1-Ak (cemiplimab, pembrolizumab) [1–4]. Para los pacientes en los que los inhibidores de los puntos de control están contraindicados, existen agentes que bloquean el receptor del factor de crecimiento epidérmico (EGFR) o diversos regímenes de quimioterapia [1–4].
Intervalos de seguimiento adaptados al riesgo
Para el seguimiento de los pacientes con CEC, se recomiendan intervalos de 6-12 meses durante un periodo de 2-5 años para los pacientes de bajo riesgo [1]. En los pacientes con un mayor riesgo de metástasis o con hallazgos de palpación poco claros, deben seleccionarse intervalos menores en los dos primeros años y debe realizarse una ecografía de los ganglios linfáticos en cada caso. En los casos localmente avanzados o con metástasis, resulta útil un régimen de seguimiento individualizado. Además de la protección solar como medida profiláctica general, la nicotinamida se preconiza como intervención quimiopreventiva. La nicotinamida (vitamina B3) mejora, entre otras cosas, la reparación de los daños en el ADN causados por la radiación ultravioleta (UV) [1]. En un estudio de fase III doble ciego controlado y aleatorizado, la nicotinamida (500 mg/2× diarios) produjo una reducción del 30% en la recurrencia del cSCC en la población de pacientes estudiada (n=386) al cabo de 12 meses [8].
Congreso: Reunión anual de la EADO
Literatura:
- «Cutaneous squamous cell carcinoma guidelines», Prof. Alexander J. Stratigos, MD, EADO Annual Meeting 20–22 April 2023.
- Stratigos AJ, et al.: European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO) and the European Organization for Research and Treatment of Cancer (EORTC). European interdisciplinary guideline on invasive squamous cell carcinoma of the skin: Part 1. epidemiology, diagnostics and prevention. Eur J Cancer 2020; 128: 60–82.
- Stratigos AJ et al.: European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO) and the European Organization for Research and Treatment of Cancer (EORTC). European interdisciplinary guideline on invasive squamous cell carcinoma of the skin: Part 2. Treatment. Eur J Cancer 2020; 128: 83–102.
- Schmults C, et al.: National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology. Squamous Cell Skin Cancer 2022; Version 2.2022. www.nccn.org, (letzter Abruf 14.07.2023)
- Dessinioti C, Stratigos AJ: Recent Advances in the Diagnosis and Management of High-Risk Cutaneous Squamous Cell Carcinoma. Cancers 2022; 14(14): 3556.
- Dessinioti C, Platsidaki E, Stratigos AJ: A Sensitivity Meta-Analysis of Disease-Specific Death in Localized Cutaneous Squamous Cell Carcinoma. Dermatology 2022; 238(6): 1026–1035.
- AWMF: Aktinische Keratose und Plattenepithelkarzinom der Haut, S3-Leitlinie 032-022OL, Registernummer 032–022OL.
- Chen AC, et al.: A Phase 3 Randomized Trial of Nicotinamide for Skin-Cancer Chemoprevention. N Engl J Med 2015; 373: 1618–1626.
- Karia PS, et al.: Evaluation of American Joint Committee on Cancer, International Union Against Cancer, and Brigham and Women’s Hospital tumor staging for cutaneous squamous cell carcinoma. J Clin Oncol 2014; 32: 327–334.
- Ruiz ES, et al.: Surgery and Salvage Limited-Field Irradiation for Control of Cutaneous Squamous Cell Carcinoma with Microscopic Residual Disease. JAMA Dermatol 2019; 155: 1193–1195.
- Brinkman JN, et al.: The Effect of Differentiation Grade of Cutaneous Squamous Cell Carcinoma on Excision Margins, Local Recurrence, Metastasis, and Patient Survival. Ann Plast Surg 2015; 75: 323–326.
- Eigentler TK, et al.: Survival of Patients with Cutaneous Squamous Cell Carcinoma: Results of a Prospective Cohort Study. J Investig Dermatol 2017; 137: 2309–2315.
- Conde-Ferreirós A, et al.: Patterns of incidental perineural invasion and prognosis in cutaneous squamous cell carcinoma: A multicenter, retrospective cohort study. J Am Acad Dermatol 2020; 84: 1708–1712.
- Schmults CD, et al.: Factors predictive of recurrence and death from cutaneous squamous cell carcinoma: A 10-year, single-institution cohort study. JAMA Dermatol 2013; 149: 541–547.
- Griffiths RW, Feeley K, Suvarna SK: Audit of clinical and histological prognostic factors in primary invasive squamous cell carcinoma of the skin: Assessment in a minimum 5 year follow-up study after conventional excisional surgery. Br J Plast Surg 2002; 55: 287–292.
- Yanofsky VR, Mercer SE, Phelps RG: Histopathological Variants of Cutaneous Squamous Cell Carcinoma: A Review. Journal of Skin Cancer 2011: 1–13.
DERMATOLOGIE PRAXIS 2023; 33(4): 32–33