Chez les patients dont l’asthme n’est pas suffisamment contrôlé sous traitement inhalé maximal, il convient de s’interroger de manière critique sur la réalité du diagnostic d’asthme et sur l’application adéquate de toutes les mesures thérapeutiques. Si tel est le cas, il convient de se concentrer sur les médicaments biologiques disponibles pour le traitement de l’asthme sévère. La détermination de biomarqueurs peut aider à choisir la classe de substances la plus appropriée.
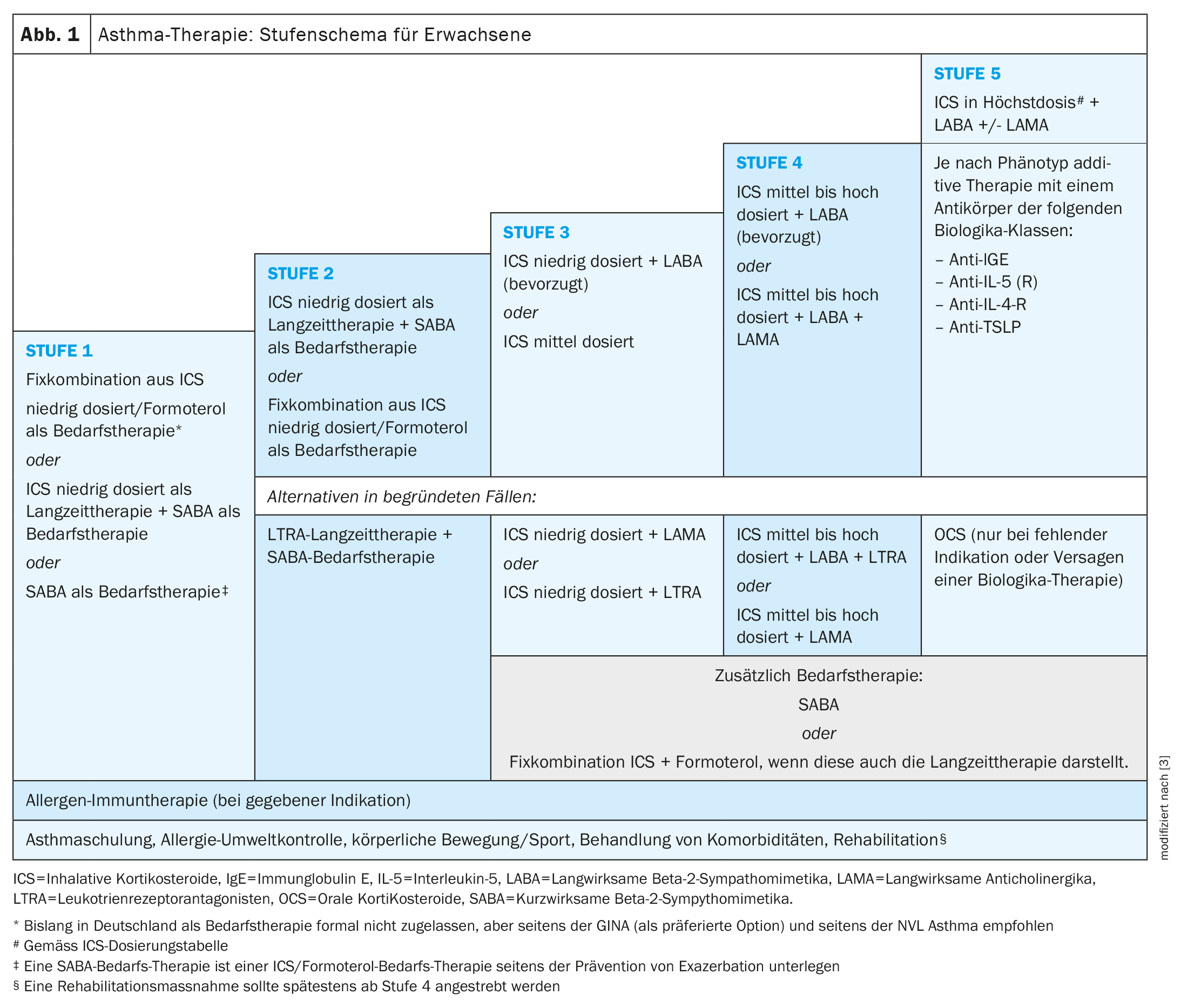
L’asthme apparaît souvent dès l’enfance et l’adolescence, mais peut aussi se manifester pour la première fois à l’âge adulte [1]. “Christophe von Garnier, médecin-chef du service de pneumologie du Centre hospitalier universitaire de Lausanne (CHUV) [2–4]. “L’asthme de l’adulte est moins souvent associé à des allergies, mais plus souvent à une rhinosinusite chronique avec polypes nasaux (CRSwNP) et à d’autres comorbidités. L’asthme “early-onset” correspond généralement à l’asthme allergique classique. Pour contrôler les symptômes de l’asthme, des médicaments à long terme et à la demande sont utilisés selon un schéma progressif (figure 1). Selon la nouvelle définition du GINA**, on parle d’asthme sévère lorsqu’il s’avère réfractaire à la trithérapie inhalée maximale (CSI à la dose maximale et LABA plus éventuellement LAMA) [5]. Si, par exemple, le traitement par inhalation maximale ne permet pas d’obtenir un contrôle suffisant de la maladie sur une période d’un mois, il convient d’abord de procéder à différentes évaluations :
- S’agit-il vraiment d’asthme ou de BPCO ?
- Le patient applique-t-il les mesures de traitement proposées ?
- La technique d’inhalation correcte est-elle utilisée ?
- Existe-t-il des déclencheurs d’asthme évitables (par ex. des allergènes) ?
- Existe-t-il des comorbidités non traitées ?
Si l’on conclut qu’il s’agit bien d’un asthme sévère, l’étape suivante consistera à évaluer le traitement par des agents biologiques spécifiques du phénotype comme option de traitement complémentaire [2,3]. L’objectif à long terme est d’atteindre et de maintenir une rémission de l’asthme, c’est-à-dire un asthme bien contrôlé sur le long terme.
** Lignes directrices de l’Initiative mondiale pour l’asthme (GINA) 2022
Éosinophiles sanguins et FeNO comme biomarqueurs
Les processus inflammatoires qui sous-tendent l’asthme sévère sont complexes, hétérogènes et dynamiques [6]. La diathèse atopique est le facteur prédisposant le plus puissant identifié à ce jour pour le développement de l’asthme. Mais chez 30 à 50 % des adultes asthmatiques, ni l’anamnèse, ni les tests cutanés, ni le dosage des IgE spécifiques dans le sérum ne révèlent d’allergies aux allergènes environnementaux, raison pour laquelle on appelle cette forme d’asthme non allergique ou intrinsèque [3]. L’asthme allergique et l’asthme non allergique sont regroupés dans la littérature sous le terme générique d’asthme de “type 2” ou “type-2-high” [7]. Cette approche repose sur la constatation que certaines cytokines peuvent être libérées non seulement par les cellules T auxiliaires spécifiques de l’allergène (cellules Th2) du système immunitaire adaptatif, mais également par les cellules ILC2 non spécifiques de l’allergène du système immunitaire inné, et entraîner des schémas inflammatoires similaires.
Les biomarqueurs de type 2 sont notamment les éosinophiles sanguins et le FeNO [3,8,9]. Afin de pouvoir délimiter le phénotype, les recommandations du GINA conseillent de mesurer ces deux biomarqueurs au moins trois fois, car ils sont soumis à de fortes variations individuelles. Par exemple, le nombre d’éosinophiles sanguins est influencé par le moment du dernier contact avec l’allergène et par la saison, et les niveaux de FeNO sont influencés par les infections ou l’exposition à des polluants [3,10]. De plus, ces deux biomarqueurs sont considérablement influencés par les traitements ICS et OCS [3,11,12].
Une éosinophilie élevée entraîne des lésions du tissu pulmonaire par l’activation des cellules éosinophiles, une hyperréactivité et des processus de remodelage des voies respiratoires (remodelling) [13]. Le diagnostic d’asthme grave à éosinophiles requiert au moins deux détections de plus de 300 éosinophiles/µl dans le sang en dehors des exacerbations et sans médication par corticostéroïdes systémiques.
Les produits biologiques comme traitement d’entretien complémentaire
Les substances actives ayant pour cible les interleukines (anti-IL-5-(R), anti-IL-4-R) ou les IgE ciblent la voie inflammatoire de type 2. Une éosinophilie sanguine (≥300 cellules/μl) est considérée comme un facteur prédictif de la réponse aux anticorps monoclonaux anti-IL-5 (mépolizumab, reslizumab) ou anti-IL-5-R (benralizumab) [20]. Une éosinophilie sanguine (≥300 cellules/μl) ou une concentration de FeNO >25 ppb sont en outre des facteurs prédictifs de réponse à un traitement par dupilumab, un anticorps anti-IL4R. En revanche, les patients souffrant d’asthme allergique sévère et présentant des taux élevés d’IgE sont les plus susceptibles de répondre à l’omalizumab. Lorsque le taux de base d’IgE est inférieur à 76 UI/ml, le bénéfice clinique de l’anticorps anti-IgE est moins probable [19]. L’anticorps monoclonal tezepelumab, autorisé en Suisse en 2022, a une approche différente de celle des substances mentionnées. La cible de ce produit biologique est la TSLP (thymic stromal lymphopoietin). En se liant à la TSLP, le tézépelumab empêche son interaction avec le récepteur hétérodimère de la TSLP. La TSLP est une cytokine de la famille des alarmines, principalement libérée par les cellules épithéliales en réponse à divers stimuli (virus, allergènes et polluants, par exemple). Elle est impliquée dans la cascade inflammatoire de l’asthme et joue un rôle dans le déclenchement et la persistance de l’inflammation asthmatique des voies respiratoires [15]. Dans le cas de l’asthme, les déclencheurs allergiques et non allergiques induisent la production de TSLP. Le blocage de TSLP par le tézépelumab affecte un large éventail de biomarqueurs et de cytokines associés à l’inflammation (par exemple, éosinophiles sanguins, IgE, FeNO, IL-5 et IL-13) [15–17]. En conséquence, la TSLP joue un rôle pathogène important dans différents sous-types d’asthme [16,17]. Dans un article de synthèse publié en 2022, il a été démontré que le tezepelumab est une option thérapeutique adéquate dans l’asthme sévère non contrôlé et <1500 éosinophiles/μl, indépendamment du FeNO et du statut allergique [18]. De plus, le tezepelumab a montré qu’il réduisait le taux d’exacerbation chez les patients souffrant d’asthme sévère non contrôlé, indépendamment du nombre d’éosinophiles à la ligne de base.
Congrès : Allergy & Immunology Update
Littérature :
- Akar-Ghibril N, et al : Endotypes allergiques et phénotypes de l’asthme. J Allergy Clin Immunol Pract 2020 ; 8(2) : 429-440.
- “Comment reconnaître et traiter l’asthme sévère (Th2)”, Prof. Christophe von Garnier, Allergy & Immunology Update, Grindelwald, 27.01.2024.
- Lommatzsch M, et al. : S2k-Leitlinie zur fachärztlichen Diagnostik und Therapie von Asthma 2023, Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin e.V. (éd.), https://register.awmf.org,(dernière consultation 07.03.2024)
- Baan EJ, et al : Caractérisation de l’asthme par âge de début : une étude de cohorte multi-bases de données. J Allergy Clin Immunol Pract 2022 ; 10 : 1825-1834.e1828.
- Initiative mondiale pour l’asthme (GINA), 2022, www.ginasthma.com,(dernière consultation 07.03.2024)
- Busse WW : Traitements biologiques de l’asthme sévère : une avancée majeure dans les soins de l’asthme. Allergol Int 2019 ; 68(2) : 158-166.
- Hinks TSC, Levine SJ, Brusselle GG : Treatment options in type-2 low asthma. Eur Respir J 2021 ; 57(1).
- Hammad H, Lambrecht BN : The basic immunology of asthma. Cell 2021 ; 184 : 1469-1485.
- Lommatzsch M : Immune Modulation in Asthma : Current Concepts and Future Strategies. Respiration 2020 ; 99 : 566-576.
- Chipps BE, et al : A Comprehensive Analysis of the Stability of Blood Eosinophil Levels. Ann Am Thorac Soc 2021 ; 18 : 1978-1987.
- Lommatzsch M, et al. : Impact d’une augmentation de la dose de corticostéroïdes inhalés sur les éosinophiles sanguins dans l’asthme. Thorax 2019 ; 74 : 417-418.
- Jackson DJ, et al. : Caractérisation des patients souffrant d’asthme sévère dans le registre britannique de l’asthme sévère à l’ère biologique. Thorax 2021 ; 76 : 220-227.
- Patterson MF, Borish L, Kennedy JL : The past, present, and future of monoclonal antibodies to IL-5 and eosinophilic asthma : a review. J Asthma Allergy 2015 ; 8 : 125-134.
- Berry M, et al : Caractéristiques pathologiques et réponse aux corticostéroïdes inhalés de l’asthme éosinophilique et non-éosinophilique. Thorax 2007 ; 62 : 1043-1049.
- Compendium suisse des médicaments,
https://compendium.ch,(dernier appel 07.03.2024) - Menzies-Gow A, Wechsler ME, Brightling CE : Unmet need in severe, uncontrolled asthma : can anti-TSLP therapy with tezepelumab provide a valuable new treatment option ? Respiratory research 2020 ; 21(1) : 268.
- Gauvreau GM, et al : Thymic stromal lymphopoietin : its role and potential as a therapeutic target in asthma. Avis d’expert sur les cibles thérapeutiques 2020 ; 24(8) : 777-792.
- Brusselle GG, Koppelman GH : Thérapies biologiques pour l’asthme sévère. The New England journal of medicine 2022 ; 386(2) : 157-171.
- Omalizumab, https://ec.europa.eu/health/documents/community-register/2022/20221014157073/anx_157073_de.pdf,(dernière consultation 07.03.2024)
- Mepolizumab, Reslizumab et Benralizumab, www.leitlinien.de/themen/asthma/4-auflage/kapitel-4,(dernière consultation 07.03.2024).
HAUSARZT PRAXIS 2024 ; 19(3) : 26-28 (publié le 20.3.24, ahead of print)