Nei pazienti con asma non adeguatamente controllata sotto terapia inalatoria massima, occorre chiedersi criticamente se la diagnosi di asma sia davvero presente e se tutte le misure terapeutiche siano state adeguatamente implementate. In tal caso, è importante concentrarsi sui biologici disponibili per il trattamento dell’asma grave. La determinazione dei biomarcatori può aiutare a selezionare la classe di sostanze più adatta in ogni caso.
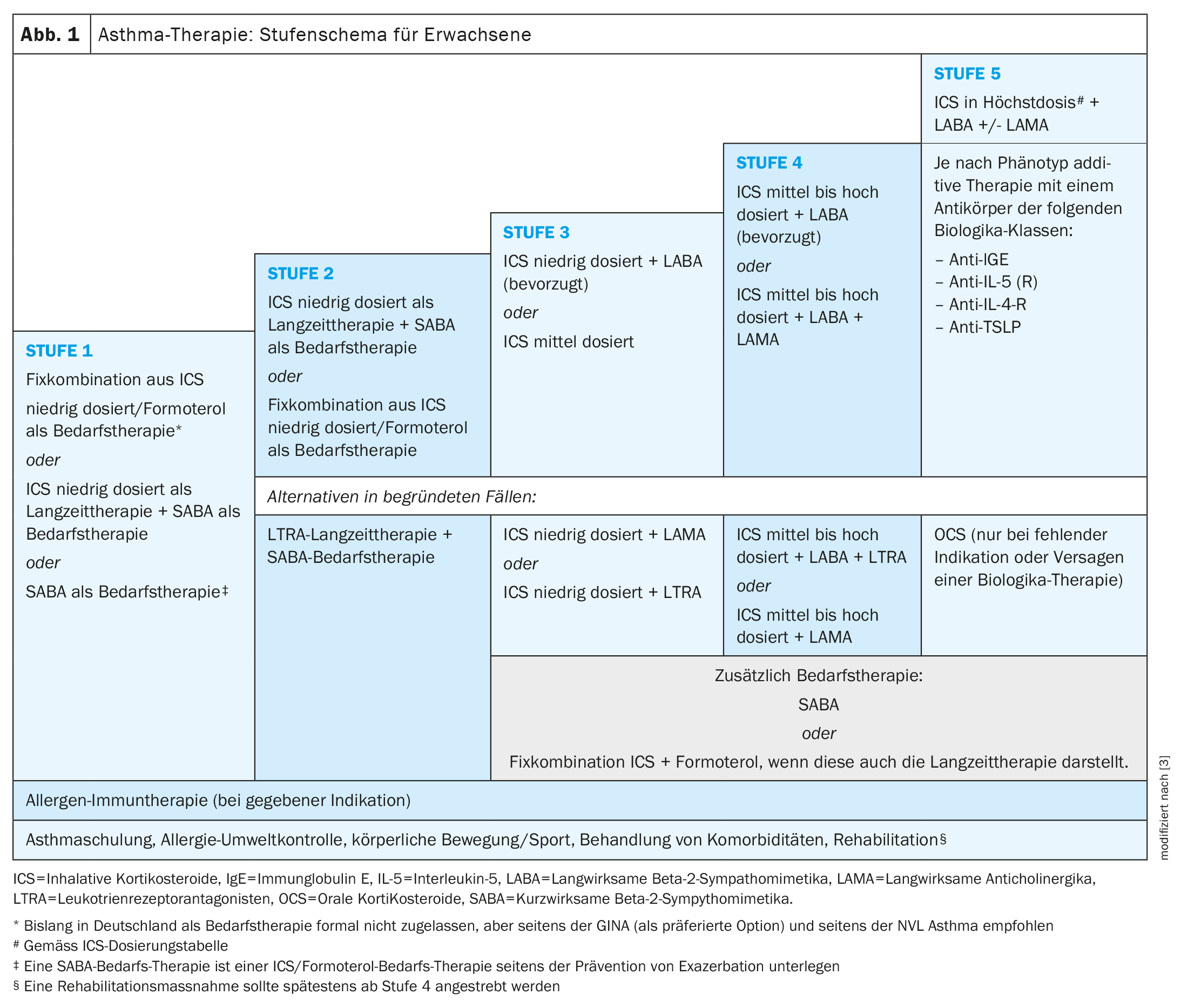
L’asma si manifesta spesso nell’infanzia e nell’adolescenza, ma può anche manifestarsi per la prima volta in età adulta [1]. L’asma “da adulti” tende ad essere più grave e ad avere tassi di esacerbazione più elevati, ha riferito il Prof. Christophe von Garnier, MD, Medico Capo del Dipartimento di Pneumologia dell’Ospedale Universitario di Losanna (CHUV) [2–4]. “L’asma in età adulta è meno frequentemente associata alle allergie, ma più frequentemente alla rinosinusite cronica con polipi nasali (CRSwNP) e ad altre comorbidità. “L’asma precoce di solito corrisponde all’asma allergica classica. I farmaci a lungo termine e su richiesta vengono utilizzati per controllare i sintomi dell’asma secondo lo schema a tappe (Fig. 1). Secondo la nuova definizione GINA**, l’asma è considerata grave se si dimostra refrattaria alla triplice terapia inalatoria massima (ICS in dose massima e LABA più eventualmente LAMA) [5]. Se, ad esempio, non si ottiene un controllo sufficiente della malattia entro un mese con la terapia inalatoria massima, è necessario effettuare prima diverse indagini:
- Si tratta davvero di asma o invece di BPCO, per esempio?
- Il paziente attua le misure terapeutiche proposte?
- Viene utilizzata la tecnica di inalazione corretta?
- Ci sono fattori scatenanti dell’asma evitabili (ad esempio, gli allergeni)?
- Ci sono comorbilità non trattate?
Se si conclude che l’asma è davvero grave, il passo successivo sarà quello di testare il trattamento con biologici specifici per il fenotipo come opzione terapeutica aggiuntiva [2,3]. L’obiettivo a lungo termine è raggiungere e mantenere la remissione dell’asma, cioè un’asma a lungo termine e ben controllata.
** Linee guida dell’Iniziativa Globale per l’Asma (GINA) 2022
Eosinofili nel sangue e FeNO come biomarcatori
I processi infiammatori alla base dell’asma grave sono complessi, eterogenei e dinamici [6]. La diatesi atopica è il più forte fattore predisponente allo sviluppo dell’asma identificato finora. Tuttavia, nel 30-50% degli adulti con asma, le allergie agli allergeni ambientali non sono rilevabili né dall’anamnesi né dai test cutanei o dalla determinazione delle IgE specifiche nel siero, motivo per cui questa forma viene definita anche asma non allergica o intrinseca [3]. L’asma allergica e non allergica sono riassunte in letteratura con il termine generico di asma di “tipo 2” o “tipo 2-alto” [7]. Ciò si basa sulla consapevolezza che alcune citochine possono essere rilasciate non solo dalle cellule T helper specifiche per l’allergene (cellule Th2) del sistema immunitario adattativo, ma anche dalle cellule ILC2 non specifiche per l’allergene del sistema immunitario innato, e portare a modelli infiammatori simili.
I biomarcatori di tipo 2 includono gli eosinofili nel sangue e il FeNO [3,8,9]. Per poter restringere il fenotipo, le raccomandazioni GINA raccomandano di misurare questi due biomarcatori almeno tre volte, poiché sono soggetti a forti fluttuazioni individuali. Per esempio, il numero di eosinofili nel sangue è influenzato dal momento dell’ultimo contatto con l’allergene e dal periodo dell’anno, e i livelli di FeNO sono influenzati dalle infezioni o dall’esposizione agli agenti inquinanti [3,10]. Inoltre, entrambi i biomarcatori sono significativamente influenzati dalle terapie ICS e OCS [3,11,12].
Un’elevata eosinofilia porta a danni al tessuto polmonare, all’iperreattività e al rimodellamento delle vie aeree a causa dell’attivazione delle cellule eosinofile [13]. La diagnosi di asma eosinofila grave richiede almeno due rilevamenti di oltre 300 eosinofili/µl nel sangue al di fuori delle esacerbazioni e senza trattamento con corticosteroidi sistemici.
I biologici come terapia di mantenimento aggiuntiva
I principi attivi che hanno come bersaglio le interleuchine (anti-IL-5-(R), anti-IL-4-R) o le IgE sono rivolti alla via infiammatoria di tipo 2. L’eosinofilia nel sangue (≥300 cellule/μl) è considerata un predittore di risposta agli anticorpi monoclonali contro l’IL-5 (mepolizumab, reslizumab) o contro l’IL-5-R (benralizumab) [20]. L’eosinofilia nel sangue (≥300 cellule/μl) o una concentrazione di FeNO >25 ppb sono anche predittori di una risposta al trattamento con l’anticorpo anti-IL4R dupilumab. I pazienti con asma allergico grave e livelli elevati di IgE, invece, hanno maggiori probabilità di rispondere a omalizumab. Se il valore basale delle IgE è inferiore a 76 U.I./ml, il beneficio clinico dell’anticorpo anti-IgE è meno probabile [19]. L’anticorpo monoclonale tezepelumab, che sarà autorizzato in Svizzera nel 2022, ha una modalità d’azione diversa dalle sostanze sopra menzionate. Il bersaglio di questo farmaco biologico è la TSLP (linfopoietina stromale timica). Legandosi a TSLP, tezepelumab impedisce la sua interazione con il recettore eterodimerico di TSLP. La TSLP è una citochina della famiglia delle allarmine che viene rilasciata principalmente dalle cellule epiteliali in risposta a vari stimoli (ad esempio virus, allergeni e agenti inquinanti), è coinvolta nella cascata infiammatoria nell’asma e svolge un ruolo nell’avvio e nella persistenza dell’infiammazione asmatica delle vie aeree [15]. Nell’asma, i fattori scatenanti sia allergici che non allergici inducono la produzione di TSLP. Il blocco di TSLP con tezepelumab influisce su un ampio spettro di biomarcatori e citochine associati all’infiammazione (ad esempio eosinofili nel sangue, IgE, FeNO, IL-5 e IL-13) [15–17]. Di conseguenza, TSLP svolge un ruolo patogenetico importante in vari sottotipi di asma [16,17]. Un articolo di revisione pubblicato nel 2022 ha dimostrato che il tezepelumab è un’opzione di trattamento adeguata per l’asma grave non controllata e <1500 eosinofili/μl, indipendentemente dal FeNO e dallo stato di allergia [18]. Inoltre, è stato dimostrato che tezepelumab riduce il tasso di esacerbazione nei pazienti con asma grave e non controllata, indipendentemente dalla conta degli eosinofili al basale.
Congresso: Aggiornamento su allergia e immunologia
Letteratura:
- Akar-Ghibril N, et al: Endotipi allergici e fenotipi dell’asma. J Allergy Clin Immunol Pract 2020; 8(2): 429-440.
- “Come riconoscere e trattare l’asma grave (Th2)”, Prof. Dr. Christophe von Garnier, Allergy & Immunology Update, Grindelwald, 27.01.2024.
- Lommatzsch M, et al: Linea guida S2k per la diagnosi e il trattamento specialistico dell’asma 2023, Società tedesca di pneumologia e medicina respiratoria e.V. (ed.), https://register.awmf.org,(ultimo accesso 07.03.2024)
- Baan EJ, et al: Caratterizzazione dell’asma in base all’età di insorgenza: uno studio di coorte multi-database. J Allergy Clin Immunol Pract 2022; 10: 1825-1834.e1828.
- Iniziativa Globale per l’Asma (GINA), 2022, www.ginasthma.com,(ultimo accesso 07/03/2024)
- Busse WW: Trattamenti biologici per l’asma grave: un importante progresso nella cura dell’asma. Allergol Int 2019; 68(2): 158-166.
- Hinks TSC, Levine SJ, Brusselle GG: Opzioni di trattamento nell’asma di tipo 2 basso. Eur Respir J 2021; 57(1).
- Hammad H, Lambrecht BN: L’immunologia di base dell’asma. Cellula 2021; 184: 1469-1485.
- Lommatzsch M: Modulazione immunitaria nell’asma: concetti attuali e strategie future. Respirazione 2020; 99: 566-576.
- Chipps BE, et al: Un’analisi completa della stabilità dei livelli di eosinofili nel sangue. Ann Am Thorac Soc 2021; 18: 1978-1987.
- Lommatzsch M, et al: Impatto di un aumento della dose di corticosteroidi per via inalatoria sugli eosinofili nel sangue nell’asma. Thorax 2019; 74: 417-418.
- Jackson DJ, et al: Caratterizzazione dei pazienti con asma grave nel Registro britannico dell’asma grave nell’era biologica. Thorax 2021; 76: 220-227.
- Patterson MF, Borish L, Kennedy JL: Il passato, il presente e il futuro degli anticorpi monoclonali contro l’IL-5 e l’asma eosinofila: una revisione. J Asthma Allergy 2015; 8: 125-134.
- Berry M, et al: Caratteristiche patologiche e risposta ai corticosteroidi inalatori dell’asma eosinofilo e non eosinofilo. Thorax 2007; 62: 1043-1049.
- Compendio svizzero dei farmaci,
https://compendium.ch,(ultimo accesso 07.03.2024) - Menzies-Gow A, Wechsler ME, Brightling CE: Esigenza insoddisfatta nell’asma grave e non controllata: la terapia anti-TSLP con tezepelumab può fornire una nuova e preziosa opzione di trattamento? Ricerca respiratoria 2020; 21(1): 268.
- Gauvreau GM, et al: Linfopoietina timica stromale: ruolo e potenziale come bersaglio terapeutico nell’asma. Opinione degli esperti sui bersagli terapeutici 2020; 24(8): 777-792.
- Brusselle GG, Koppelman GH: Terapie biologiche per l’asma grave. The New England journal of medicine 2022; 386(2): 157-171.
- Omalizumab, https://ec.europa.eu/health/documents/community-register/2022/20221014157073/anx_157073_de.pdf,(ultimo accesso 07/03/2024)
- Mepolizumab, reslizumab e benralizumab, www.leitlinien.de/themen/asthma/4-auflage/kapitel-4,(ultimo accesso 07/03/2024).
HAUSARZT PRAXIS 2024; 19(3): 26-28 (pubblicato il 20.3.24, prima della stampa)