- Il trattamento a lungo termine con UPA fino a 5,5 anni non mostra nuovi segnali di sicurezza (1).
- L’UPA ha un profilo di sicurezza coerente nel trattamento dell’artrite reumatoide (RA), dell’artrite psoriasica (PsA) e della spondiloartrite assiale (AS), anche se la frequenza degli effetti collaterali varia a causa delle differenze nella popolazione di pazienti e delle comorbidità correlate alla malattia (1).
- UPA ha un profilo di sicurezza paragonabile a quello di adalimumab nella RA* e nella PsA (1).
* Ad eccezione dei già noti eventi di herpes zoster e NMSC più elevati e dei livelli di CPK più alti.
UPA nelle malattie reumatiche
La RA, la PsA e la SA sono molto stressanti per le persone che ne sono affette: l’infiammazione di base può causare danni permanenti alle articolazioni e ridurre significativamente la qualità della vita delle persone colpite [2, 3]. Upadacitnib (UPA, RINVOQ®) è un inibitore orale e reversibile della Janus chinasi (JAK) che agisce specificamente su JAK1 e, in misura minore, anche su JAK2, JAK3 o TYK2. L’UPA è utilizzato al dosaggio di 15 mg una volta al giorno per RA, AS e PsA ed è anche approvato per il trattamento degli adulti con dermatite atopica (AD) da moderata a grave [4].
L’UPA ha dimostrato una forte efficacia in tutti i 9 studi condotti su RA, PsA, AS e AD. Tuttavia, l’uso sicuro è altrettanto fondamentale per il trattamento [4]. I dati dello studio di sorveglianza ORAL, che ha confrontato l’inibitore JAK tofacitinib con un inibitore del fattore di necrosi tumorale (TNF) in pazienti anziani con RA e fattori di rischio cardiovascolare, evidenziano la necessità di caratterizzare meglio il profilo di sicurezza degli inibitori JAK nella terapia della malattia reumatica, in particolare nel contesto dei comparatori attivi. Una nuova pubblicazione di Burmester et al. ora mostra il profilo di sicurezza a lungo termine di UPA in un periodo fino a 5,5 anni nelle malattie reumatiche, in cui non sono emersi nuovi segnali di sicurezza [1].
Trattamento a lungo termine con UPA
Complessivamente, la sicurezza dell’UPA è stata studiata in 6000 pazienti con RA, PsA, AS e AD nell’arco di 15.000 anni-paziente. In RA, AS e PsA, sono stati inclusi in totale 9 studi di fase IIb/III, cioè sono disponibili dati su 4298 pazienti trattati che hanno ricevuto almeno una dose di UPA (3209 pazienti con RA, 907 con PsA e 182 con AS). Ciò corrisponde a un totale di 11272 anni-paziente (9079,1 per la RA, 1872 per la PsA e 320 per la SA, rispettivamente) [1]. La durata massima del trattamento è stata di 5,5 anni per la RA, 3,9 anni per la PsA e 3,3 anni per la SA. Circa l’80% dei pazienti in tutti i gruppi presentava almeno un fattore di rischio per la malattia cardiovascolare al basale (Tabella 1). I pazienti anziani (> 65 anni) erano più frequentemente rappresentati nella popolazione RA (20%) che nella popolazione AS (6%) [1]. I pazienti che hanno ricevuto almeno una dose di ADA o MTX sono stati utilizzati per il confronto. La maggior parte dei pazienti con RA e PSA che assumono UPA ha ricevuto una terapia concomitante con csDMARD – nei pazienti con AS, la terapia aggiuntiva con csDMARD è stata rara [1].
Tabella 1: Dati demografici di base e caratteristiche della malattia di UPA, ADA e MTX nei pazienti RA e di UPA e ADA nei pazienti PsA e UPA nei pazienti AS, rispettivamente.

* L ‘attività della malattia è misurata come segue: RA, DAS (Disease Activity Score)-28 (CRP); PsA, DAPSA (Disease Activity Index for Psoriatic Arthritis); AS, ASDAS (Ankylosing Spondylitis Disease Activity Score).
I fattori di rischio deiCVincludono la storia di eventi cardiovascolari, l’ipertensione, il diabete mellito, l’uso di tabacco/nicotina, l’aumento dell’LDL-C e la diminuzione dell’HDL-C. Adattato da [1]
Nessun nuovo segnale di sicurezza sotto l’UPA
Il profilo di sicurezza complessivo dell’UPA è stato paragonabile in RA, PsA e AS. Nei pazienti con RA e PsA in trattamento con UPA sono state osservate infezioni gravi (Fig. 1), che raramente hanno portato all’interruzione del trattamento e con un’incidenza simile nei pazienti RA in terapia con UPA rispetto ai pazienti in terapia con ADA. Al contrario, non sono state segnalate infezioni gravi nei pazienti con AS in terapia con UPA. L’aumento dei tassi di infezioni gravi nei pazienti con PsA sottoposti a UPA sembra essere correlato a COVID-19 [1].
I tumori maligni (escluso il tumore cutaneo non melanoma, NMSC) sono stati segnalati in tutti gli stadi della malattia a un tasso fino a un massimo di un evento per 100 anni-paziente (≤1,0 E/100 PY) (Fig. 1), che era coerente tra tutte le malattie e anche tra UPA e i farmaci attivi di confronto. Non c’è stato alcun cambiamento significativo in questo tasso durante l’intera durata dell’assunzione di UPA. I tassi di NMSC con la terapia UPA (≤ 0,8 E/100 PY) sono stati generalmente gli stessi per tutte le malattie, ad eccezione dell’AS – non sono stati osservati tumori maligni in questa popolazione di pazienti [1].
Gli eventi cardiovascolari avversi gravi (MACE) sono stati riportati in tutti i gruppi di trattamento a tassi <0,5 per 100 anni-paziente (PY) (Fig. 1). Ad eccezione del trattamento con UPA dei pazienti con AS, dove non sono stati osservati eventi cardiovascolari. Nel complesso, il tasso di MACE è stato paragonabile nei pazienti con RA e PsA in terapia con UPA, ADA e MTX. Non c’era alcuna correlazione tra la durata dell’uso di UPA e il verificarsi di MACE. La maggior parte dei pazienti che hanno subito un MACE aveva almeno un fattore di rischio cardiovascolare [1].
Il tromboembolismo venoso (VTE) è stato osservato nei pazienti in terapia con UPA in tutti gli stadi della malattia, con tassi di <0,4 E/100 PY nella RA o 0,2 E/100 PY nella PsA e 0,3 E/100 PY nella AS. Il numero di eventi con UPA era paragonabile a quello con ADA (RA e PsA) e MTX (RA) (Fig. 1). Non è stata osservata alcuna correlazione tra la durata dell’esposizione all’UPA e l’insorgenza di TEV. La maggior parte dei pazienti che hanno avuto un TEV aveva almeno un fattore di rischio cardiovascolare e/o tromboembolico [1].
I pazienti che hanno ricevuto l’UPA hanno avuto anche segnalazioni di herpes zoster, come previsto. In genere è stato lieve o moderato. L’herpes zoster raramente ha portato all’interruzione della terapia e ha colpito solo un singolo dermatomo. Inoltre, non è stato possibile stabilire una correlazione tra la durata del trattamento e l’insorgenza dell’herpes zoster [1]. È disponibile la vaccinazione contro l’herpes zoster. Il vaccino deve essere somministrato 4 settimane prima del trattamento con un agente immunomodulatore attivo come l’UPA [4].
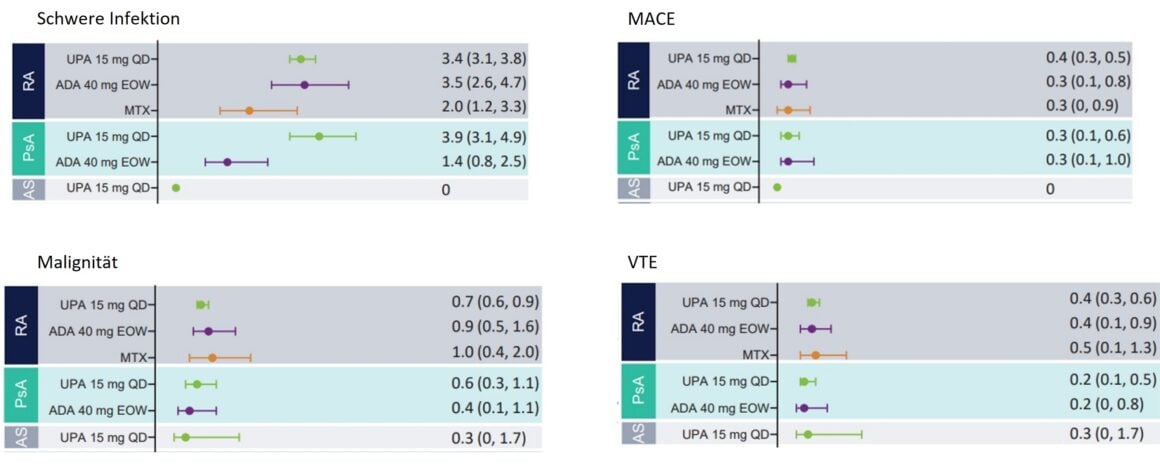
Figura 1: Tassi aggiustati per esposizione di eventi avversi al trattamento (TEAEs) di particolare interesse nei pazienti con RA, PsA e AS. MACE, Eventi Cardiovascolari Avversi Maggiori; VTE, Tromboembolia Venosa. Adattato da [1]
Ponderare il profilo rischio-beneficio
Il trattamento delle malattie reumatiche deve mirare a ottenere una remissione prolungata [5]. La remissione non solo migliora l’esito del trattamento, ma riduce anche il carico del paziente al di là dei sintomi della malattia. Quindi la remissione riduce il rischio di infezioni [6], il rischio di CV [7] e forse anche il rischio di linfoma [8]. Gli inibitori della JAK hanno dimostrato di essere un’alternativa efficace per i pazienti affetti da RA, AS e PsA con risposta inadeguata o intolleranza ai csDMARD o ai bDMARD [4]. L’inibitore della JAK UPA è stato e viene studiato in ampi programmi clinici di fase III [1]. Sono disponibili i primi dati a lungo termine di UPA, che studiano la sicurezza e l’efficacia nei pazienti con RA e risposta inadeguata al metotrexato. L’UPA in combinazione con MTX è superiore all’ADA con MTX in termini di risposta clinica. L’efficacia sui sintomi articolari è stata misurata in base ai criteri di risposta ACR, all’intensità del dolore e alla conservazione della funzione fisica. Inoltre, una percentuale significativamente più alta di pazienti sottoposti a UPA ha raggiunto la remissione o una bassa attività della malattia. I tassi di eventi avversi sono stati paragonabili a quelli dell’ADA, ad eccezione di herpes zoster, linfopenia, disfunzione epatica (soprattutto innalzamenti di ALT e ALS) ed elevazioni di CPK. Esaminando i benefici e i rischi dell’UPA rispetto all’ADA, l’UPA ha mostrato risultati clinici migliori con un profilo comparabile di eventi avversi (Fig. 2) [9].

Figura 2: compromesso beneficio-rischio tra UPA e ADA in un contesto clinico. Il numero incrementale di pazienti che soddisfano gli endpoint di efficacia e sicurezza è stato basato sulle stime del punto Number Needed to Treat (NNT) e Number Needed to Harm (NNH) per il trattamento con UPA invece che con ADA. a Differenza statisticamente significativa per UPA vs. ADA (95% Ki). Adattato secondo [9]
Conclusione
In sintesi, il profilo di sicurezza dell’UPA nell’AR, nella PsA e nell’AS è paragonabile e non sono stati osservati nuovi segnali di sicurezza anche con un trattamento a lungo termine con UPA fino a 5,5 anni (1). Inoltre, l’UPA mostra un profilo di sicurezza coerente nell’AR, nella PsA e nell’AS, sebbene la frequenza degli effetti collaterali vari a causa delle differenze nella popolazione di pazienti e delle comorbidità legate alla malattia. Nel complesso, il profilo di sicurezza dell’UPA nell’AR e nella PsA è paragonabile a quello di ADA e MTX (1).
La pubblicazione completa di Burmester et al. è disponibile qui.
ACR, American College of Rheumatology; ADA, adalimumab; ALT, alanina aminotransferasi; ALS, aspartato aminotransferasi; CV, cardio-vascolare, CDAI, Clinical Disease Activity Index; csDMARD, farmaci antireumatici sintetici convenzionali modificanti la malattia; DAS28, 28-joint Disease Activity Score; HZ, herpes zoster; IR, risposta inadeguata; KI, intervallo di confidenza; LDA, bassa attività di malattia; MACE, evento cardiovascolare avverso maggiore; MTX, metotrexato; NNT, numero necessario per il trattamento; NMSC, tumore cutaneo non melanoma; NNH, numero necessario per il danno; UPA, upadacitinib; VTE, tromboembolismo venoso.
Riferimenti:
1. Burmester, G.R., et al, Profilo di sicurezza di upadacitinib su 15.000 anni-paziente tra artrite reumatoide, artrite psoriasica, spondilite anchilosante e dermatite atopica. RMD Open, 2023. 9(1).
Gudu, T. e L. Gossec, Qualità di vita nell’artrite psoriasica. Expert Rev Clin Immunol, 2018. 14(5): p. 405-417.
Combe, B., et al, Aggiornamento 2016 delle raccomandazioni EULAR per la gestione dell’artrite precoce. Ann Rheum Dis, 2017. 76(6): p. 948-959.
4. informazioni tecniche aggiornate su RINVOQ® (upadacitinib) all’indirizzo
www.swissmedicinfo.ch
.
Smolen, J.S., et al, Raccomandazioni EULAR per la gestione dell’artrite reumatoide con farmaci antireumatici sintetici e biologici modificanti la malattia: aggiornamento 2019. Ann Rheum Dis, 2020. 79(6): p. 685-699.
6 Accortt, N.A., et al, Impatto della remissione sostenuta sul rischio di infezioni gravi nei pazienti con artrite reumatoide. Arthritis Care Res (Hoboken), 2018. 70(5): p. 679-684.
7. Solomon, D.H., et al, Attività della malattia nell’artrite reumatoide e rischio di eventi cardiovascolari. Arthritis Rheumatol, 2015. 67(6): p. 1449-55.
8 Baecklund, E., et al, Associazione dell’infiammazione cronica, non del suo trattamento, con un aumento del rischio di linfoma nell’artrite reumatoide. Arthritis Rheum, 2006. 54(3): p. 692-701.
9 Conaghan, P., et al, Analisi dei benefici e dei rischi di Upadacitinib rispetto ad Adalimumab nel trattamento dei pazienti con artrite reumatoide da moderata a grave. Rheumatol Ther, 2022. 9(1): p. 191-206.
Le referenze possono essere richieste dai professionisti all’indirizzo medinfo.ch@abbvie.com.
Relazione: Corinne Peter, MD
Questo articolo è stato realizzato con il sostegno finanziario di AbbVie AG, Alte Steinhauserstrasse 14, Cham.
Brevi informazioni tecniche UPA
CH-RNQD-230016_04/2023
Online dal 04.05.2023











