Sulla base dei dati provenienti da ampi studi clinici, attualmente si raccomanda che tutti i pazienti con diabete e insufficienza cardiaca cronica – indipendentemente dalla frazione di eiezione ventricolare sinistra – siano trattati con un inibitore SGLT-2 come add-on. Di conseguenza, gli studi hanno dimostrato una riduzione significativa dei ricoveri ospedalieri legati all’insufficienza cardiaca e della mortalità cardiovascolare. Il SGLT-i deve essere utilizzato come parte di una terapia multimodale.
Circa un terzo di tutti i pazienti con diabete presenta un’insufficienza cardiaca (Tabella 1). Il rischio di insufficienza cardiaca è da 2 a 5 volte superiore nei diabetici rispetto alla popolazione generale, ha spiegato la dottoressa Amadea Erben del Centro Cardiologico Tedesco di Monaco [1]. “Dobbiamo sottoporre i pazienti diabetici a screening regolari”, ha detto il relatore, chiedendo informazioni su sintomi come la riduzione delle prestazioni, la dispnea o l’edema alle gambe. Al contrario, i pazienti con insufficienza cardiaca hanno un rischio maggiore di sviluppare il diabete. Il 30-40% dei pazienti con insufficienza cardiaca ha il diabete o il prediabete. Pertanto, tutti i pazienti a cui è stata diagnosticata per la prima volta un’insufficienza cardiaca dovrebbero essere sottoposti a uno screening per verificare la presenza di diabete. Per i pazienti di età superiore ai 45 anni con risultati negativi, le linee guida raccomandano di ripetere questo screening ogni tre anni, ha riferito il dottor Erben [1].
Empagliflozin e dapagliflozin sono utili per HFpEF, HFmrEF e HFrEF
Fino a poco tempo fa, non era possibile offrire ai pazienti con HFpEF una terapia che migliorasse la mortalità. Le raccomandazioni della linea guida ESC 2021 per questo sottogruppo di pazienti con insufficienza cardiaca si limitavano all’uso di diuretici e alla migliore gestione possibile delle comorbidità. “Questo è cambiato nel frattempo”, ha ammesso il relatore [1]. Sulla base dei risultati dello studio EMPA-PRESERVED su empagliflozin e dello studio DELIVER su dapagliflozin, nell’aggiornamento 2023 della linea guida ESC [8,9] è stata postulata una raccomandazione di classe I per questi inibitori SGLT-2 (SGLT-2-i) nell’HFpEF. “Entrambi gli studi hanno dimostrato che l’aggiunta di un SGLT-2-i ha ridotto in modo significativo la morte cardiovascolare e l’ospedalizzazione legata all’insufficienza cardiaca. Con empagliflozin del 21% e con dapagliflozin del 18%”, ha detto il dottor Erben di [1,8,9].
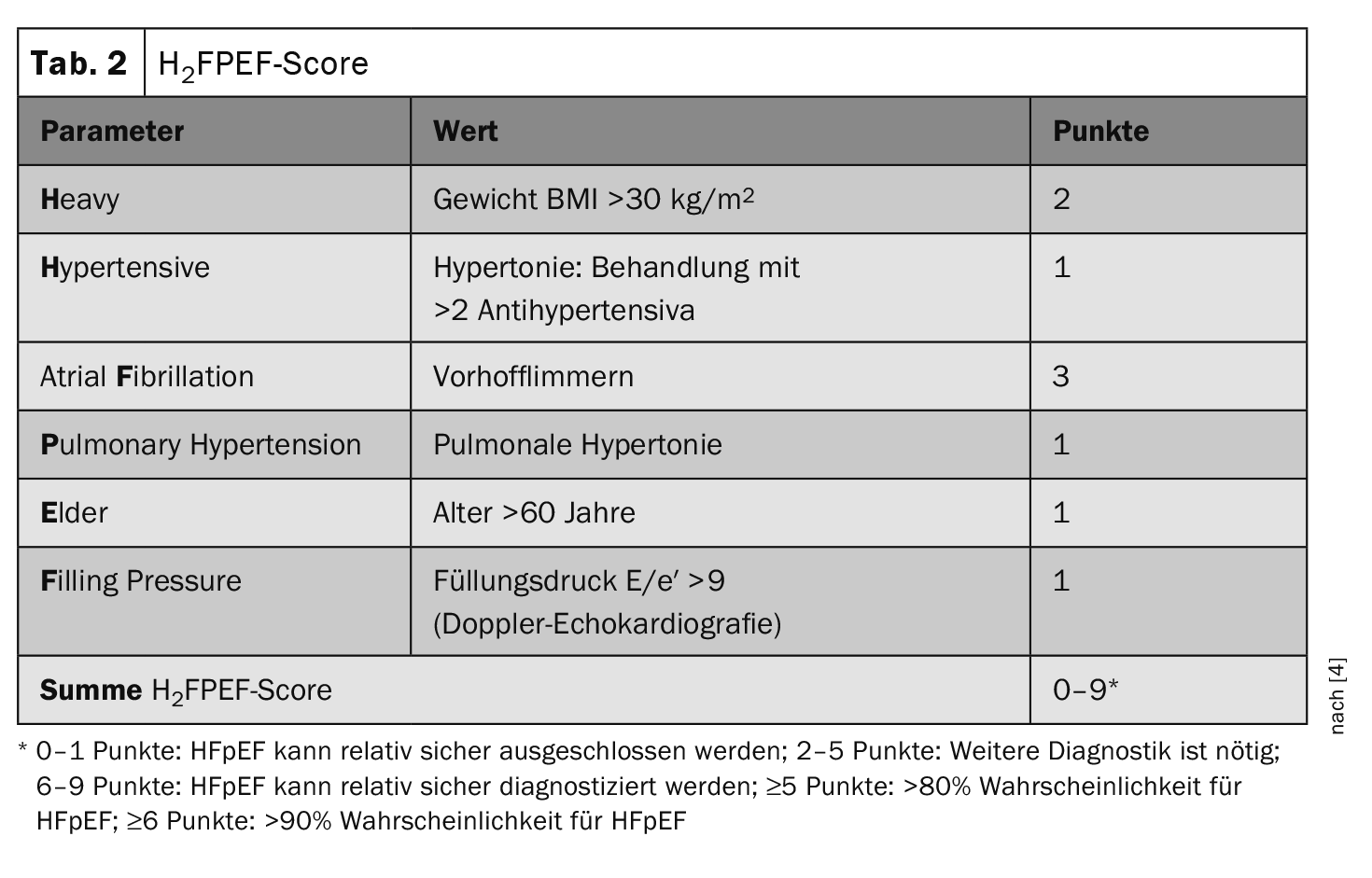
Il punteggio H2FPEFcome aiuto diagnostico
“Le comorbidità giocano un ruolo importante nello sviluppo dell’HFpEF”, ha sottolineato il relatore [1]. I sintomi concomitanti comorbili, come l’ipertensione arteriosa, l’obesità o la carenza di ferro, vengono mappati nel punteggio H2FPEF. Questo punteggio raccomandato nelle linee guida ESC (Tabella 2) è stato sviluppato nel 2018 e convalidato utilizzando dati retrospettivi di persone che si sono rivolte a una misurazione invasiva della pressione arteriosa a causa di dispnea inspiegabile. La presenza di HFpEF viene valutata nel punteggio H2FPEF utilizzando 6 parametri di aree diverse (fattori di rischio, malattie precedenti ed ecocardiografia) [2,3]. Nello studio di validazione, questo punteggio ha permesso di differenziare bene i pazienti con HFpEF da quelli con cause non cardiache di dispnea (p<0,0001).
Quale terapia combinata è migliore per l’HFrEF?
Per il trattamento dell’HFrEF (LVEF ≤40%), dal 2021 è in vigore una raccomandazione di classe I per l’uso dei “Fantastici quattro”: ACE inibitore o ARNI, SGLT-2-i, betabloccante e antagonista del recettore mineralcorticoide. I due studi storici DAPA-HF e EMPEROR-Reduced hanno dimostrato che l’SGLT-2-i come add-on ha ridotto significativamente l’endpoint combinato di morte e ricovero ospedaliero legato all’insufficienza cardiaca [10,11]. Il dottor Erben ha sottolineato che questi effetti di miglioramento della prognosi dimostrati negli studi si applicano solo ai pazienti con diabete di tipo 2, mentre non esiste alcuna raccomandazione per l’uso di SGLT-2-i nei diabetici di tipo 1 [1]. È anche importante informare i pazienti non solo sui benefici dell’SGLT-2-i, ma anche sui possibili effetti collaterali. Per esempio, si può verificare un aumento dello stimolo a urinare e una riduzione della pressione sanguigna, e un’assunzione sufficiente di liquidi si è dimostrata utile per prevenire le infezioni urogenitali, ha riferito il relatore [1]. Dovrebbe anche seguire le “regole del giorno di malattia” per evitare la chetoacidosi. In termini concreti, ciò significa che l’SGLT-2-i deve essere messo in pausa se l’assunzione di cibo e liquidi è carente e ripreso solo quando il comportamento alimentare si è normalizzato. Questo si riferisce, ad esempio, alle fasi di malattia con febbre, diarrea e vomito, ma anche al periodo prima o dopo operazioni importanti o soggiorni in terapia intensiva [4].
Per quanto riguarda l’implementazione e la titolazione delle “Fantastiche quattro”, si raccomanda che tutte e quattro le classi di sostanze siano iniziate tempestivamente a basse dosi e titolate lentamente in base al profilo del paziente sottostante [4]. Ci sono opinioni controverse sul fatto che si debba dare la preferenza a un ACE-inibitore o a un ARNI nella combinazione quadrupla. La linea guida europea privilegia l’ACE-i; secondo la linea guida americana, si dovrebbe usare prima un ARNI. Secondo le conoscenze attuali, i “Fantastici quattro” sono una terapia che dura tutta la vita. Questo si può dedurre dallo studio TRED-HF (“Therapy withdrawal in REcovered Dilated cardiomyopathy – Heart Failure”): in ogni caso si è verificata una ricaduta dopo l’interruzione graduale [5]. D’altra parte, i farmaci come il saxagliptin o il pioglitazone con effetti potenzialmente negativi sull’insufficienza cardiaca devono essere sospesi. E, naturalmente, sono importanti i controlli regolari, soprattutto dei valori di HbA1c.
Approccio terapeutico olistico, comprese le comorbidità
“Il trattamento dell’insufficienza cardiaca richiede un team interdisciplinare”, ha sottolineato il dottor Erben [1]. Le comorbidità sono prognosticamente sfavorevoli non solo nell’HFpEF, ma anche nei pazienti con HFrEF o HFmrEF e devono essere trattate adeguatamente. “Più comorbilità ci sono, peggiore è la prognosi del paziente e più siamo tenuti a prendere in considerazione queste comorbilità”, ha riassunto il relatore [1]. La carenza di ferro è una comorbidità importante e frequente nell’insufficienza cardiaca. Fino a due terzi dei pazienti ne sono affetti. Se viene rilevata una carenza di ferro (saturazione della transferrina inferiore al 20% o ferritina sierica inferiore a 100 ng/ml), deve essere somministrato un trattamento con ferro per via endovenosa. Il relatore ha sottolineato che questa raccomandazione si applica anche se nello studio IRONMAN non è stato possibile dimostrare alcun beneficio significativo in termini di mortalità [6]. Tuttavia, è stato dimostrato che la correzione della carenza di ferro può migliorare i sintomi e la qualità di vita dei pazienti. I risultati del grande studio randomizzato FAIR-HF2 sono ancora in attesa di essere pubblicati su [12]. Infine, ma non meno importante, anche le componenti del trattamento non farmacologico, come l’educazione del paziente, l’allenamento fisico e l’alimentazione, sono fattori importanti nella gestione dell’insufficienza cardiaca. Se i pazienti rimangono sintomatici, si deve prendere in considerazione la terapia con un dispositivo (ad esempio, l’ICD).
Congresso: Diabetologie grenzenlos
Letteratura:
- «Herzinsuffizienz», Dr. med. Amadea Erben, Diabetologie grenzenlos, München, 02.–03.02.2024.
- «In 3 einfachen Schritten zur HFpEF-Wahrscheinlichkeit», https://herzmedizin.de, (letzter Abruf 27.02.2024).
- Reddy YNV, et al.: A Simple, Evidence-Based Approach to Help Guide Diagnosis of Heart Failure With Preserved Ejection Fraction. Circulation 2018; 138(9): 861–870.
- Schütt K, et al.: Positionspapier Herzinsuffizienz und Diabetes, Kardiologie 2022; 16: 358–371.
- Halliday BP, et al.: Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial. Lancet 2019; 393(10166): 61–73.
- Kalra PR, et al.: IRONMAN Study Group. Intravenous ferric derisomaltose in patients with heart failure and iron deficiency in the UK (IRONMAN): an investigator-initiated, prospective, randomised, open-label, blinded-endpoint trial. Lancet 2022; 400(10369): 2199–2209.
- Sun Y, et al.: Predictive value of H2FPEF score in patients with heart failure with preserved ejection fraction. ESC Heart Fail 2021; 8(2): 1244–1252.
- Anker SD, et al.: EMPEROR-Preserved Trial Investigators. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. NEJM 2021; 385(16): 1451–1461.
- Solomon SD, et al.: on behalf of the DELIVER Trial Committees and Investigators. Dapagliflozin in Heart Failure With Mildly Reduced or Preserved Ejection Fraction. NEJM 2022; 387: 1089–1098.
- McMurray JJV, et al.: DAPA-HF Trial Committees and Investigators. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. NEJM 2019; 381(21): 1995–2008.
- Packer M, et al.: EMPEROR-Reduced Trial Investigators. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. NEJM 2020; 383(15): 1413–1424.
- FAIR-HF2-DZHK5, https://fair-hf2.dzhk.de,(ultimo accesso 28/02/2024).
HAUSARZT PRAXIS 2024; 19(3): 34–35 (pubblicato il 20.3.24, prima della stampa)
CARDIOVASC 2024; 23(1): 32–33
InFo DIABETOLOGIE & ENDOKRINOLOGIE 2024; 1(2): 26