La malattia del fegato grasso non alcolica (NAFLD) è la malattia epatica più comune nel mondo occidentale. A differenza della malattia alcolica del fegato grasso, il consumo di alcol nella NAFLD dovrebbe essere a un livello generalmente sicuro, cioè <20 grammi al giorno per le donne e <30 grammi al giorno per gli uomini. Con l’aumento della prevalenza dell’obesità e delle condizioni associate, come il diabete mellito di tipo 2, la dislipidemia, l’ipertensione e l’apnea ostruttiva del sonno, anche la prevalenza della NAFLD è aumentata in modo significativo negli ultimi anni.
Eziologia e fattori di rischio
La malattia del fegato grasso non alcolica (NAFLD) è la malattia epatica più comune nel mondo occidentale. A differenza della malattia alcolica del fegato grasso, il consumo di alcol nella NAFLD dovrebbe essere a un livello generalmente sicuro, cioè <20 grammi al giorno per le donne e <30 grammi al giorno per gli uomini. Nei Paesi con un’alta percentuale di persone in sovrappeso e obese, circa un quarto o un terzo degli adulti ha la NAFLD. (Fig.1). Con l’aumento della prevalenza dell’obesità e delle condizioni associate, come il diabete mellito di tipo 2, la dislipidemia, l’ipertensione e l’apnea ostruttiva del sonno, anche la prevalenza della NAFLD è aumentata in modo significativo negli ultimi anni. Per esempio, mentre la NAFLD colpiva il 6% degli adulti negli Stati Uniti nel 2003, questo numero è salito al 18% nel 2011 e attualmente è appena sotto il 25% [1]. Nelle popolazioni a rischio, ossia i pazienti con obesità e diabete mellito di tipo 2, la prevalenza della NAFLD è addirittura superiore al 50% [2]. L’aumento globale del consumo di bevande dolci, soprattutto quelle ad alto contenuto di fruttosio, ha anche contribuito all’aumento dei tassi di prevalenza della NAFLD. A causa di questi chiari fattori di rischio metabolico, la NAFLD è anche chiamata manifestazione epatica della sindrome metabolica. Da distinguere sono altre cause che possono portare alla steatosi epatica, come la rapida perdita di peso, la nutrizione parenterale totale, l’infezione da epatite C di genotipo 3, la malattia di Wilson e alcuni farmaci (ad esempio, il metotrexato). L’evidenza dei fattori di rischio genetici è venuta dagli studi sui gemelli monozigoti e dagli studi sulle famiglie, che hanno dimostrato che il rischio che anche i parenti di primo grado sviluppino la NAFLD è fino al 50%. I pazienti di origine asiatica e sudamericana sono particolarmente colpiti [3]. Inoltre, esistono geni di rischio come la patatin-like phospholipase domain-containing 3 (PNPLA3), transmembrane 6 superfamily member 2 (TM6SF2), 17-beta hydroxysteroid dehydrogenase 13 (HSD17B13), membrane-bound O-acyltransferase domain-containing 7 (MBOAT7) o transmembrane channel-like 4 (TMC4) che influenzano la steatosi epatica e lo sviluppo della fibrosi in alcuni pazienti con NAFLD. È possibile che la determinazione delle varianti genetiche di rischio possa essere utilizzata per la stratificazione del rischio in futuro, ma non hanno ancora un ruolo nella pratica clinica.
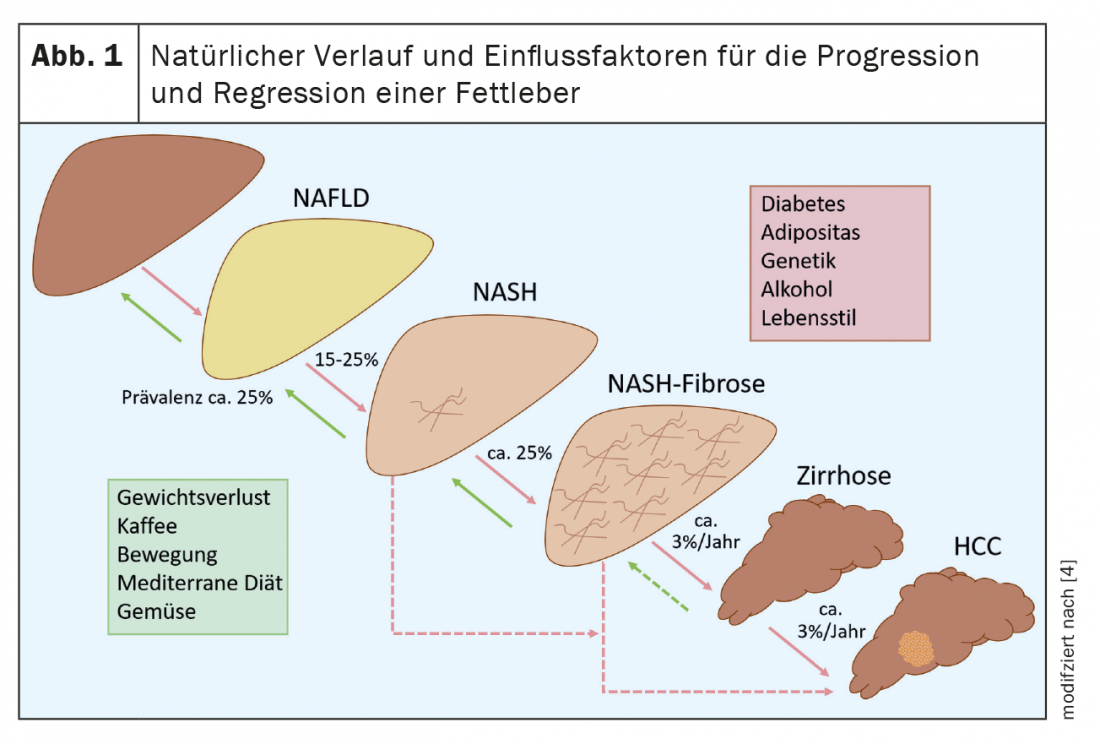
La maggior parte dei pazienti con NAFLD presenta una steatosi epatica pura e circa il 15-25% di questi casi può progredire verso la steatoepatite non alcolica (NASH) [4]. (Fig.1). Alcuni di questi pazienti sviluppano una fibrosi epatica rilevante e fino al 12% dei pazienti con NASH sviluppano successivamente una cirrosi epatica [2]. Questo aumenta il rischio di scompenso epatico e di carcinoma epatocellulare (HCC), ognuno dei quali aumenta significativamente la morbilità e la mortalità della NAFLD. È quindi importante identificare i pazienti a rischio di malattia progressiva o con fibrosi avanzata, per trattarli precocemente e sottoporli a screening per l’HCC. Con una terapia adeguata, è possibile la stabilizzazione o addirittura la regressione della malattia. Questo illustra ancora una volta l’importanza della diagnosi. Tuttavia, i dati recenti di un grande database sanitario tedesco mostrano che la NAFLD è significativamente sottodiagnosticata [5].
La mortalità dei pazienti con NAFLD è in gran parte determinata dalle malattie cardiovascolari, pertanto il rischio cardiovascolare di questi pazienti dovrebbe essere rivisto annualmente, ad esempio utilizzando il calcolatore di rischio AGLA dell’Associazione Svizzera per la Prevenzione dell’Aterosclerosi. La NAFLD è anche un fattore di rischio indipendente per le malattie cardiovascolari.
Screening, diagnostica e sorveglianza
Il sospetto di NAFLD viene formulato dopo l’esclusione di altre cause di malattia epatica (soprattutto epatite virale cronica, malattia epatica alcolica o autoimmune) e in presenza di un profilo di rischio metabolico con evidenza concomitante di steatosi all’esame ecografico. Le attuali linee guida indicano una biopsia epatica per il rilevamento della steatosi, anche se a causa dell’invasività e dell’elevato numero di pazienti nella pratica clinica, si è affermata la suddetta procedura con l’ecografia [6]. Sonograficamente, la steatosi può essere rilevata solo a partire da circa il 20% di degenerazione grassa. Il passo diagnostico successivo consiste nel valutare se la fibrosi epatica è già presente, poiché questo determinerà la prognosi del paziente. Indipendentemente dalla presenza di attività infiammatoria (NASH), i pazienti con fibrosi epatica esistente hanno una mortalità complessiva e correlata al fegato a lungo termine significativamente più alta rispetto ai pazienti senza fibrosi [7].
La biopsia epatica è il gold standard per la diagnosi di fibrosi. Istologicamente, si distinguono 5 stadi di fibrosi: Da F0 = assenza di fibrosi a F4 = cirrosi. Inoltre, l’istologia è l’unico modo per distinguere la presenza di NAFLD e NASH. Nella NAFLD, più del 5% degli epatociti è affetto da steatosi [6]. Nella NASH, si trovano anche epatociti gonfiati e infiltrati di cellule infiammatorie [8]. L’entità di questi cambiamenti è riassunta nel cosiddetto punteggio di attività della NAFLD (NAS). Se questo punteggio è di 5 o più punti, i criteri diagnostici per la NASH sono soddisfatti. Tali cambiamenti favoriscono poi la formazione di fibrosi e persino di cirrosi. La biopsia epatica viene solitamente eseguita da uno specialista in gastroenterologia ed epatologia per domande specifiche. Può essere eseguita se si sospetta una fibrosi di grado superiore nella diagnostica non invasiva della fibrosi (Fig. 2) o per la diagnostica differenziale nel caso di una possibile altra causa di malattia epatica presente in concomitanza, in quanto è rilevante per la terapia e il monitoraggio del paziente.
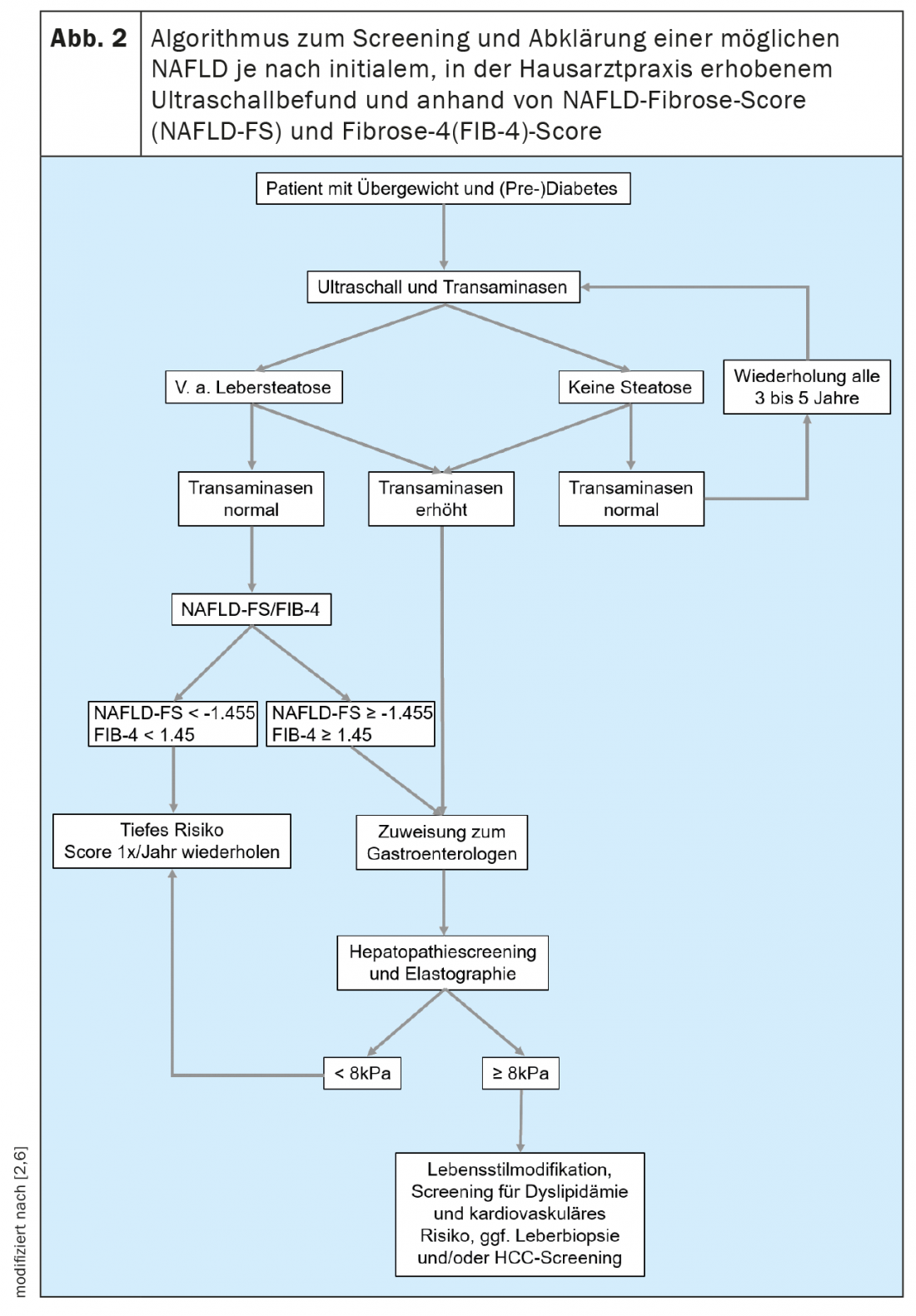
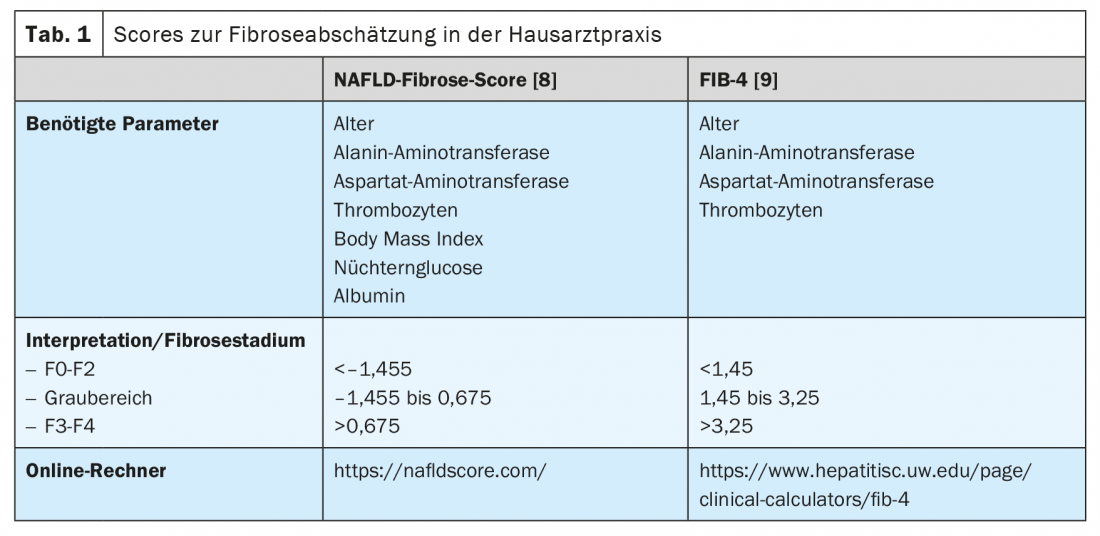
Inoltre, esistono metodi non invasivi per valutare la presenza e l’estensione della fibrosi epatica. Ciò consente ai colleghi che trattano spesso pazienti nelle popolazioni a rischio per la NAFLD, come i medici di base, gli endocrinologi e i cardiologi, di eseguire uno screening semplice. In generale, si raccomanda di iniziare lo screening della NAFLD in tutti i pazienti che appartengono a una delle popolazioni a rischio, mediante un esame ecografico. (Fig. 2). Se c’è un sospetto di steatosi epatica, si deve valutare il rischio di una malattia epatica di grado superiore esistente, determinando le transaminasi e altri parametri clinici, come l’indice di massa corporea, l’età e l’emocromo. Esistono molti punteggi basati su valori clinici o sierici che possono essere utilizzati principalmente per escludere una malattia epatica avanzata. Di questi, il NAFLD Fibrosis Score -(NAFLD-FS) e il Fibrosis-4 (FIB-4) sono sufficientemente validati per essere raccomandati in questa sede (Tabella 1) [9,10]. I valori di NAFLD-FS e FIB-4 nell’intervallo di fibrosi da F0 a F2 escludono quasi del tutto la malattia epatica grave. Se, sulla base di questi punteggi, c’è il sospetto di una fibrosi epatica di grado superiore (punteggi nella gamma grigia, o nella gamma di fibrosi F3 o F4), è necessario rivolgersi a un gastroenterologo per una diagnostica estesa con elastografia transitoria (FibroScan).®) o l’elastografia a onde di taglio e, se necessario, può essere eseguita una biopsia epatica. (Fig. 2). Utilizzando la velocità di propagazione di un impulso a ultrasuoni nel fegato, il grado di fibrosi epatica può essere stimato in modo non invasivo con l’aiuto dell’elastografia transitoria o a onde di taglio, e si può anche fare una diagnosi di progressione durante la terapia. I pazienti con obesità, diabete di tipo 2 o prediabete e transaminasi elevate dovrebbero generalmente essere indirizzati a uno specialista in gastroenterologia ed epatologia per un’ecografia addominale con elastografia, a causa dell’alta prevalenza di NAFLD in questa popolazione [11,6]. Nel contesto dell’elastografia transitoria, viene determinato contemporaneamente anche un surrogato della steatosi epatica mediante il parametro di attenuazione controllata (CAP). Questo valore CAP può indicare la steatosi se elevato oltre i 275 dB/m, ma questo metodo non è attualmente raccomandato per l’unica diagnosi iniziale di steatosi epatica a causa dei dati insufficienti [12].
I pazienti con cirrosi sono a maggior rischio di sviluppare un carcinoma epatocellulare e dovrebbero pertanto sottoporsi a uno screening semestrale del carcinoma epatocellulare. Se la visibilità ecografica è buona, si procede con l’ecografia e si determina anche l’alfa-fetoproteina (AFP) come marcatore tumorale. Se la visibilità è difficile, ad esempio a causa dell’obesità concomitante, si può eseguire una risonanza magnetica del fegato (in alternativa, se necessario). In una parte dei pazienti, il carcinoma epatocellulare si verifica prima che si sviluppi la cirrosi, ma lo screening generale del carcinoma epatocellulare nei pazienti con NAFLD senza cirrosi non è considerato economicamente vantaggioso a causa dell’elevato numero di pazienti. In generale, lo screening del carcinoma epatocellulare è raccomandato a partire dalla presenza di fibrosi F3 (“fibrosi a ponte”).
Opzioni terapeutiche
La terapia della NAFLD/NASH mira a prevenire la progressione della malattia o a ottenere la regressione della fibrosi e anche a ridurre il rischio cardiovascolare dei pazienti. Negli ultimi anni sono stati condotti numerosi studi di terapia farmacologica, compresi quelli di fase 3, ma non è ancora stata approvata una terapia specifica. Le sostanze studiate comprendono approcci terapeutici metabolici, antinfiammatori e antifibrotici. L’acido obeticolico, un agonista del recettore farnesoide X (FXR), ha dimostrato di migliorare la fibrosi epatica nell’unico studio positivo di fase 3 finora condotto (REGENERATE) [13]. Questa sostanza è già in commercio per il trattamento della colangite biliare primaria (Ocaliva®); l’approvazione con l’indicazione NASH è in attesa. Gli studi attuali stanno anche esaminando la combinazione di diversi preparati. La prevenzione della progressione della malattia sembra essere più facile da raggiungere rispetto alla regressione della fibrosi epatica. Soprattutto per i pazienti con malattia avanzata, la terapia farmacologica potrebbe essere utile, ma finora non è ancora possibile una cura farmacologica [6].
Il fulcro della terapia per la NAFLD è quindi la perdita di peso con cambiamenti nello stile di vita. Gli studi hanno dimostrato effetti significativi sul grado di degenerazione grassa e di infiammazione del fegato e, in alcuni casi, sulla regressione della fibrosi. Questo approccio terapeutico ha anche un effetto positivo sulle co-morbilità rilevanti, come il diabete, la sindrome da apnea del sonno o l’aumento del rischio cardiovascolare. La Società tedesca per le malattie dell’apparato digerente e del metabolismo e la Società europea per le malattie del fegato raccomandano una riduzione del peso dal 7 al 10%, che dovrebbe essere ottenuta con cambiamenti nella dieta (evitando gli alimenti che favoriscono lo sviluppo della NAFLD) e aumentando l’attività fisica, veda anche la Tabella 2 [6,14]. L’allenamento di resistenza e l’allenamento di forza sono entrambi efficaci, quindi può essere progettato in base alle preferenze del paziente. È quindi disponibile una terapia efficace per la NAFLD, ma l’attuazione delle raccomandazioni e il raggiungimento di una riduzione permanente del peso sono spesso difficili per il paziente nella vita quotidiana. Un approccio multidisciplinare, soprattutto per i pazienti a rischio di malattia progressiva o già avanzata, che includa la consulenza nutrizionale e l’endocrinologia con un consulto sull’obesità, ha senso.

In questo senso, anche la chirurgia bariatrica è elencata come una possibile opzione terapeutica, se esiste un’indicazione all’intervento chirurgico in relazione a un’obesità attuale. È stato dimostrato che dopo la chirurgia bariatrica c’è una diminuzione significativa dell’attività infiammatoria nella maggior parte dei pazienti ed è possibile anche la regressione della fibrosi [15].
Se sono presenti delle co-morbilità, queste devono essere trattate secondo le raccomandazioni attuali delle rispettive società professionali. Attualmente non ci sono raccomandazioni per l’uso di agenti che abbassano i lipidi, statine, biguanidi, inibitori SGLT2 o agonisti GLP1 nei pazienti con NAFLD senza la corrispondente co-morbilità, ma ci sono dati che mostrano un beneficio, cioè una regressione della steatosi e dell’infiammazione, nei pazienti con NAFLD [16,17]. Se la somministrazione di statine è indicata sulla base del profilo lipidico, esse possono essere utilizzate anche nei pazienti con NAFLD senza aumento del rischio, purché la funzione epatica sia compensata. Se è già presente una cirrosi infantile A, può verificarsi un aumento significativo della biodisponibilità a seconda del preparato, per cui è necessario valutare un aggiustamento della dose ed effettuare un monitoraggio regolare della creatina nasi, poiché il rischio di rabdomiolisi è leggermente aumentato.
I pazienti con fegato grasso e sindrome metabolica spesso presentano anche elevati livelli di ferritina sierica in presenza di una normale saturazione della transferrina o in assenza di una mutazione genetica compatibile con l’emocromatosi. In questi pazienti, il beneficio della flebotomia per esaurire le riserve di ferro è controverso e non può essere raccomandato a causa dei dati limitati [6]. L’iperferritinemia in questi pazienti è un’espressione della steatoepatite.
In caso di progressione della NASH verso la cirrosi scompensata, esiste la possibilità di valutare il trapianto di fegato. Nel frattempo, la cirrosi NASH è già la causa più comune di trapianto di fegato negli Stati Uniti.
MAFLD– che cos’è?
La distinzione tra la malattia del fegato grasso alcolica e non alcolica è spesso difficile. Come già detto, la NAFLD è una diagnosi di esclusione. Tuttavia, spesso non è possibile distinguere il ruolo del consumo di alcol o di altre patologie epatiche coesistenti dalla NAFLD, ad esempio in un paziente con obesità, diabete ed epatite B cronica. Per questo motivo, si sta cercando di utilizzare il termine di malattia del fegato grasso associata al metabolismo (MAFLD). Introdurre la nuova terminologia con enfasi sull’eziologia. Questa definizione tiene conto delle malattie metaboliche concomitanti e la presenza di altre malattie epatiche non costituisce una controindicazione alla diagnosi [18]. La MAFLD può essere diagnosticata quando c’è una steatosi epatica (diagnostica per immagini o biopsia) con un’obesità aggiuntiva (indice di massa corporea
≥
25 kg/m²) o diabete di tipo 2. Nei soggetti normopeso, devono essere considerati 2 fattori aggiuntivi di sindrome metabolica (circonferenza dei fianchi >101 e 87 cm negli uomini e nelle donne, rispettivamente). Donne, ipertensione >130/85 mmHg, ipertrigliceridemia >1,7 mmol/l, colesterolo HDL <1,0 e 1,3 mmol/l rispettivamente negli uomini e nelle donne, prediabete con HbA1c da 5,7 a 6,4%, CRP >2 mg/l). Questa definizione è utilizzata in una certa misura, ma non si è ancora affermata nelle linee guida esistenti delle società professionali e nella pratica clinica quotidiana.
Messaggi da portare a casa
- La prevalenza della NAFLD è aumentata in modo significativo negli ultimi anni.
- I pazienti con obesità e sindrome metabolica sono ad alto rischio di sviluppare la NAFLD.
- Lo screening di queste popolazioni a rischio da parte dei loro medici di base per la presenza di NAFLD e la stima dello stadio della malattia sono importanti per individuare precocemente la malattia epatica avanzata e iniziare il trattamento.
- Il punteggio di fibrosi della NAFLD e la FIB-4 sono metodi di screening per la valutazione della fibrosi e possono essere eseguiti senza bisogno di attrezzature.
- I pazienti con NAFLD devono essere sottoposti a screening regolari per le malattie cardiovascolari.
- La base della terapia è un cambiamento dello stile di vita con un aumento dell’attività fisica e una modifica della dieta con l’obiettivo di ridurre il peso di circa il 7-10%.
- Le terapie farmacologiche sono in fase di sperimentazione, ma finora non esiste un farmaco approvato per il trattamento della NAFLD.
Letteratura:
- Arshad T, Golabi P, Henry L, Younossi ZM: Epidemiologia della malattia del fegato grasso non alcolica in Nord America. Curr Pharm Des 2020; 26: 993-997.
- Vieira Barbosa J, Lai M: Screening della malattia epatica grassa non alcolica nei pazienti con diabete mellito di tipo 2 nel contesto delle cure primarie. Hepatol Commun 2021; 5: 158-167.
- Eslam M, Valenti L, Romeo S: Genetica ed epigenetica della NAFLD e della NASH: impatto clinico. J Hepatol 2018; 68: 268-279.
- Tacke F, Weiskirchen R: Fibrosi epatica correlata alla malattia del fegato grasso non alcolica (NAFLD)/steatoepatite non alcolica (NASH): meccanismi, trattamento e prevenzione. Ann Transl Med 2021; 9(8): 729.
- Canbay A, Kachru N, Haas JS, et al.: Modelli e predittori di mortalità e progressione della malattia tra i pazienti con malattia epatica grassa non alcolica. Aliment Pharmacol Ther 2020; 52: 1185-1194.
- Associazione Europea per lo Studio della L, Associazione Europea per lo Studio della D e Associazione Europea per lo Studio della O. Linee guida di pratica clinica EASL-EASD-EASO per la gestione della malattia del fegato grasso non alcolica. J Hepatol 2016; 64: 1388-1402.
- Angulo P, Kleiner DE, Dam-Larsen S, et al: La fibrosi epatica, ma non altre caratteristiche istologiche, è associata agli esiti a lungo termine dei pazienti con malattia epatica grassa non alcolica. Gastroenterologia 2015; 149: 389-397.
- Kleiner DE, Brunt EM, Van Natta M, et al: Progettazione e validazione di un sistema di punteggio istologico per la malattia del fegato grasso non alcolica. Epatologia 2005; 41: 1313-1321.
- Angulo P, Hui JM, Marchesini G, et al: Il punteggio di fibrosi della NAFLD: un sistema non invasivo che identifica la fibrosi epatica nei pazienti con NAFLD. Epatologia 2007; 45: 846-854.
- Sterling RK, Lissen E, Clumeck N, et al.: Sviluppo di un semplice indice non invasivo per prevedere la fibrosi significativa nei pazienti con coinfezione da HIV/HCV. Epatologia 2006; 43: 1317-1325.
- American Diabetes A. 4. Valutazione medica completa e valutazione delle comorbidità: Standard di assistenza medica nel diabete-2021. Diabetes Care 2021; 44: 40-52.
- Associazione Europea per lo Studio della L, Elenco del gruppo di esperti m, Berzigotti A, Boursier J, Castera L, et al: Linee guida di pratica clinica Easl (Cpgs) sui test non invasivi per la valutazione della gravità e della prognosi delle malattie epatiche – Aggiornamento 2020. J Hepatol 2021.
- Younossi ZM, Ratziu V, Loomba R, et al: Acido obeticolico per il trattamento della steatoepatite non alcolica: analisi ad interim di uno studio di fase 3 multicentrico, randomizzato, controllato con placebo. Lancet 2019; 394: 2184-2196.
- Roeb E, Steffen HM, Bantel H, et al: [S2k Guideline non-alcoholic fatty liver disease]. Z Gastroenterol 2015; 53: 668-723.
- Lassailly G, Caiazzo R, Ntandja-Wandji LC, et al: La chirurgia bariatrica fornisce una risoluzione a lungo termine della steatoepatite non alcolica e la regressione della fibrosi. Gastroenterologia 2020; 159: 1290-1301.
- Lai LL, Vethakkan SR, Nik Mustapha NR, et al: Empagliflozin per il trattamento della Steatoepatite Non Alcolica nei pazienti con Diabete Mellito di Tipo 2. Dig Dis Sci 2020; 65: 623-631.
- Newsome PN, Buchholtz K, Cusi K, et al: Uno studio controllato con placebo sul semaglutide sottocutaneo nella steatoepatite non alcolica. N Engl J Med 2021; 384: 1113-1124.
- Eslam M, Sanyal AJ, George J, International Consensus P: MAFLD: A Consensus-Driven Proposed Nomenclature for Metabolic Associated Fatty Liver Disease. Gastroenterologia 2020; 158: 1999-2014.
PRATICA GP 2021; 16(10): 4-8