No congresso deste ano da Associação Europeia de Dermato-Oncologia (EADO), foram explicadas as recomendações actuais para o tratamento do carcinoma espinocelular cutâneo (cSCC). O tratamento de primeira escolha continua a ser a excisão completa com controlo histológico da margem de incisão. A radioterapia adjuvante pode ser considerada em função do risco de recorrência. No CECC avançado não ressecável, a inibição do ponto de controlo imunitário é considerada uma terapêutica de primeira linha. Em caso de contra-indicações, podem ser utilizados agentes quimioterapêuticos ou inibidores do EGFR. O seguimento deve ser adaptado ao risco e incluir a ecografia dos gânglios linfáticos em doentes de alto risco.
O carcinoma de células escamosas da pele – uma neoplasia maligna dos queratinócitos epidérmicos – é o tumor maligno da pele mais comum nos seres humanos, a seguir ao carcinoma basocelular. Alexander J. Stratigos, MD, Departamento de Dermatologia-Venereologia, Hospital Andreas Sygros, Universidade Nacional e Kapodistrian de Atenas (Grécia) resumiu o estado atual dos conhecimentos sobre o diagnóstico e a terapêutica docarcinoma espinocelular cutâneo(cSCC) com referência a várias directrizes internacionais [1]. A diretriz europeia (EDF/EADO/EORTC) publicada em 2020 está atualmente a ser revista – espera-se que a nova versão seja publicada em breve – e as directrizes dos EUA (NCCN) são publicadas anualmente [1–4].
O CSCC ocorre mais frequentemente nos homens e 80% das vezes na área da cabeça e do rosto ou em áreas com exposição crónica à luz UV. O risco de contrair a doença aumenta significativamente com a idade. Se se suspeitar da presença de CEC, recomenda-se a inspeção de todo o tegumento. “Devemos descrever bem as lesões, documentar os sintomas e também medir o tamanho das lesões”, sublinhou o Prof. Stratigos [1]. Para além da dermatoscopia, a utilização de outros métodos de diagnóstico não invasivos, como a microscopia confocal a laser e a tomografia de coerência ótica, é particularmente útil para fins de diagnóstico diferencial.
O cSCC pode metastizar principalmente para os gânglios linfáticos regionais e formar metástases à distância. Por conseguinte, o diagnóstico precoce e a terapia adaptada ao risco são cruciais. Se houver uma suspeita clínica de CEC, deve também obter-se uma histologia para diferenciar entre outras neoplasias benignas ou malignas. Se o quadro clínico for claro para o cSCC, recomenda-se a ressecção completa.
A excisão com clarificação histológica continua a ser considerada a terapia padrão
O objetivo da excisão cirúrgica é a ressecção completa, incluindo o reprocessamento das margens periféricas e profundas da incisão [1]. A terapia cirúrgica local é fortemente influenciada pela precisão do controlo histológico da margem da incisão, explicou o Prof. Para a notificação histológica do CECC, deve ser utilizado um sistema de notificação normalizado, se possível, com informações sobre os seguintes critérios Subtipo histológico (desmoplásico, acantolítico, etc.), grau histológico de diferenciação, espessura máxima do tumor, profundidade da invasão tumoral (acima ou além da gordura subcutânea), invasão perineural, invasão linfática/vascular, ressecção completa possível/não possível, margens de incisão mínimas e máximas [1].
Biópsia do gânglio linfático sentinela: útil?
A indicação para a realização de uma biópsia do gânglio linfático sentinela (SLNB) em doentes com CECC é objeto de controvérsia, informou o Prof. Stratigos [1]. Devido à falta de dados válidos sobre o valor prognóstico e terapêutico, a SLNB não é recomendada como norma nas directrizes europeias. Não há provas de que os doentes com gânglios linfáticos sentinela positivos tenham piores resultados do que aqueles com resultados negativos, explicou o orador.
Quais são os factores de prognóstico mais importantes?
Entre a diretriz europeia publicada em 2020 e a diretriz americana publicada em 2022, existe consenso quanto ao facto de, para além da imunossupressão, os seguintes factores específicos do tumor aumentarem significativamente o risco de metástases e a mortalidade específica da doença em doentes com CECC [1–4]:
- Espessura vertical do tumor (>6 mm)
- Diâmetro horizontal do tumor (>2 cm ou >4 cm)
- diferenciação histológica
- Desmoplasia
- crescimento perineural
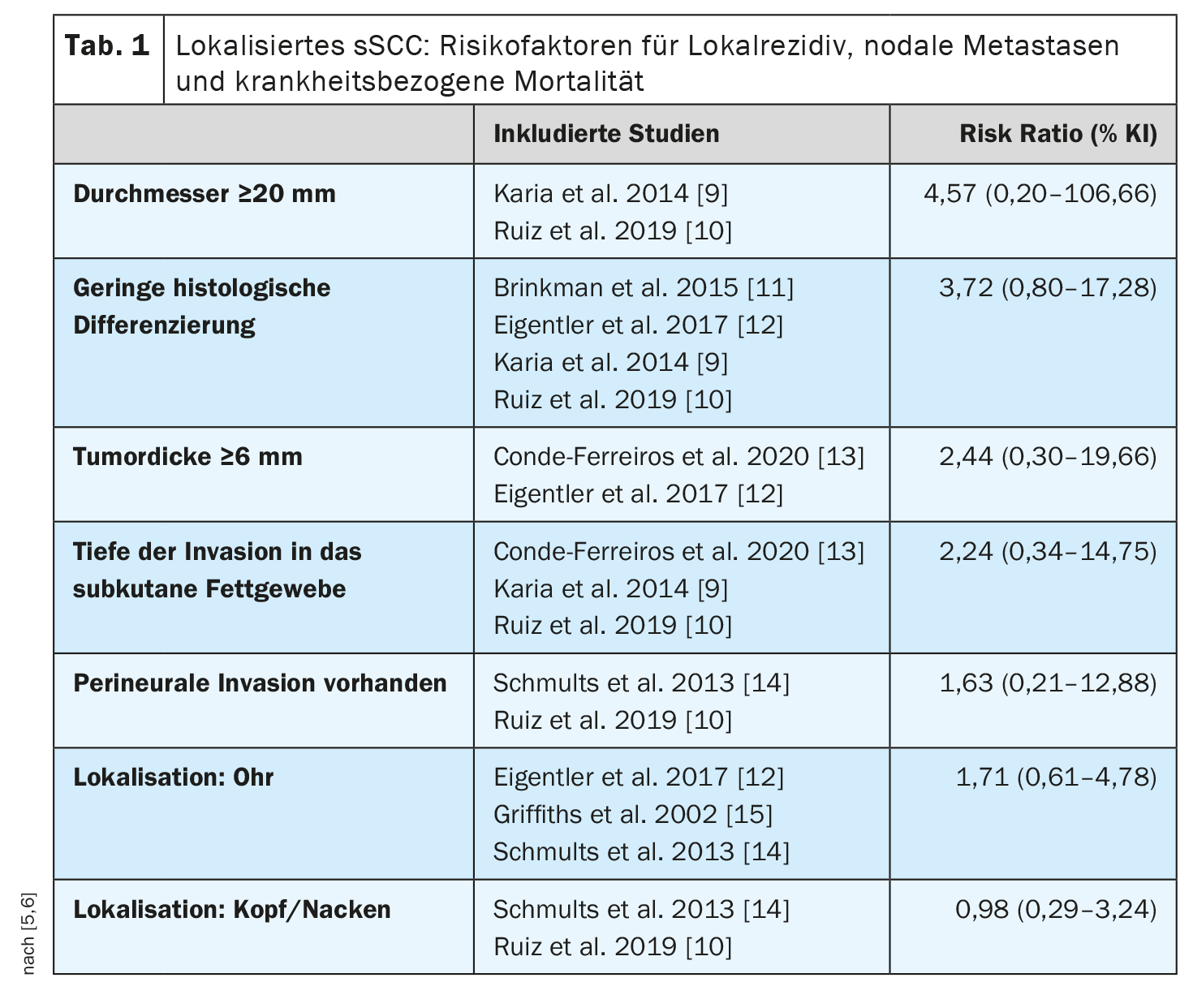
Isto é consistente com uma meta-análise publicada em 2022 que identificou os factores de risco associados à morte relacionada com a doença em doentes com CECC localizado (sem metástases loco-regionais ou à distância) [5,6] (Tabela 1). Foram incluídos nove estudos com 5205 doentes e um seguimento mediano de 18-81 meses. Verificou-se uma associação global positiva, mas não significativa, entre a morte relacionada com a doença e o diâmetro do tumor, a espessura do tumor, a presença de invasão perineural, a profundidade da invasão no tecido adiposo e a localização. Foi encontrado um risco 4 vezes maior para o diâmetro do tumor ≥20 mm e mais do dobro do risco para a espessura do tumor ≥6 mm em comparação com o cSCC sem estas características. Os doentes com imunossupressão tinham quase o dobro da probabilidade de morrer de CECC do que os doentes imunocompetentes (rácio de risco 1,85; IC 95%: 1,32-2,61). Os autores da meta-análise salientam que estes resultados devem ser considerados no contexto de certas limitações metodológicas (por exemplo, a heterogeneidade dos estudos).
Radioterapia: recomendação de indicação
O Prof. Stratigos resumiu as indicações gerais da radioterapia da seguinte forma [1]: Em primeiro lugar, como alternativa à excisão cirúrgica para tumores localmente irressecáveis, doentes inoperáveis ou tumores difíceis de operar, ou quando a ressecção não é desejada. E, em segundo lugar, após a excisão, no caso de margens de incisão positivas e se não for possível uma nova excisão. Bem como no contexto adjuvante após linfadenectomia terapêutica quando o cSCC se encontrava na cabeça e no pescoço com metástases nodais regionais e extensão extracapsular. Uma questão controversa é se a radioterapia adjuvante deve ser efectuada após a excisão completa com margens de ressecção sem tumor. Até à data, não foi possível comprovar qualquer benefício claro. O orador recomenda que pondere esta questão caso a caso. A radioterapia adjuvante pode ser aconselhável se estiverem presentes vários factores de risco.
Terapia de sistema com anti-PD-1-Ak ou com quimioterapia ou EGFR-i
A recidiva loco-regional deve ser removida cirurgicamente se for clinicamente possível localmente [7]. Para o tratamento de uma recidiva local ou loco-regional, deve ser examinada a indicação para uma terapia sistémica (Tab. 2) , caso não estejam disponíveis opções cirúrgicas ou radioterapêuticas. A indicação e a determinação da terapia do sistema devem ser feitas num comité multidisciplinar de tumores, sublinhou o Prof.
No CECC avançado ou quando a excisão cirúrgica e a radioterapia não são possíveis, as directrizes europeias e norte-americanas sugerem a imunoterapia de primeira linha com anti-PD-1-Ak (cemiplimab, pembrolizumab) [1–4]. Para os doentes em que os inibidores do ponto de controlo estão contra-indicados, estão disponíveis agentes que bloqueiam o recetor do fator de crescimento epidérmico (EGFR) ou vários regimes de quimioterapia [1–4].
Intervalos de seguimento adaptados ao risco
Para o seguimento de doentes com CEC, são recomendados intervalos de 6-12 meses num período de 2-5 anos para doentes de baixo risco [1]. Em doentes com um risco aumentado de metástases ou com achados de palpação pouco claros, devem ser seleccionados intervalos mais pequenos nos primeiros dois anos e deve ser realizada uma ecografia dos gânglios linfáticos em cada caso. Nos casos localmente avançados ou com metástases, é útil um regime de acompanhamento individualizado. Para além da proteção solar como medida profiláctica geral, a nicotinamida é defendida como intervenção quimiopreventiva. A nicotinamida (vitamina B3) melhora a reparação dos danos no ADN causados pela radiação ultravioleta (UV), entre outras coisas [1]. Num estudo de fase III, aleatorizado e em dupla ocultação, a nicotinamida (500 mg/2×dia) resultou numa redução de 30% na recorrência de CECC na população de doentes estudada (n=386) após 12 meses [8].
Congresso: Reunião Anual da EADO
Literatura:
- «Cutaneous squamous cell carcinoma guidelines», Prof. Alexander J. Stratigos, MD, EADO Annual Meeting 20–22 April 2023.
- Stratigos AJ, et al.: European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO) and the European Organization for Research and Treatment of Cancer (EORTC). European interdisciplinary guideline on invasive squamous cell carcinoma of the skin: Part 1. epidemiology, diagnostics and prevention. Eur J Cancer 2020; 128: 60–82.
- Stratigos AJ et al.: European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO) and the European Organization for Research and Treatment of Cancer (EORTC). European interdisciplinary guideline on invasive squamous cell carcinoma of the skin: Part 2. Treatment. Eur J Cancer 2020; 128: 83–102.
- Schmults C, et al.: National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology. Squamous Cell Skin Cancer 2022; Version 2.2022. www.nccn.org, (letzter Abruf 14.07.2023)
- Dessinioti C, Stratigos AJ: Recent Advances in the Diagnosis and Management of High-Risk Cutaneous Squamous Cell Carcinoma. Cancers 2022; 14(14): 3556.
- Dessinioti C, Platsidaki E, Stratigos AJ: A Sensitivity Meta-Analysis of Disease-Specific Death in Localized Cutaneous Squamous Cell Carcinoma. Dermatology 2022; 238(6): 1026–1035.
- AWMF: Aktinische Keratose und Plattenepithelkarzinom der Haut, S3-Leitlinie 032-022OL, Registernummer 032–022OL.
- Chen AC, et al.: A Phase 3 Randomized Trial of Nicotinamide for Skin-Cancer Chemoprevention. N Engl J Med 2015; 373: 1618–1626.
- Karia PS, et al.: Evaluation of American Joint Committee on Cancer, International Union Against Cancer, and Brigham and Women’s Hospital tumor staging for cutaneous squamous cell carcinoma. J Clin Oncol 2014; 32: 327–334.
- Ruiz ES, et al.: Surgery and Salvage Limited-Field Irradiation for Control of Cutaneous Squamous Cell Carcinoma with Microscopic Residual Disease. JAMA Dermatol 2019; 155: 1193–1195.
- Brinkman JN, et al.: The Effect of Differentiation Grade of Cutaneous Squamous Cell Carcinoma on Excision Margins, Local Recurrence, Metastasis, and Patient Survival. Ann Plast Surg 2015; 75: 323–326.
- Eigentler TK, et al.: Survival of Patients with Cutaneous Squamous Cell Carcinoma: Results of a Prospective Cohort Study. J Investig Dermatol 2017; 137: 2309–2315.
- Conde-Ferreirós A, et al.: Patterns of incidental perineural invasion and prognosis in cutaneous squamous cell carcinoma: A multicenter, retrospective cohort study. J Am Acad Dermatol 2020; 84: 1708–1712.
- Schmults CD, et al.: Factors predictive of recurrence and death from cutaneous squamous cell carcinoma: A 10-year, single-institution cohort study. JAMA Dermatol 2013; 149: 541–547.
- Griffiths RW, Feeley K, Suvarna SK: Audit of clinical and histological prognostic factors in primary invasive squamous cell carcinoma of the skin: Assessment in a minimum 5 year follow-up study after conventional excisional surgery. Br J Plast Surg 2002; 55: 287–292.
- Yanofsky VR, Mercer SE, Phelps RG: Histopathological Variants of Cutaneous Squamous Cell Carcinoma: A Review. Journal of Skin Cancer 2011: 1–13.
DERMATOLOGIE PRAXIS 2023; 33(4): 32–33