A esquizofrenia caracteriza-se, entre outras coisas, pela desregulamentação dopaminérgica. Todos os antipsicóticos aprovados para o seu tratamento são antagonistas dos receptores dopaminérgicos, especialmente os receptores D2 e D3. Os três agonistas parciais da dopamina D2 aripiprazole, brexpiprazole e cariprazina mostram um efeito significativamente melhor como antipsicóticos do que placebo no tratamento medicamentoso das doenças esquizofrénicas.
O mecanismo de acção dos antipsicóticos actualmente introduzidos apoia a hipótese neurobiológica de que a esquizofrenia se caracteriza, entre outras coisas, pela desregulamentação dopaminérgica [1]. Todos os antipsicóticos aprovados para o seu tratamento são antagonistas dos receptores dopaminérgicos, especialmente os receptores D2 e D3. Nos últimos 20 anos, três novos antipsicóticos foram introduzidos na Suíça para o tratamento da esquizofrenia; pertencem ao grupo dos agonistas receptores parciais de dopamina D2: aripiprazol, brexpiprazol e cariprazina. As suas propriedades farmacológicas e clínicas foram descritas em pormenor por Eich e Gertsch nesta revista em 2019 [2]. O presente artigo visa actualizar a literatura publicada desde então, mas também apresentar alguns tópicos em maior profundidade, com ênfase na brexpiprazole. Contudo, as recentes recomendações e revisões de tratamento [3–5] também mostram que a situação dos dados dos novos representantes deste grupo de medicamentos, brexpiprazole e cariprazina, ainda é escassa em comparação com a do aripiprazole, que está disponível há quase 20 anos. É particularmente notável que as comparações directas entre estes três antipsicóticos são extremamente raras, tanto em termos da sua eficácia clínica como do seu perfil de efeitos secundários (tolerância, segurança) [6].
Hipóteses neurobiológicas de esquizofrenia: aspectos farmacológicos
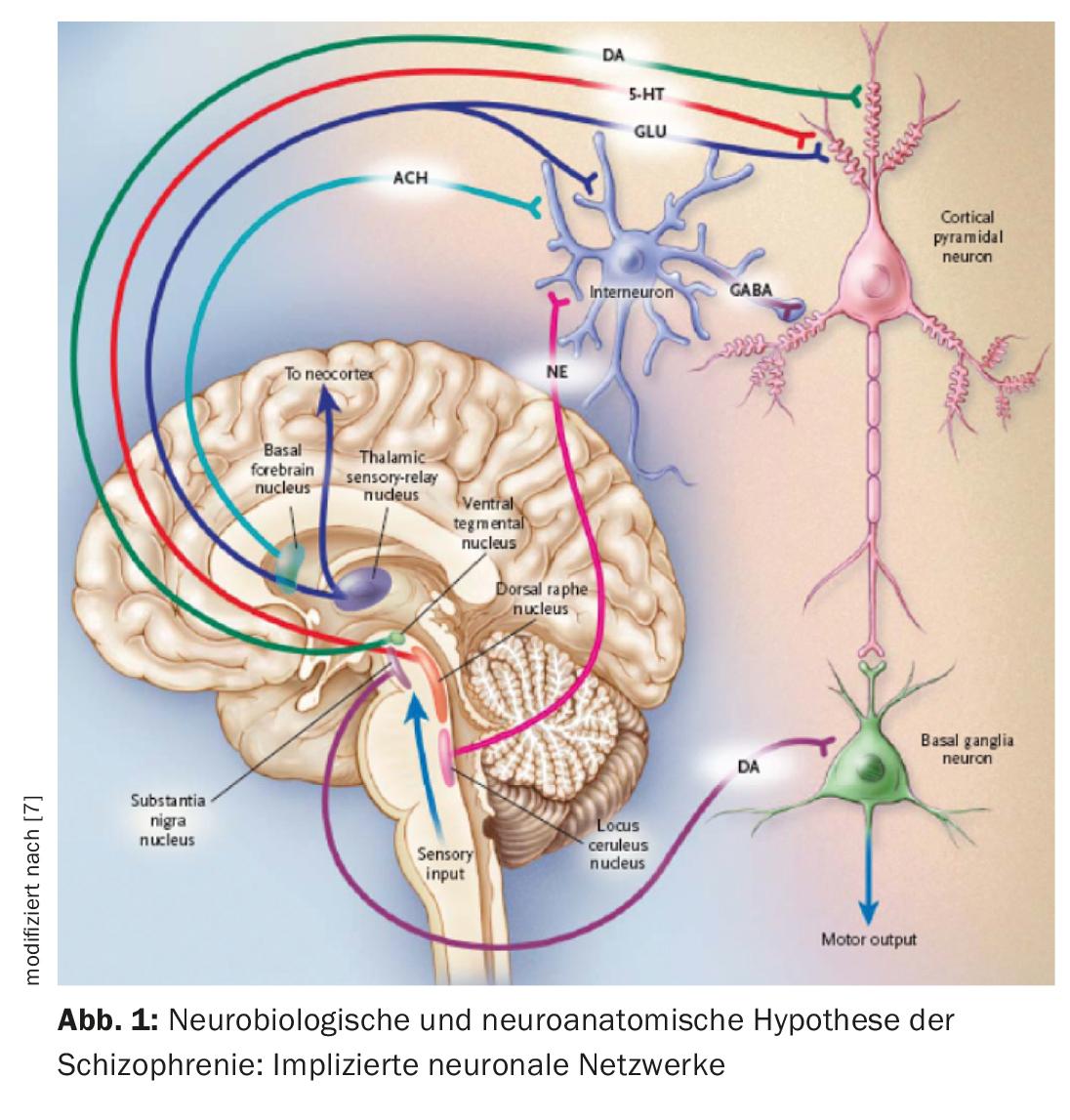
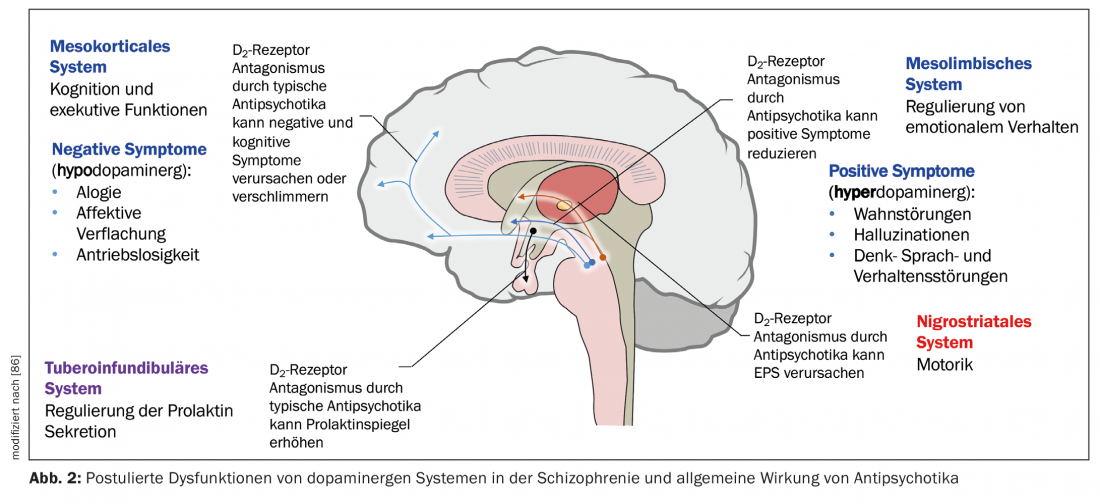
Uma hipótese neurobiológica de esquizofrenia baseia-se no pressuposto de que o tálamo já não cumpre o seu papel de órgão filtrante dos estímulos externos (Fig. 1) [7]. A informação sensorial é conduzida desde os núcleos talâmicos até aos neurónios piramidais no córtex límbico e neocórtex através de aferentes estimulantes glutamatérficos. Uma resposta excessiva de neurónios piramidais poderia ser o mecanismo responsável pela psicose, em linha com a hiperestimulação observada em doentes esquizofrénicos. Diferentes núcleos subcorticais facilitam a resposta dos neurónios. A disfunção de vários neurotransmissores, tais como glutamato, dopamina (DA), GABA, serotonina (5-HT) e noradrenalina é postulada em relação à etiopatogénese da esquizofrenia [7,8]. É possível que o sistema glutamatégico seja principalmente afectado, mas as drogas que inibem selectivamente a neurotransmissão glutamatégica e que se têm revelado úteis no tratamento da psicose ainda se encontram na fase de desenvolvimento [9]. Agora, todos os antipsicóticos actualmente disponíveis têm um mecanismo dopaminérgico, mas nem todos são serotonérgicos. O DA da área tegmental ventral activa os receptores D1 e D2, que aumentam a resposta neuronal ao glutamato. A serotonina do núcleo do ráquis dorsal activa os receptores 5-HT2A, o que facilita a libertação de glutamato dos terminais nervosos. Indirectamente, a actividade glutamatérica pode ser reduzida através de um efeito em 5-HT e DA. Os antipsicóticos geralmente inibem o efeito estimulante da DA e 5-HT, de modo que também o da DA da substantia nigra nos gânglios basais, e assim causam distúrbios motores (Fig. 2). Para especificar o papel das regiões anantómicas individuais, existem agora provas de um aumento da actividade dopaminérgica na área mesolimbica. Seria responsável por sintomas positivos ou psicóticos, tais como alucinações e delírios, enquanto a actividade reduzida no sistema mesocortical com projecções para o córtex frontal seria consistente com a neurotransmissão hipodopaminérgica. Seria responsável por sintomas negativos como a apatia, anedonia, afastamento social e pobreza de pensamento (Fig. 2) [10].
Esta breve visão geral negligencia a discussão do papel dos receptores D1, D3, 5-HT1a e 5-HT2 e a sua farmacologia [11]. É agora notável que a cariprazina tem uma maior afinidade para os receptores D3 em comparação com o aripiprazol e a brexpiprazol [12,13]. A cariprazina tem uma afinidade 10 vezes maior para os receptores D3 do que para os receptores D2. Existe agora uma hipótese, baseada em modelos animais, de que os antagonistas dos receptores D3 influenciam favoravelmente a deficiência cognitiva, aumentando a transmissão dopaminérgica no córtex pré-frontal. Em termos de mecanismo, a cariprazina, por exemplo, anula uma deficiência desencadeada pelo antagonista do receptor de glutamato NMDA feniciclidina (PCP). No entanto, o antagonismo D3 por si só não é suficiente para um efeito antipsicótico. Por outro lado, recorda-se que certos antipsicóticos como a lurasidona, o amisulpride, o brexpiprazol e, em menor grau, o aripiprazol são fortes antagonistas dos receptores 5-HT7 em comparação com outros antipsicóticos, incluindo a cariprazina, também um mecanismo que se pensa poder explicar os efeitos positivos nas perturbações cognitivas [5,14,15].
Farmacologia dos agonistas receptores parciais de dopamina D2
Enquanto a maioria dos antipsicóticos são antagonistas da dopamina pura, os agonistas parciais de D2 têm em certa medida a propriedade de agir como agonistas no caso de baixa actividade de dopamina, como é assumido na esquizofrenia no sistema mesocórtico, e como antagonistas no caso de aumento da actividade de dopamina, como é o caso no sistema mesolímbico. [10]. Existem, portanto, autores que, talvez no sentido de uma estratégia de marketing, se referem ao efeito destes medicamentos como “estabilizadores do sistema dopaminérgico” (DSS) [16].
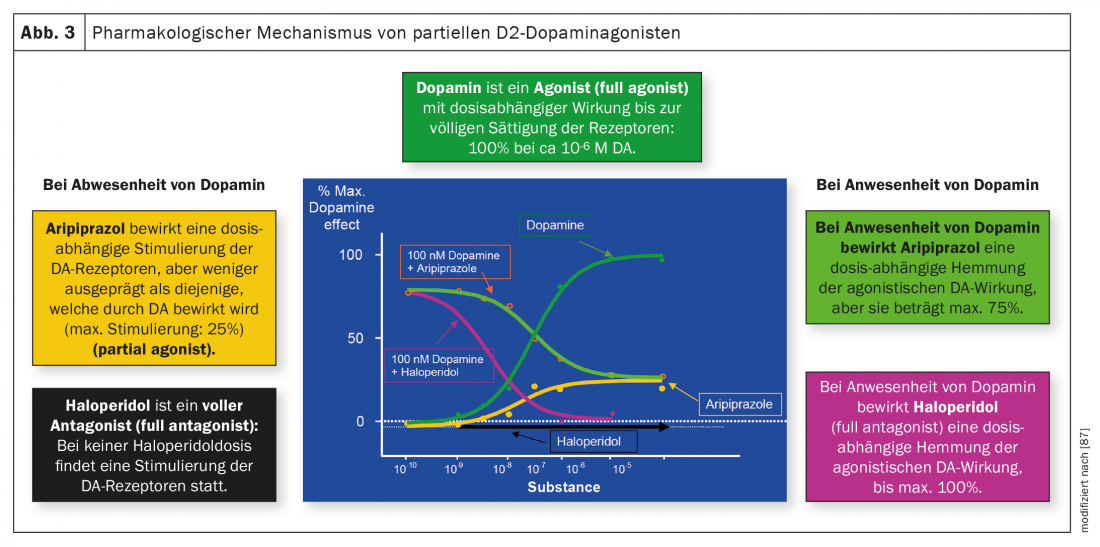
A figura 3 ilustra as diferenças entre os antagonistas e os agonistas parciais. A própria dopamina é um agonista, o clássico haloperidol antipsicótico é um antagonista sem qualquer efeito agonista nos receptores de dopamina, enquanto que o aripiprazol tem um efeito agonista nestes receptores na ausência ou baixa concentração de dopamina até um máximo de 25%. Na presença de dopamina, o haloperidol tem também um efeito puramente antagónico graças à sua maior afinidade com estes receptores, enquanto a actividade do aripiprazole é antagónica a uma inibição máxima de 75%. Brexpiprazole e cariprazina têm um efeito semelhante ao do aripiprazole. Como mencionado acima, a cariprazina difere dos seus dois outros antipsicóticos relacionados na sua afinidade particularmente pronunciada com o receptor D3 e na sua actividade agonista parcial neste receptor, o que também poderia explicar um efeito sobre os sintomas negativos e o défice cognitivo.
A hipótese noradrenalina da esquizofrenia: aspectos farmacológicos
Embora aripiprazole, brexpiprazole e cariprazina partilhem a propriedade de serem agonistas parciais de D2, o seu efeito no sistema noradrenérgico é diferente. A primeira questão é se existem provas da sua disfunção nas perturbações esquizofrénicas e se o efeito terapêutico dos antipsicóticos pode ser explicado através deste sistema neurotransmissor. Assume-se que a hiperactividade do sistema noradrenérgico em vez do sistema dopaminérgico desempenha um papel no desenvolvimento de sintomas positivos, enquanto que a hipoactividade do sistema noradrenérgico é decisiva para os sintomas negativos [17]. Recentemente, um grupo de autores formulou extensivamente a hipótese de que a fenomenologia da esquizofrenia, em particular os sintomas cognitivos, é explicada por uma interacção anormal entre a susceptibilidade genética e a disfunção noradrenérgica induzida pelo stress do locus coeruleus (um núcleo de neurónios noradrenérgicos) [18]. A investigação actual sobre esquizofrenia está de facto centrada nos aspectos da genética – desenvolvimento (fase pré-natal e pós-natal, infância, adolescência, idade adulta) – stress, mas também é verdade que a hipótese noradrenérgica não é um ponto focal neste momento e não deve de modo algum ser considerada apenas isoladamente de outras hipóteses.
Agora, porém, há também descobertas farmacológicas interessantes sobre a hipótese noradrenérgica de esquizofrenia. Uma meta-análise sugere que a comedicação (“aumento”) com o α2-antagonistasmirtazapina ou mianserina melhora a eficácia dos antagonistas de D2 no tratamento da esquizofrenia, reduzindo os sintomas negativos [19]. De acordo com uma revisão de 2020, praticamente todos os antipsicóticos, incluindo aripiprazol e brexpiprazol, são antagonistas dos receptores α1-, α2a-e α2b, mas faltam dados correspondentes para a cariprazina [20]. Até à data, estas propriedades farmacológicas têm estado principalmente associadas a efeitos secundários. De facto, asenapina (em α2b-receptores) e brexpiprazole (em α2c-receptores) destacam-se como os antagonistas mais fortes. Os estudos com animais permitem a hipótese de que um bloqueio de α1-receptorescontribui para a melhoria dos sintomas positivos e de α2-receptorespara a melhoria dos sintomas negativos e cognitivos. O antagonismo α2cseria possivelmente responsável pelos efeitos procognitivos e pela melhoria da ansiedade e da depressão [21]. Estes receptores têm uma distribuição diferente no cérebro: α2-receptoresestão espalhados e são mais frequentes (90%) do que α2c-receptores(10%), que são principalmente localizados no estriato, hipocampo e córtex [22].
Metabolismo e farmacocinética do aripiprazole, brexpiprazole e cariprazina
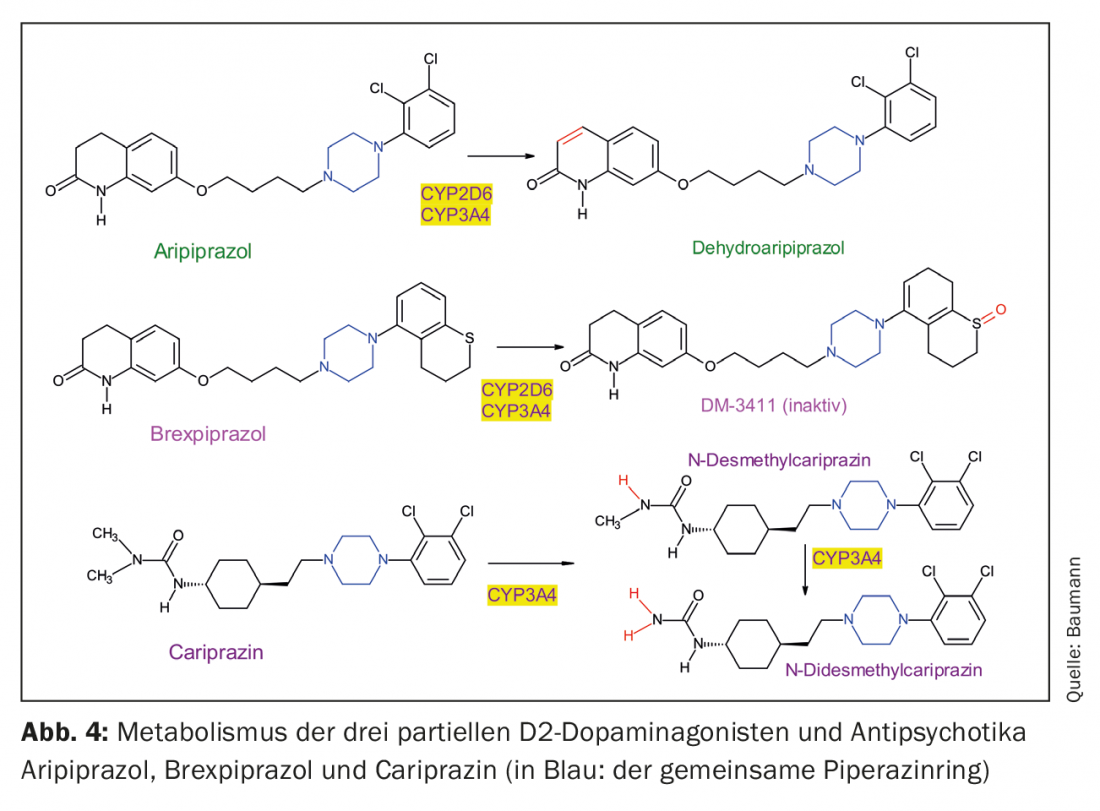
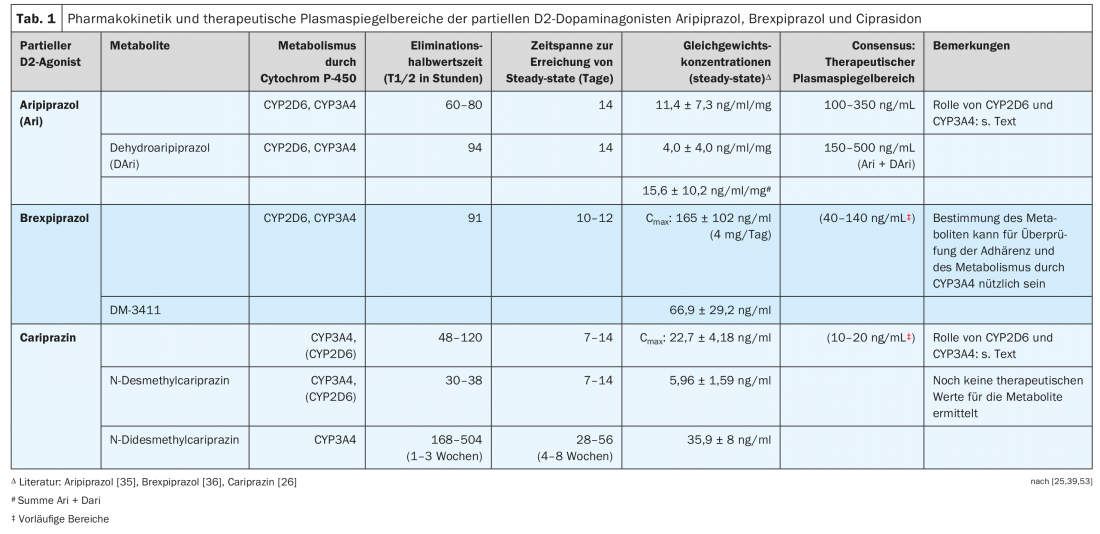
Os três agonistas parciais D2 são derivados de piperazina estruturalmente semelhantes, mas diferem no seu metabolismo (Fig. 4, Tab. 1). Note-se que a cariprazina é o isómero trans de um composto químico, sendo o isómero cis farmacologicamente menos activo [23]. Tanto aripiprazole como brexpiprazole não têm uma estrutura que resulte em tal isomerismo cis-trans.
O aripiprazol é desidratado a desidroariprazol, que exerce uma actividade farmacológica semelhante à sua substância-mãe. O Brexpiprazole é sulfoxidado pelo CYP2D6 ao metabolito (DM-3411) [24], que, no entanto, é farmacologicamente significativamente menos activo do que a substância parental e também não entra no cérebro [24]. Isto não era necessariamente de esperar uma vez que, por exemplo, o metabolito sulfóxido de tioridazina, mesoridazina, estava também no mercado como um antipsicótico. A biotransformação da cariprazina é mais complicada, porque embora a desmetilcariprazina farmacologicamente activa seja formada através de uma primeira desmetilação de N, as suas concentrações de equilíbrio no sangue dos doentes tratados com cariprazina são significativamente mais baixas do que as da substância parental e do próximo metabolito, também um produto de N-demetilação: trata-se da N-didesmetilcariprazina farmacologicamente activa, cujas concentrações em estado estável excedem as da cariprazina devido à sua semi-vida de eliminação particularmente longa. (Tab. 1) [25, 26].
Uma vez que até à data quase não existem publicações sobre o significado clínico do polimorfismo genético do CYP2D6 no tratamento de doentes com brexpiprazole (ou cariprazina), o tópico será apenas brevemente abordado aqui. Não só o aripiprazol mas também o seu metabolito activo são substratos do CYP2D6; os seus níveis plasmáticos dependem fortemente do genótipo CYP2D6. Isto explica a recomendação em artigos de revisão e meta-análises recentes de considerar a genotipagem do CYP2D6 em pacientes tratados com aripiprazole sob certas condições. O mesmo se aplica ao brexpiprazole, também um substrato CYP2D6, mas os dados são limitados [27–30]. Por exemplo, não existem estudos farmacogenéticos publicados sobre brexpiprazole excepto um no Japão: apenas examinou metabolizadores normais (EM) e intermediários (IM) de substratos de CYP2D6, uma vez que praticamente não existem casais com uma deficiência genética de CYP2D6 (metabolizadores pobres (PM)) neste grupo de povos. Um estudo baseado num modelo farmacocinético também deve ser mencionado. Uma simulação é utilizada para comparar a farmacocinética da brexpiprazole nos chamados metabolizadores “extensivos” (normais) com a cinética em PM, calculada de acordo com o modelo teórico [31]. Estes estudos confirmam a recomendação de ajustar a dose de brexpiprazole ao genótipo CYP2D6 do paciente. Isto significa receitar apenas cerca de metade da dose habitual para pacientes com deficiência genética ou uma dose mais elevada para metabolizadores ultra-rápidos. A dose de ambos os antipsicóticos também deve ser reduzida no caso de comedicação com inibidores fortes de CYP2D6 como a fluoxetina ou a paroxetina. Para os três agonistas D2 parciais, a dose deve ser ajustada para baixo no caso de comedicação com inibidores de CYP3A4 como o cetoconazol, e aumentada se os medicamentos indutores de CYP3A4 como a carbamazepina ou certos extractos de erva de São João contendo hiperforina se destinarem a ser comedicados. A maioria dos dados só foram recolhidos para a aripiprazole [32,33]. O próprio Brexpiprazole inibe moderadamente o CYP2B6, e o CYP2C9, CYP2C19, CYP2D6 e CYP3A4 apenas de forma fraca, e o seu efeito inibidor de moléculas transportadoras como a P-glycoprotein (P-gP) é também pouco relevante clinicamente, de acordo com experiências in vitro. Brexpiprazole também não é um substrato de P-gP [34].
O quadro 1 mostra exemplos de concentrações sanguíneas de equilíbrio medidas em sujeitos ou doentes durante a administração de um dos três agonistas parciais D2 [26,35,36].
Agonistas D2 parciais como preparações de depósito e a sua farmacocinética
As preparações de antipsicóticos de depósito existem há décadas, por exemplo com decanoato de haloparidol, através da esterificação dos grupos hidroxídicos existentes das drogas com ácidos gordos longos [37–39]. São depois dissolvidos em óleo e administrados intramuscularmente ao doente como LAI (medicamento antipsicótico injectável de acção prolongada). Esta técnica já não era aplicável a produtos como a risperidona, uma vez que não têm grupo OH esterificável. Para eles, foi utilizada uma nova técnica ao injectar tais antipsicóticos encerrados em microesferas. Uma vez que nem aripiprazol, brexpiprazol ou cariprazina são compostos hidroxídicos (Fig. 1), teria de ser desenvolvido um método semelhante para eles. Até agora, existe apenas uma preparação LAI para aripiprazole no mercado, mas existem estudos com o objectivo de oferecer também brexpiprazole como um LAI [40]. Existem mesmo duas formas de depósito para o aripiprazole: o aripiprazole monohidrato foi introduzido na Suíça, enquanto nos EUA o aripiprazole lauroxil também é oferecido [41]. É o produto de uma ligação covalente de ácido láurico (ácido dodecanóico) a um átomo de azoto de aripiprazole (Fig. 4) [42]. Isto deve ser tido em conta pelo médico assistente para pacientes do estrangeiro, uma vez que as dosagens diferem para as duas preparações. Uma vez que os antipsicóticos do depósito atípico têm frequentemente o problema do ganho de peso e do IMC e da elevação da prolactina (excepção: aripiprazole) [43], seria vantajoso ter também disponíveis as IAs de brexipirazole e cariprazina [44], que têm um perfil mais favorável a este respeito, como se mostra a seguir.
Medição da ligação de agonistas D2 parciais no sistema nervoso central usando tomografia por emissão de pósitrons (PET).
Uma questão importante é saber até que ponto os antipsicóticos são activos no cérebro e até que ponto se ligam a receptores terapeuticamente importantes. Os estudos PET conseguiram primeiro demonstrar a ligação do aripiprazol aos receptores D2 e D3 no cérebro humano [45–48]. A saturação completa da ligação dos receptores centrais D2/D3 já é alcançada a uma concentração plasmática de 100-150 ng/mL de aripiprazol em doentes esquizofrénicos tratados com este antipsicótico [47], e neste estudo foi medida uma concentração média de aripiprazol plasmático de 228 ng/mL (s.d.: 142 ng/mL) em todo o grupo de doentes (n=16).
Tais estudos PET também foram publicados para cariprazina [49] e brexpiprazole [24,50,51]. Dependendo do ligante PET utilizado, não é possível distinguir entre ligação a receptores D2 ou D3. Esta técnica também não determina directamente a proporção do metabolito activo na ligação, pelo que fornece efectivamente provas da ligação da “moiety activa” (nomeadamente aripiprazol + desidroariprazol; brexpiprazol; cariprazina + N-desmethlycariprazina + N-didesmethylcariprazine). Uma vez que brexpiprazole não tem metabolitos activos, a ligação observada refere-se apenas à molécula mãe, uma vez que, além disso, o metabolito não entra no cérebro [24]. Outra limitação da técnica PET é que a respectiva proporção de antagonismo/agonismo não pode ser determinada directamente a partir dos dados recolhidos. Os estudos PET fornecem no entanto descobertas muito importantes, tais como a observação de que existe também uma curva dose-resposta para brexpiprazol entre o seu nível plasmático e a sua ligação aos receptores D2/D3 na área striatal, como já foi relatado para o aripiprazol [45]. Quatro horas após uma dose única (5 ou 6 mg) de brexpiprazole, a ligação atinge 77-78% no putamen e caudate; permanece relativamente estável até 23,5 h após administração [51]. Recorda-se que um efeito antipsicótico tem um intervalo de ligação de 60-80%, e que uma ligação mais forte aumenta o risco de efeitos secundários extrapiramidais [52], o que pode ser o caso de antagonistas D2/D3 puros em vez de agonistas D2 parciais como o aripiprazole [45]. Com uma ligação de 50% da ligação máxima (Omax: aprox. 90-95%), os níveis de plasma brexpiprazole correspondentes seriam aprox. 8 ng/mL [51]. Se os dados forem agora extrapolados para tratamento com doses múltiplas de 2 mg/dia brexpiprazole, pode esperar-se uma ligação do receptor D2/D3 de mais de 80%, o que é um pouco superior ao valor reportado noutro estudo PET [50] devido à escolha de um ligando diferente.
Estudos sobre a relação: níveis plasmáticos de agonistas D2 parciais – efeito clínico
Para o aripirazole em particular, existem vários estudos sobre a relação entre os seus níveis plasmáticos e o seu efeito clínico em doentes esquizofrénicos. As directrizes de consenso do grupo AGNP-TDM (Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie) [53] e as publicadas com a Sociedade Americana de Psicofarmacologia Clínica [54] recomendam gamas de níveis plasmáticos, que são mostradas no Quadro 1 . As gamas de nível de plasma dadas para brexpiprazole e cariprazina devem ser consideradas provisórias devido à insuficiência de dados. Os intervalos dados para a cariprazina não especificam se também incluem os metabolitos.
Estudos recentes de eficácia clínica sobre aripiprazole, brexpiprazole e cariprazina
Nos últimos dois anos foram publicadas várias análises sobre as propriedades clínicas de brexpiprazole [55] e cariprazina [56,57]. Uma vez que actualmente não existem estudos comparativos directos entre os três agonistas D2 parciais, os estudos de rede devem ser utilizados para comparações indirectas [6,58]. Uma meta-análise da eficácia clínica de 32 antipsicóticos orais revelou que praticamente todos estes medicamentos eram significativamente mais benéficos do que placebo [58], incluindo aripiprazol, brexpiprazol e cariprazina. Isto dizia respeito à pontuação total, bem como aos sintomas positivos, negativos e depressivos. A apresentação dos dados sugere no entanto que brexpiprazole difere menos do que aripiprazole e cariprazina do placebo. Os autores justificam isto com a observação de que, ao longo das décadas, o efeito placebo em tais estudos comparativos tem aumentado constantemente, e isto foi particularmente evidente com o mais recente agonista parcial D2. O Brexpiprazole revelou-se melhor que o placebo no “funcionamento social”, ao contrário do aripiprazole, que não diferia do placebo, enquanto que não havia dados sobre este para a cariprazina. Comparando os dados sobre a interrupção do tratamento, aripiprazole e brexpiprazole tiveram melhor desempenho do que placebo, em contraste com a cariprazina. Para uma comparação mútua das propriedades clínicas destes antipsicóticos directos, seriam agora necessários estudos comparativos directos, mas até agora estes existem apenas de forma limitada [59,60], nomeadamente apenas como um estudo aberto e exploratório de 6 semanas entre a aripiprazole e brexpiprazole [61].
No entanto, um estudo com cariprazina tinha atraído grande atenção ao mostrar que tinha um desempenho significativamente melhor que o da risperidona no tratamento de sintomas negativos em doentes esquizofrénicos com sintomas negativos predominantes [62,63]. Infelizmente, este estudo ainda não foi replicado para confirmar esta importante descoberta. Numa interessante meta-análise, que também incluiu outros antipsicóticos, verificou-se que as doses diárias ideais para o tratamento dos sintomas negativos e positivos diferiam entre os medicamentos: Aripiprazole (11,9 mg [für die negative Symptomatik], 11 mg [für die positive Symptomatik]). As doses correspondentes para brexpiprazole são: (2,1 mg e 4 mg respectivamente); para cariprazina: (4 mg e 6,51 mg respectivamente): A rigor, estas são as doses de ED95 (dose efectiva 95%) com as quais os respectivos sintomas são reduzidos ao máximo [64]. Num estudo semelhante, o ED95 também foi calculado, ou seja, a redução de 95% dos sintomas positivos medidos com a escala PANSS ou BPRS em comparação com placebo. [65]É 11,5 mg/dia (dose equivalente a 1 mg/dia de risperidona: 1,8 mg/dia) para aripiprazol, 3,36 mg/dia (0,54 mg/dia) para a brexpiprazol, e 7,6 mg/dia para a cariprazina. A curva dose-resposta para brexpiprazole e cariprazina mostra um planalto em doses mais elevadas, e uma curva em forma de sino para aripiprazole, o que significa que doses mais elevadas não prometem qualquer efeito adicional.
Reacções adversas aos medicamentos (ADRs)
Com poucas excepções, os antipsicóticos ainda hoje em uso não diferem significativamente na sua eficácia clínica nas doenças esquizofrénicas [58]. A situação é diferente com os seus perfis de efeitos secundários, tal como apresentados em três notáveis revisões ou meta-análises de rede [58,6,25] (Tab. 2), bem como noutras publicações [20,66,67]. Muitas ADRs de antipsicóticos mostram uma dependência de dose de acordo com a literatura, como foi documentado para o aripiprazole mas ainda não para o brexpiprazole e a cariprazina [68].
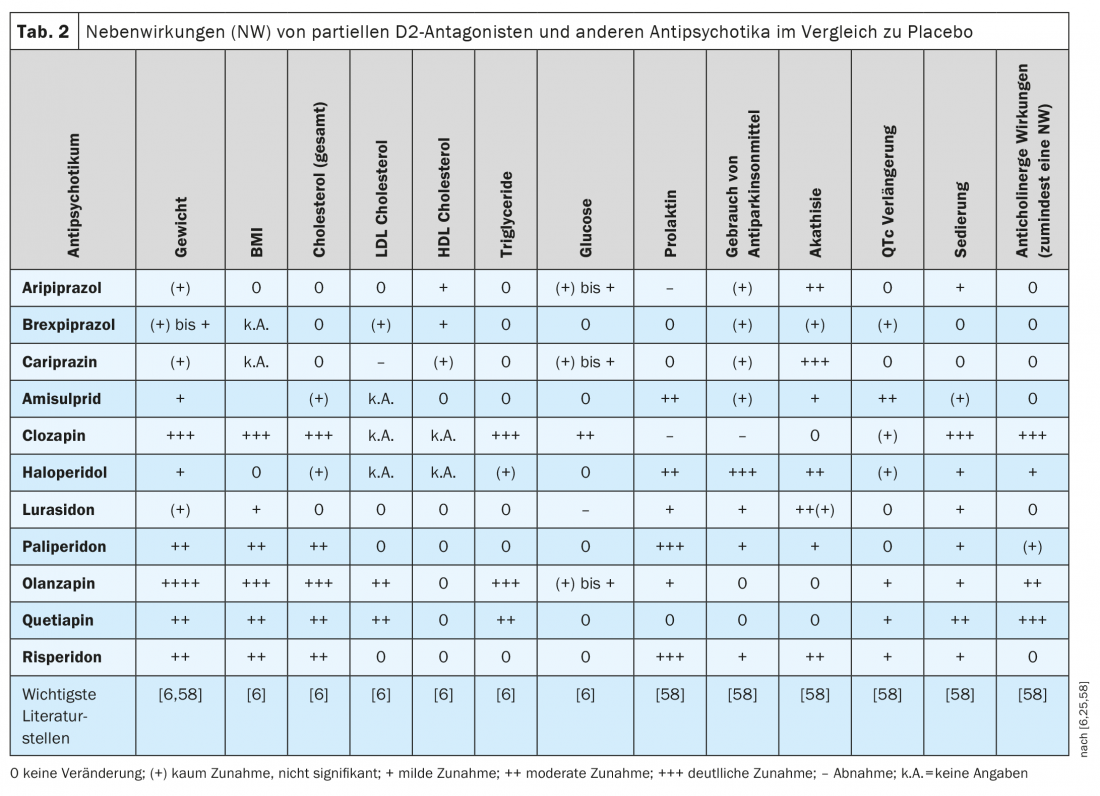
No estudo comparativo directo entre brexpiprazole e aripiprazole citado anteriormente, a akathisia ocorreu menos frequentemente sob brexpiprazole (9,4%) do que sob aripiprazole (21,2%), mas não houve diferença significativa entre os dois inibidores parciais de D2 no efeito clínico [61], nem nos níveis de prolactina medidos. Contudo, muitos pacientes experimentaram um ganho de peso clinicamente significativo(≥7%) após 6 semanas de farmacoterapia tanto no grupo brexpiprazole (35% dos pacientes) como no grupo aripiprazole (19%): uma descoberta que foi confirmada numa análise de rede [60] mas que parece bastante elevada de acordo com outras análises [59,69]. Como mostra o Quadro 2 , baseado na literatura, os três agonistas D2 parciais têm um desempenho bastante bom em comparação com muitos outros antipsicóticos em termos de ganho ou aumento de peso no IMC. Pode haver ganho de peso em alguns pacientes e perda de peso em outros, mas isto reflecte apenas a largura do intervalo de confiança não mostrado aqui (principalmente IC: 95%), que é expresso em maior ou menor grau em tais cálculos estatísticos de fármaco para fármaco. O aripiprazol tende a ter um desempenho ligeiramente melhor que o brexpiprazol e a cariprazina [6,25,58], e um estudo retrospectivo recente mostrou que o peso corporal e o IMC aumentaram significativamente nos doentes tratados com brexpiprazol mas não com cariprazina [70]. Em comparação com vários outros antipsicóticos de segunda geração, a dislipidemia ocorre menos frequentemente com os três agonistas D2 parciais (Tab. 2).
Referindo-se novamente ao estudo comparativo [61], o ECG mostrou quase nenhuma alteração em média, e se assim foi, alterações clinicamente irrelevantes sob aripiprazole e brexpiprazole. Tais medições são contudo apropriadas, uma vez que num paciente em brexpiprazole o valor QTcF aumentou (399 ms antes do tratamento; 442 ms quando foi descontinuado). O tratamento também teve de ser interrompido num paciente em aripiprazole devido a alterações no ECG. Outros estudos comparativos directos seriam necessários para mostrar diferenças claras entre estes agonistas parciais de D2.
Em comparação com outros antipsicóticos com forte antagonismo D2, os antagonistas parciais D2 não aumentam o prolactina no sangue (Tab. 2) . Com aripiprazole, como com a clozapina, ocasionalmente até se pode observar uma diminuição dos níveis de prolactina em comparação com o placebo. O aripiprazol é, portanto, considerado a primeira opção para reduzir os níveis elevados de prolactina plasmática em doentes esquizofrénicos [71]. Um estudo farmacocinético mostrou correlações negativas significativas entre os níveis de prolactina e as concentrações plasmáticas de aripiprazol e a soma de aripiprazol e desidro-ariprazol em doentes esquizofrénicos tratados com aripiprazol. A hipoprolactinemia (<8 ng/mL) ocorreu em vários doentes, embora as possíveis consequências clínicas não sejam claras (disfunção eréctil, diminuição da produção de leite, sintomas de ansiedade) [72]. Por outro lado, os doentes sob a aripiprazina ou cariprazina sofrem mais frequentemente de acatisia do que sob brexpiprazol (Tab. 2).
Um “aumento” de uma terapia antidepressiva com o máximo. 2 mg/dia brexpiprazole em doentes deprimidos [73] que não respondem à monoterapia com antidepressivos é uma opção terapêutica interessante [74]. Contudo, a polimedicação também comporta riscos, como descrito num relatório de um doente que desenvolveu hipomania após 1 semana de comedicação com brexpiprazole depois de o doente deprimido ter respondido inadequadamente ao tratamento combinado com mirtazapina e duloxetina. Surpreendentemente, após a brexpiprazole ter sido parada, este efeito secundário desapareceu [75]. Esta observação estaria mais ou menos de acordo com os resultados de 2 estudos que não mostram nenhum benefício de brexpiprazole em comparação com placebo no tratamento da mania bipolar [76].
Perguntas clínicas especiais
Discinesias tardívias: Uma meta-análise recente de estudos sobre EPS em doentes psiquiátricos tratados com antipsicóticos encontrou uma elevada prevalência de efeitos secundários motores: EPS: 20%; akathisia: 11%; discinesias tardívias: 7% [77]. O mesmo grupo de autores relatou uma incidência anual de discinesia tardive de 0,68-6,5%. Ocorreram em cerca de 15-30% dos doentes cronicamente tratados com antipsicóticos [78]. Actualmente, os antipsicóticos podem ser prescritos com mais frequência, não só para doenças esquizofrénicas, mas também para doenças bipolares e como medicação adjuvante para psicoses afectivas. A questão é, portanto, urgente até que ponto os medicamentos modernos, tais como os antipsicóticos parciais de D2 agonistas, podem causar discinesia tardive. A questão da discinesia tardive também é actual desde que foram introduzidas a dutetrabenazina e a valbenazina com a indicação de discinesia tardive nos EUA, mas ainda não na Suíça [79]. O aripiprazol causa menos discinesia tardive que o haloperidol, de acordo com um estudo mais antigo [80]. Uma revisão de 2018 descreveu a ocorrência destas ADR após tratamento com aripiprazol, mas possivelmente devido à sua recente introdução, ainda não foram comunicados casos deste tipo após tratamento com brexpiprazol ou casos de cariprazina [81].
Agonistas parciais de D2 em doentes psicogeriátricos: Os antipsicóticos geralmente levam um aviso para a sua utilização em doentes psicogeriátricos que sofrem de psicose associada à demência. O risco de mortalidade é aumentado para pacientes tratados com antipsicóticos atípicos (incluindo aripiprazol) em comparação com placebo, ou seja, como resultado de reacções cardiovasculares (por exemplo, insuficiência cardíaca, morte cardíaca súbita), infecciosas (por exemplo, pneumonia) ou adversas cerebrovasculares. No entanto, existem também estudos sobre o efeito de agonistas D2 parciais em doentes agitados diagnosticados com a doença de Alzheimer. Por exemplo, dois ensaios de 12 semanas controlados por placebo demonstraram recentemente uma eficácia satisfatória e uma tolerância relativamente boa de 2 mg/dia de brexpiprazole em doentes agitados com Alzheimer, em que o sintoma alvo era a agitação [82]. O sucesso deste estudo motivou então os fabricantes de brexpiprazole a realizar mais estudos. Uma revisão recentemente publicada de inovações farmacoterapêuticas em doentes psicogeriátricos citou este estudo nesta área [82], mas nenhum se refere ao aripiprazol ou à cariprazina [83].
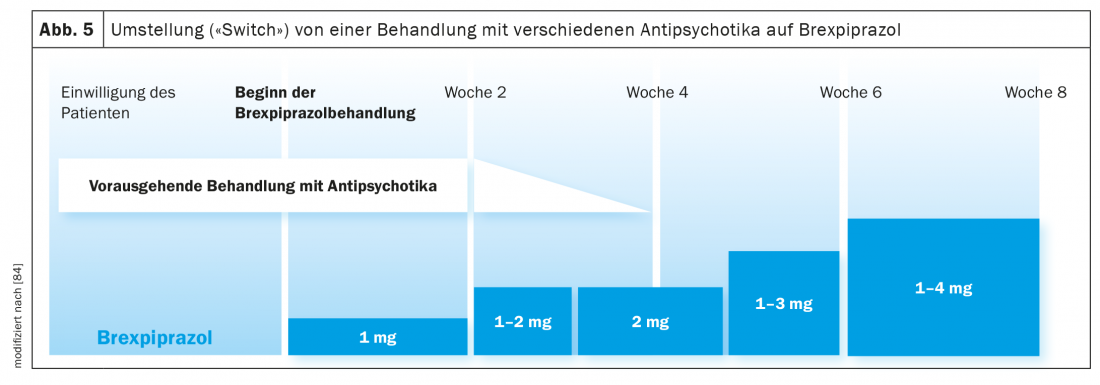
Mudança de tratamento antipsicótico para brexpiprazole: Num estudo clínico, foram investigadas as consequências da mudança de pacientes que sofrem de esquizofrenia ou psicose afectiva do tratamento com diferentes antipsicóticos para brexpiprazole (Fig. 5) [84]. A mudança foi realizada durante quatro semanas, mantendo o tratamento antipsicótico anterior durante quatro semanas. Foi lentamente eliminado no início da semana 3, e a partir da semana 4 apenas o medicamento brexpiprazole foi continuado, que tinha sido introduzido no início da semana 1 com uma dose baixa (1 mg/dia, depois 1-2 mg/dia, 4 mg/dia). (Fig. 5). A dose máxima de brexpiprazole era de 4 mg/dia (em 50% dos 200 pacientes), mas foi ajustada individualmente de acordo com os critérios CGI. Após a oitava semana do estudo, a taxa de interrupção atingiu os 17%. Como mais ou menos esperado, esta taxa foi de apenas 4,9% em doentes que passaram de aripiprazole para brexpiprazole, mas 25,4% em doentes tratados com outros antipsicóticos. Em resumo, um período de transição de 4 semanas parece ser demasiado curto, especialmente com um medicamento anterior com, por exemplo, olanzapina, que se caracteriza por propriedades anticolinérgicas. Deve também ter-se em conta que as longas semi-vidas (Tab. 1) de aripiprazole, brexpiprazole e cariprazina significam que as concentrações de equilíbrio não são alcançadas antes de 10 dias. Num outro estudo de conversão, a introdução do brexpiprazol demonstrou ter um efeito benéfico na sintomatologia de EPS pré-existente. Não só se verificou um aumento do colesterol HDL e uma diminuição do peso corporal e do IMC dos pacientes, como também uma diminuição significativa dos níveis de prolactina (a maioria dos pacientes foi pré-tratada com risperidona ou paliperidona) [85]. Este efeito benéfico do brexpiprazole também foi observado no paciente aqui descrito (descrição do caso) após a mudança do risperidone para o agonista parcial D2.
Observações finais
Comparando o perfil prático desejado de antipsicóticos apresentado por Eich e Gentsch (2019) na sua revisão relativamente à sua segurança e tolerabilidade óptimas [2], nomeadamente Sem ou pouco EPS, sem agranulocitose, sem/baixo ganho de peso, sem ou baixa sedação, sem cardiotoxicidade (sem prolongamento de QTc, sem hipotensão), sem elevação de prolactina/ sem disfunção sexual, sem/baixas interacções, os três agonistas parciais D2 aripiprazole, brexpiprazole e cariprazina satisfazem satisfatoriamente alguns destes desejos. No entanto, após cerca de 70 anos de investigação biologicamente orientada, gostaríamos de ver um “salto quântico” no desenvolvimento de medicamentos antipsicóticos eficientes. Isto provavelmente só será possível quando a investigação nos tiver proporcionado mais conhecimentos sobre as causas neurobiológicas das doenças esquizofrénicas, que poderemos então utilizar para desenvolver novas ferramentas terapêuticas.
Mensagens Take-Home
- Os três agonistas parciais da dopamina D2 aripiprazole, brexpiprazole e cariprazina mostram um efeito significativamente melhor como antipsicóticos do que placebo no tratamento medicamentoso das doenças esquizofrénicas.
- Em termos de segurança e tolerabilidade, são mais benéficos do que muitos outros antipsicóticos de primeira e segunda geração, particularmente no que diz respeito ao uso de medicamentos antiparkinsonianos, bem como ao aumento do peso corporal e dos níveis de prolactina. O risco de efeitos secundários metabólicos e anticolinérgicos é baixo. Por outro lado, a ocorrência de acatisia é particularmente digna de menção durante a terapia com cariprazina e aripiprazole.
- Uma vez que o aripiprazol e o brexpiprazol são metabolizados pelo CYP2D6, mas também como a cariprazina pelo CYP3A4, o risco de interacções farmacocinéticas (inibição, indução) deve ser considerado para os três antipsicóticos.
- Dependendo do genótipo CYP2D6 do paciente, são recomendados ajustes de dose de aripiprazole ou brexpiprazole.
- Há falta de dados relativos a recomendações de monitorização terapêutica (TDM) de brexpiprazole e cariprazina.
Literatura:
- McCutcheon RA, Reis Marques T, Howes OD: Esquizofrenia – Uma visão geral. JAMA psychiatry 2020;77(2): 201-210.
- Eich P, Gentsch K: Similitudes e diferenças dos agonistas parciais da dopamina. InFo NEUROLOGIA & PSYCHIATRY 2019; 17(6): 16-21.
- Barnes TR, Drake R, Paton C, et al: Evidence-based guidelines for the pharmacological treatment of schizophrenia: Updated recommendations from the British Association for Psychopharmacology. J Psicofarmacol. 2020;34(1): 3-78.
- Sakurai H, Yasui-Furukori N, Suzuki T, et al: Tratamento Farmacológico da Esquizofrenia: Consenso de Peritos Japoneses. Farmacopsiquiatria. 2021;54(2): 60-67.
- Frankel JS, Schwartz TL: Brexpiprazole e cariprazina: distinguindo dois novos antipsicóticos atípicos do estabilizador dopaminérgico original aripiprazole. Ther Adv Psychopharmacol. 2017;7(1): 29-41.
- Pillinger T, McCutcheon RA, Vano L, et al: efeitos comparativos de 18 antipsicóticos sobre a função metabólica em doentes com esquizofrenia, preditores de desregulação metabólica, e associação com psicopatologia: uma revisão sistemática e meta-análise de rede. A Lancet Psychiatry. 2020;7(1): 64-77.
- Freedman R: Esquizofrenia. New England Journal of Medicine. 2003; 349: 1738-1749.
- McCutcheon RA, Krystal JH, Howes OD: Dopamina e glutamato na esquizofrenia: biologia, sintomas e tratamento. Psiquiatria Mundial. 2020; 19(1): 15-33.
- Koblan KS, Kent J, Hopkins SC, et al: Um fármaco não-D2 de ligação receptora para o tratamento da esquizofrenia. N Engl J Med. 2020;382(16): 1497-1506.
- Lieberman JA: agonistas parciais da dopamina: uma nova classe de antipsicóticos. CNSD Medicamentos. 2004;18(4): 251-267.
- Kondej M, Stepnicki P, Kaczor AA: Multi-Target Approach for Drug Discovery against Schizophrenia. Int J Mol Sci. 2018;19(10).
- Stahl SM: Drogas para psicose e humor: acções únicas nos subtipos D3, D2, e D1 receptores de dopamina. CNS Spectr. 2017; 22(5): 375-384.
- Neill JC, Grayson B, Kiss B, et al: Effects of cariprazine, a novel antipsychotic, on cognitive deficit and negative symptoms in a rodent model of schizophrenia symptomatology. Eur Neuropsicofarmacol. 2016;26(1): 3-14.
- Risbood V, Lee JR, Roche-Desilets J, Fuller MA: Lurasidone: um antipsicótico atípico para a esquizofrenia. Ann Pharmacother 2012; 46(7-8): 1033-1046.
- Harvey PD, Siu CO, Hsu J, et al: Effect of lurasidone on neurocognitive performance in patients with schizophrenia: A short-term placebo- and active-controlled study followed by a 6 months double-blind extension. Eur Neuropsicofarmacol. 2013; 23(11): 1373-1382.
- Kikuchi T, Maeda K, Suzuki M, et al: Discovery research and development history of the dopamine D2 receptor partial agonists, aripiprazole and brexpiprazole. Neuropsicofarmacol Rep. 2021;41(2): 134-143.
- Yamamoto K, Shinba T, Yoshii M: sintomas psiquiátricos de disfunção noradrenérgica: uma visão fisiopatológica. Psychiatry Clin Neurosci 2014;68(1): 1-20.
- Maki-Marttunen V, Andreassen OA, Espeseth T: O papel da norepinefrina na fisiopatologia da esquizofrenia. Neurosci Biobehav Rev. 2020;118: 298-314.
- Hecht EM, Landy DC: Antagonista do receptor Alfa-2 no tratamento da esquizofrenia; uma meta-análise. Res. Schizophr 2012; 134(2-3): 202-206.
- Siafis S, Tzachanis D, Samara M, Papazis G: Drogas Antipsicóticas: Dos Perfis de Ligação de Receptor aos Efeitos Secundários Metabólicos. Neurofarmacologia actual de 2018; 16(8): 1210-1223.
- Maletic V, Eramo A, Gwin K, Offord SJ, Duffy RA. O Papel da Norepinefrina e dos seus Receptores Alfa-Adrenérgicos na Fisiopatologia e Tratamento da Grande Desordem Depressiva e Esquizofrenia: Uma Revisão Sistemática. Psiquiatria de Frente. 2017(8): 42.
- Uys MM, Shahid M, Harvey BH: Therapeutic Potential of Selectively Targeting the alpha2C-Adrenoceptor in Cognition, Depression, and Schizophrenia-New Developments and Future Perspective. Psiquiatria de Frente 2017; 8: 144.
- Yuan R-X, Xu J-W, Song L-H, et al: Uma síntese prática e conveniente do isómero cis do primeiro anel de referência de dopamina D3 activa oralmente D3-D2 receptor agonista parcial cariprazina. Synthetic Communications 2021; 51(14): 2127-2134.
- Sasabe H, Koga T, Furukawa M, et al.: Farmacocinética e metabolismo da brexpiprazole, um novo modulador da actividade da serotonina-dopamina e o seu principal metabolito em rato, macaco e humano. Xenobiotica 2021; 51(5): 590-604.
- Keks N, Hope J, Schwartz D, et al: Tolerabilidade Comparativa da Dopamina D2/3 Receptor Agonistas Parciais para a Esquizofrenia. CNS Drugs 2020.
- Nakamura T, Kubota T, Iwakaji A, et al: Estudo farmacológico clínico da cariprazina (MP-214) em doentes com esquizofrenia (tratamento de 12 semanas). Drug Des Devel Ther 2016; 10: 327-338.
- Milosavljevic F, Bukvic N, Pavlovic Z, et al: Association of CYP2C19 and CYP2D6 Poor and Intermediate Metabolizer Status With Antidepressant and Antipsychotic Exposure: A Systematic Review and Meta-analysis. JAMA psychiatry 2021; 78(3): 270-280.
- Islão F, Homens X, Yoshida K, et al: Avanços Farmacogénicos Orientados no Tratamento Antipsicótico. Clin Pharmacol Ther 2021; 110(3): 582-588.
- Bousman CA, Bengesser SA, Aitchison KJ, et al: Revisão e Consenso sobre Testes Farmacogenómicos em Psiquiatria. Farmacopsiquiatria 2021; 54(1): 5-17.
- Carvalho Henriques B, Yang EH, et al: Como podem o Metabolismo das Drogas e a Genética do Transportador Informar a Prescrição Psicotrópica? Fronteiras em genética 2020; 11: 491895.
- Elmokadem A, Bruno CD, Housand C, Jordie EB, Chow CR, Lesko LJ, et al. Brexpiprazole Pharmacokinetics in CYP2D6 Metabolizadores pobres: Utilização de Modelação Farmacocinética de Base Fisiológica para Optimizar o Tempo para Concentrações Eficazes. J Clin Pharmacol. 2021.
- Waade RB, Christensen H, Rudberg I, et al.: Influência da comedicação nas concentrações séricas de aripiprazole e desidroariprazole. Ther Drug Monit 2009; 31(2): 233-238.
- Castberg I, Spigset O: Efeitos da comedicação nos níveis séricos do aripiprazole: provas de um serviço de monitorização de medicamentos terapêuticos de rotina. Pharmacopsychiatry 2007; 40(3): 107-110.
- Sasabe H, Koga T, Furukawa M, Matsunaga M, et al: Avaliações in vitro para interacções farmacocinéticas de um novo modulador da actividade da serotonina-dopamina, brexpiprazole. Xenobiotica 2021; 51(5): 522-535.
- Kirschbaum KM, Muller MJ, Malevani J, et al: Níveis séricos de aripiprazole e desidroariprazole, resposta clínica e efeitos secundários. World J Biol Psychiatry 2008; 9(3):212-218.
- Ishigooka J, Iwashita S, Higashi K, et al. Farmacocinética e Segurança de Brexpiprazole Após Administração de Dose Múltipla a Pacientes Japoneses com Esquizofrenia J Clin Pharmacol 2018; 58(1): 74-80.
- Correll CU, Kim E, Sliwa JK, et al: Pharmacokinetic Characteristics of Long-Acting Injectable Antipsychotics for Schizophrenia: An Overview. CNS Drugs 2021; 35(1): 39-59.
- Toja-Camba FJ, Gesto-Antelo N, Maronas O, et al: Review of Pharmacokinetics and Pharmacogenetics in Atypical Long-Acting Injectable Antipsychotics. Farmacêutico 2021; 13(7).
- Schoretsanitis G, Baumann P, Conca A, et al: Therapeutic Drug Monitoring of Long-Acting Injectable Antipsychotic Drugs. Ther Drug Monit 2021; 43(1): 79-102.
- Wu B, Wu L, He Y, et al.: Microesferas de engenharia PLGA para libertação prolongada de brexpiprazole: estudos in vitro e in vivo. Desenvolvimento de medicamentos e farmácia industrial 2021; 47(6): 1001-1010.
- Citrome L: Aripiprazole formulações injectáveis de acção prolongada para esquizofrenia: aripiprazole monohidrato e aripiprazole lauroxil. Perito Rev Clin Pharmacol 2016; 9(2): 169-186.
- Hard ML, Mills RJ, Sadler BM, et al: Aripiprazole lauroxil: Pharmacokinetic Profile of This Long-Acting Injectable Antipsychotic in Persons With Schizophrenia. J Clin Psychopharmacol 2017; 37(3): 289-295.
- Saucedo Uribe E, Carranza Navarro F, Guerrero Medrano AF, et al: Preliminary effectiveness and tolerability profiles of first versus secondd-gend-generation longacting injectable antipsychotics in schizophrenia: A systematic review and meta-analysis. J Psiquiatra Res 2020; 129: 222-233.
- de Filippis R, De Fazio P, Gaetano R, et al: Antipsicóticos actuais e emergentes de acção prolongada para o tratamento da esquizofrenia. Expert Opinião Drug Saf 2021; 20(7): 771-790.
- Yokoi F, Grunder G, Biziere K, et al.: Dopamina D2 e D3 ocupação de receptores em humanos normais tratados com o aripiprazol do medicamento antipsicótico (OPC 14597): um estudo utilizando tomografia por emissão de positrões e [11C]raclopride. Neuropsicofarmacologia 2002; 27(2): 248-259.
- Mamo D, Graff A, Mizrahi R, et al: Differential effects of aripiprazole on D(2), 5-HT(2), and 5-HT(1A) receptor occupancy in patients with schizophrenia: a triple tracer PET study.[see comment]. American Journal of Psychiatry 2007; 164(9): 1411-1417.
- Grunder G, Fellows C, Janouschek H, et al.: Brain and plasma pharmacokinetics of aripiprazole in patients with schizophrenia: an [18F]fallypride PET study. Am J Psychiatry 2008; 165(8): 988-995.
- Sparshatt A, Taylor D, Patel MX, Kapur S: Uma revisão sistemática de aripiprazole–dose, concentração plasmática, ocupação de receptores, e resposta: implicações para a monitorização de drogas terapêuticas. J Clin Psychiatry 2010; 71(11): 1447-1456.
- Girgis RR, Slifstein M, D’Souza D, et al: Ligação preferencial à dopamina D3 em relação aos receptores D2 por cariprazina em doentes com esquizofrenia utilizando PET com o ligante receptor D3/D2 [(11)C]-(+)-PHNO. Psicofarmacologia (Berl) 2016; 233 (19-20): 3503-3512.
- Girgis RR, Forbes A, Abi-Dargham A, Slifstein M: Um estudo de ocupação por tomografia de emissão positrónica de brexpiprazole a dopamina D2 e D3 e receptores de serotonina 5-HT1A e 5-HT2A, e transportadores de recaptação de serotonina em sujeitos com esquizofrenia. Neuropsicofarmacologia 2020; 45(5): 786-792.
- Wong DF, Raoufinia A, Bricmont P, et al: Um estudo de tomografia por emissão de pósitrons, de ocupação do receptor striatal D2/D3 e farmacocinética de brexpiprazole oral de dose única em participantes saudáveis. Eur J Clin Pharmacol 2021;77(5): 717-725.
- Gründer G, Carlsson A, Wong DF: Mecanismo de novos medicamentos antipsicóticos – A ocupação não é apenas um antagonismo. Archives of General Psychiatry 2003; 60: 974-977.
- Hiemke C, Bergemann N, Clement HW, et al: Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2018; 51(1/2): 9-62.
- Schoretsanitis G, Kane JM, Correll CU, et al: Blood Levels to Optimize Antipsychotic Treatment in Clinical Practice: A Joint Consensus Statement of the American Society of Clinical Psychopharmacology and the Therapeutic Drug Monitoring Task Force of the Arbeitsgemeinschaft fur Neuropsychopharmakologie und Pharmakopsychiatrie. J Clin Psychiatry 2020; 81(3).
- Frampton JE: Brexpiprazole: A Review in Schizophrenia. Drogas 2019; 79(2): 189-200.
- Mucci F, Della Vecchia A, Baroni S, Marazziti D: Cariprazina como uma opção terapêutica para a esquizofrenia: uma avaliação de drogas. Pareceres de peritos Pharmacother 2021; 22(4): 415-426.
- Laszlovszky I, Barabassy A, Nemeth G: Cariprazine, A Broad-Spectrum Antipsychotic for the Treatment of Schizophrenia: Pharmacology, Efficacy, and Safety. Adv Ther 2021; 38(7): 3652-3673.
- Huhn M, Nikolakopoulou A, Schneider-Thoma J, et al: Eficácia comparativa e tolerabilidade de 32 antipsicóticos orais para o tratamento agudo de adultos com esquizofrenia multiepisódica: uma revisão sistemática e meta-análise de rede. Lancet 2019; 394(10202): 939-951.
- Watanabe Y, Yamada S, Otsubo T, Kikuchi T: Brexpiprazole for the Treatment of Schizophrenia in Adults: An Overview of Its Clinical Efficacy and Safety and a Psychiatrist’s Perspective. Drug Des Devel Ther 2020; 14: 5559-5574.
- Kishi T, Ikuta T, Matsuda Y, et al: Aripiprazole vs. brexpiprazole para esquizofrenia aguda: uma revisão sistemática e meta-análise de rede. Psicofarmacologia (Berl) 2020; 237(5): 1459-1470.
- Citrome L, Ota A, Nagamizu K, et al: O efeito do brexpiprazol (OPC-34712) e do aripiprazol em pacientes adultos com esquizofrenia aguda: resultados de um estudo exploratório randomizado. Int Clin Psychopharmacol 2016; 31(4): 192-201.
- Nemeth G, Laszlovszky I, Czobor P, et al: Cariprazina versus monoterapia com risperidona para tratamento de sintomas negativos predominantes em doentes com esquizofrenia: um ensaio aleatório, duplo-cego e controlado. Lancet 2017; 389(10074): 1103-1113.
- Fleischhacker W, Galderisi S, Laszlovszky I, et al: The efficacy of cariprazine in negative symptoms of schizophrenia: Análises post hoc de itens individuais de PANSS e factores derivados de PANSS. Eur Psychiatry 2019; 58: 1-9.
- Sabe M, Zhao N, Crippa A, Kaiser S: Antipsicóticos para sintomas negativos e positivos de esquizofrenia: meta-análise dose-resposta de ensaios aleatórios de fase aguda controlada. NPJ Schizophr 2021; 7(1): 43.
- Leucht S, Crippa A, Siafis S, et al: Dose-Response Meta-Analysis of Antipsychotic Drugs for Acute Schizophrenia. Am J Psychiatry 2020;177(4): 342-353.
- Citrome L: Os ABC’s dos agonistas receptores de dopamina parcial – aripiprazol, brexpiprazol e cariprazina: o desafio de 15 minutos para classificar estes agentes. Int J Clin Pract 2015; 69(11): 1211-1220.
- Citrome L: Activação e Sedação dos Efeitos Adversos dos Antipsicóticos de Segunda Geração no Tratamento da Esquizofrenia e da Grande Desordem Depressiva: Aumento do Risco Absoluto e Número Necessário para Prejudicar. J Clin Psychopharmacol. 2017; 37(2): 138-147.
- Yoshida K, Takeuchi H: Dose-dependent effects of antipsychotics on efficacy and adverse effects in schizophrenia. Behav Brain Res 2021; 402: 113098.
- Huhn M, Nikolakopoulou A, Schneider-Thoma J, et al: Eficácia comparativa e tolerabilidade de 32 antipsicóticos orais para o tratamento agudo de adultos com esquizofrenia multiepisódica: uma revisão sistemática e meta-análise de rede. Lancet 2019.
- Greger J, Aladeen T, Lewandowski E, et al: Comparação das Características Metabólicas dos Antipsicóticos de Nova Segunda Geração: Brexpiprazole, Lurasidone, Asenapine, Cariprazine, e Iloperidone com Olanzapine como Comparador. J Clin Psychopharmacol 2021; 41(1): 5-12.
- Labad J, Montalvo I, Gonzalez-Rodriguez A, et al: Estratégias de tratamento farmacológico para baixar a prolactina em pessoas com distúrbio psicótico e hiperprolactinaemia: Uma revisão sistemática e meta-análise. Schizophr Res 2020; 222: 88-96.
- Tasaki M, Yasui-Furukori N, Kubo K, et al: Relação das Concentrações de Prolactin com as Concentrações de Plasma de Aripiprazole em Estado Estacionário em Pacientes com Esquizofrenia. Ther Drug Monit 2021; 43(4): 589-592.
- Thase ME, Zhang P, Weiss C, et al: Eficácia e segurança do brexpiprazole como tratamento adjuvante em grandes desordens depressivas: visão geral de quatro estudos de curto prazo. Expert Opinion Pharmacother 2019; 20(15): 1907-1916.
- Kishi T, Sakuma K, Nomura I, et al: Brexpiprazole como Tratamento Adjuvante para a Grande Desordem Depressiva Após Falha de Tratamento Com Pelo menos um Antidepressivo no Episódio Actual: uma Revisão Sistemática e Meta-Análise. Int J Neuropsychopharmacol 2019; 22(11): 698-709.
- Lafreniere S, Picotte F, Legare N: Hipomania num homem deprimido após a introdução da brexpiprazole: Um relato de caso. Encephale 2021;47(2): 185-186.
- Vieta E, Sachs G, Chang D, et al: Dois ensaios aleatórios, duplo-cegos, controlados por placebo e um ensaio de brexpiprazole aberto, a longo prazo, para o tratamento agudo da mania bipolar. J Psychopharmacol 2021; 35(8): 971-982.
- Ali T, Sisay M, Tariku M, et al: Antipsychotic-induced extrapyramidal side effects: A systematic review and meta-analysis of observational studies. PLoS One 2021; 16(9): e0257129.
- Ali Z, Roque A, El-Mallakh RS: Uma teoria unificadora para o mecanismo patológico da discinesia tardive. Med Hipóteses 2020; 140: 109682.
- Bashir HH, Jankovic J: Tratamento da discinesia tardive. Neurol Clin 2020; 38: 379-396.
- Amada N, Akazawa H, Ohgi Y, et al: Brexpiprazole tem um baixo risco de sensibilização dos receptores de dopamina D2 e inibe os fenómenos de ricochete relacionados com os receptores de D2 e serotonina 5-HT2A em ratos. Neuropsicofarmacol Rep 2019; 39(4): 279-288.
- Carbon M, Kane JM, Leucht S, Correll CU: risco de discinesia tardive com antipsicóticos de primeira e segunda geração em ensaios comparativos controlados aleatórios: uma meta-análise. Psiquiatria Mundial 2018; 17(3): 330-340.
- Grossberg GT, Kohegyi E, Mergel V, et al: Eficácia e Segurança do Brexpiprazole para o Tratamento da Agitação na Demência de Alzheimer: Dois ensaios de 12 semanas, Aleatorizados, Duplo-Blind, Placebo-Controlados. Am J Geriatr Psychiatry 2020; 28(4): 383-400.
- Aftab A, Lam JA, Liu F, et al: Recentes desenvolvimentos em psicofarmacologia geriátrica. Perito Rev Clin Pharmacol 2021; 14(3): 341-355.
- Ishigooka J, Usami T, Iwashita S, et al: Análise post-hoc investigando a segurança e eficácia da brexpiprazole em doentes japoneses com esquizofrenia que foram trocados de outros antipsicóticos num estudo a longo prazo (Publicação Secundária). Neuropsicofarmacol Rep. 2020;40(2): 122-129.
- Ichinose M, Miura I, Horikoshi S, et al: Effect of Switching to Brexpiprazole on Plasma Homovanillic Acid levels and Antipsychotic-Related Side Effects in Patients with Schizophrenia or Schizoaffective Disorder. Neuropsicquiatr Dis Treat 2021; 17: 1047-1053.
- Stahl SM: A psicofarmacologia essencial de Stahl: base neurocientífica e aplicação prática.4ª ed. Nova Iorque, EUA: Cambridge University Press; 2013: 626.
- Bandelow B, Meier A: Aripiprazole, um “estabilizador do sistema dopamina-serotonina” no tratamento da psicose. Jornal Alemão de Psiquiatria 2003; 6: 9-16.
InFo NEUROLOGIA & PSYCHIATRY 2021; 19(6): 12-23