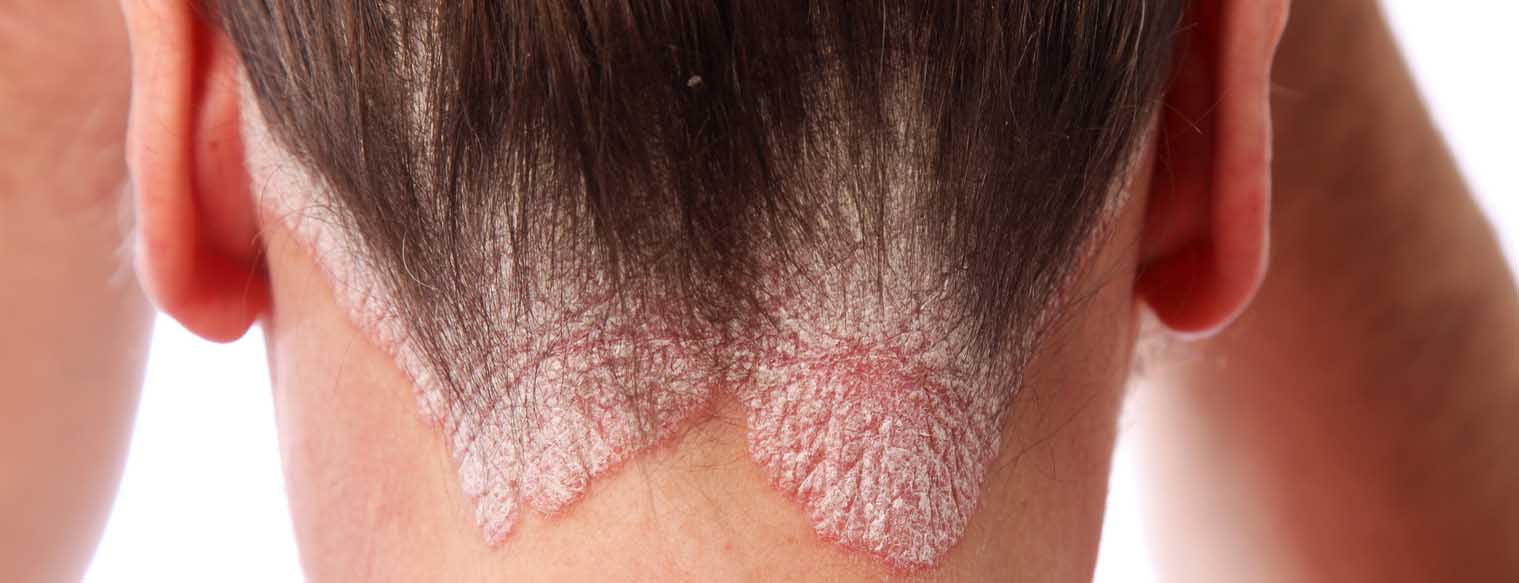
O dispositivo recentemente aprovado pelo Swissmedic permite aos portadores de psoríase auto-administrar a biologia em doses únicas. É actualmente o único inibidor de IL23 disponível na Suíça sob a forma de injector controlado pelo paciente.
A nova caneta pré-fabricada TREMFYA® [1] não é um auto-injector como com outros biólogos na terapia da psoríase de placa moderada a grave. O design inovador da caneta pré-fabricada TREMFYA® permite aos pacientes controlar eles próprios a intensidade e a pressão da sua injecção. No estudo ORION, quase 99% dos pacientes relataram uma primeira injecção bem sucedida [2]. Além disso, a caneta pré-cheia inclui um sistema de segurança para proteger a agulha após a sua utilização. Mesmo após três injecções, os pacientes do estudo continuaram a classificar como positiva a utilização da caneta TREMFYA®[2].
Manuseamento convincentemente simples
Os doentes com psoríase têm por vezes dificuldades com tratamentos auto-administrados devido a uma série de factores. No ensaio ORION fase III randomizado [2] realizado em vários centros de estudo, a avaliação subjectiva dos pacientes a este respeito foi avaliada utilizando um questionário validado (Questionário de Avaliação de Auto-injecção, SIAQ) [3]. Isto implicava avaliar as experiências dos pacientes com a caneta pré-fabricada TREMFYA® nas semanas 0, 4 e 12 numa escala de 0 (“pior”) a 10 (“melhor”), utilizando os seis critérios seguintes:
- Sensações relativas a injecções
- Auto-imagem, auto-confiança
- Dor e reacções cutâneas durante ou após a injecção
- Facilidade de utilização da unidade
- Satisfação com a auto-injecção
O valor médio para o critério “satisfação com auto-injecção” no estudo foi de 9,18 pontos (10=”muito satisfeito”) e o valor médio para “facilidade de utilização” foi de 9,24 pontos (10=”muito fácil”) [2].
Boa eficácia e segurança
No ensaio de eficácia e segurança do ORION, uma proporção significativamente maior de participantes no estudo alcançou a eliminação de IGA0 ou IGA1 (81% vs. 0%) ou uma taxa de resposta PASI 90 (76% vs. 0%) na semana 16 no grupo TREMFYA® pré-fabricado em comparação com o placebo. A proporção de participantes que conseguiram uma resposta PASI100 na semana 16 foi também significativamente mais elevada no grupo TREMFYA® pré-fabricado do que no grupo placebo (50% vs. 0%). A maioria das reacções no local de injecção com a caneta pré-fabricada TREMFYA® foram de natureza suave e transitória [2].
No Verão de 2018, TREMFYA® (guselkumab) já tinha recebido autorização de comercialização na Suíça para o tratamento de doentes adultos com psoríase de placa moderada a grave e resposta insuficiente a outras terapias sistémicas ou PUVA [1]. Guselkumab foi geralmente bem tolerado pelos doentes com psoríase durante o desenvolvimento clínico [4–6]. Mesmo durante o período de rotulagem aberta de 4 anos, não foram identificados novos sinais de segurança com a utilização deste anticorpo monoclonal totalmente humano [7].
Os factos mais importantes em resumo
- A caneta pré-fabricada TREMFA® é um injector controlado pelo paciente. É actualmente o único inibidor da IL23 na Suíça nesta forma de administração.
- No Questionário de Avaliação da Auto-injecção (SIAQ), o critério “facilidade de utilização” foi avaliado com uma média de 9,24 pontos (máximo: 10 pontos) [2].
- No ensaio ORION, uma proporção significativamente mais elevada de pacientes no grupo TREMFYA® pré-fabricado atingiu IGA1 ou IGA0 (81% vs. 0%) ou PASI90 ou PASI100 (76% vs. 0%) na 16ª semana após a linha de base, em comparação com o placebo [2].
Literatura:
- Tremfya® informação especializada, a partir de 09/2019 disponível em www.swissmedicinfo.ch.
- Ferris LK, et al: Eficácia e Segurança de Guselkumab, administrado com um novo injector controlado pelo doente (One-Press), para psoríase moderada a grave: resultados do estudo ORION fase 3. J Dermatol Treat 2019: 1-8. doi:10.1080/09546634.2019.1587145
- Keininger D, Coteur G: Avaliação da experiência de auto-injecção em pacientes com artrite reumatóide: validação psicométrica do Questionário de Avaliação de Auto-injecção (SIAQ) Saúde e Qualidade de Vida Resultados 2011; 9, Artigo número 2.
- Blauvelt A, et al: Eficácia e segurança do guselkumab, um anticorpo monoclonal anti-interleucina-23, em comparação com o adalimumab para o tratamento contínuo de doentes com psoríase moderada a grave: Resultados do ensaio VOYAGE 1, fase III, duplo-cego, placebo- e activo, controlado por comparador. J Am Acad Dermatol 2017; 76(3): 405-417.
- Reich K, et al: Eficácia e segurança do guselkumab, um anticorpo monoclonal anti-interleucina-23, em comparação com o adalimumab para o tratamento de doentes com psoríase moderada a grave com retirada aleatória e novo tratamento: Resultados do ensaio fase III, duplo-cego, placebo- e VOYAGE 2 controlado por comparador activo. J Am Acad Dermatol 2017; 76(3): 418-431.
- Langley RG, et al: Eficácia e segurança do guselkumab em doentes com psoríase que têm uma resposta inadequada ao ustekinumab: resultados do ensaio NAVIGATE fase III randomizado, duplo-cego. Br J Dermatol 2018; 178(1): 114-123.
- Griffiths CE, et al: Fall Clinical Dermatology Conference. Outubro, 2019; Las Vegas, EUA
DERMATOLOGIE PRAXIS 2020; 30(1): 37 (publicado 24.2.20, antes da impressão).