Antes de iniciar a terapia, os pacientes com GIST devem ser discutidos num quadro interdisciplinar de tumores. Para risco intermédio a elevado de recaída, a terapia imatinibular adjuvante deve ser considerada após a ressecção. Os pacientes com GIST metastásico beneficiam de inibidores de tirosina cinase e intervenções locais.
O tumor estromal gastrointestinal (GIST) é uma entidade tumoral mesenquimal do tracto gastrointestinal ou – muito mais raramente – do tecido mole intra-abdominal. As chamadas células Cajal são assumidas como sendo as células de origem. Estas células musculares especializadas estão localizadas no plexo mesentérico e têm uma função de pacemaker no que diz respeito à contracção peristáltica. Os GISTs podem ocorrer ao longo de todo o tracto gastrointestinal – mas encontram-se mais frequentemente no estômago (50%) e intestino delgado (30-35%), muito menos frequentemente no cólon/recto (5%) ou no esófago (<1%). Os GISTs que surgem no omentum, mesentério ou retroperitonealmente são chamados E-GISTs (extra-gastrointestinais) e são uma raridade.
A incidência anual de GIST é relatada na literatura como sendo de cerca de dez casos por milhão de habitantes. Se se incluir também o chamado micro-GIST (tumor de GIST <1 cm), que se encontram autopticamente em até 20% dos doentes com mais de 50 anos de idade na área da junção estomaco-esofágica, então é muito mais elevado. Contudo, os micro-GISTs têm um potencial maligno extremamente baixo e, portanto, representam um subgrupo separado, clinicamente irrelevante.
Diagnóstico e encenação
A maioria dos doentes diagnosticados com GIST são sintomáticos da doença tumoral. Classicamente, relatam hemorragias gastrointestinais, dores abdominais, náuseas, vómitos ou irregularidades nas fezes. Contudo, devido ao uso crescente de imagens no contexto de outras questões, em até 25% dos casos é detectado um GIST em pacientes completamente assintomáticos.
O diagnóstico de GIST só pode, em última análise, ser feito com base numa histologia típica. Histologicamente, uma biópsia obtida por endoscopia é claramente preferível a uma biópsia percutânea. Positividade para CD117 e DOG1 distingue um GIST de outros tumores mesenquimais ou um carcinoma ou melanoma mesenquimatoso em crescimento (Fig. 1).
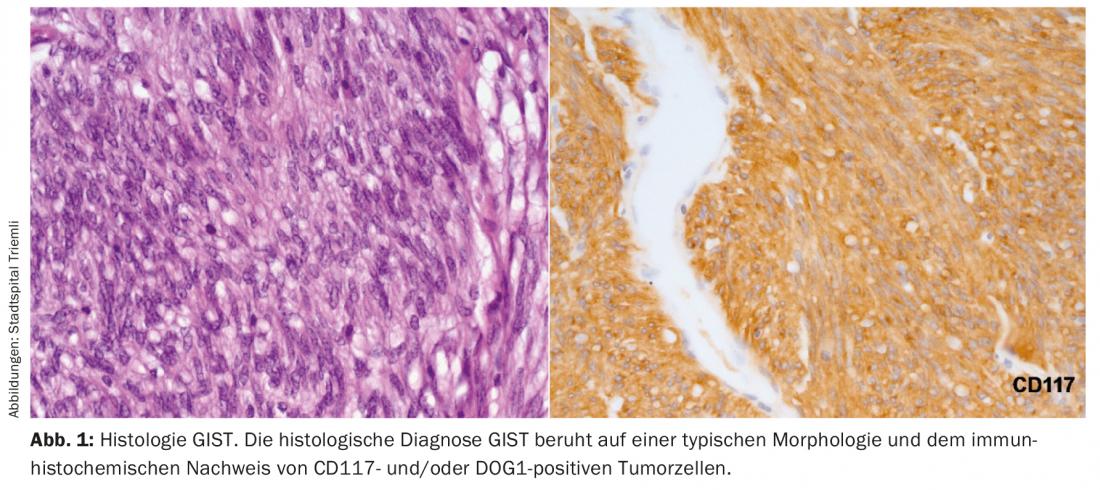
As metástases de GIST desenvolvem-se tipicamente no fígado, omentum ou peritoneu. As metástases fora do abdómen só são vistas em doenças avançadas, já intensivamente tratadas. Por conseguinte, pelo menos um abdómen/pelvis com contraste aumentado ou uma ressonância magnética do abdómen deve ser realizado como um exame inicial de estadiamento.
Patologia Molecular
75% dos pacientes com GIST têm uma mutação do gene c-Kit, tipicamente no exon 11 ou 9. A segunda alteração molecular mais comum (10%) é uma mutação no gene PDGFR. Todas estas alterações levam a uma activação contínua das células. Se nem um c-KIT nem uma mutação PDGFR podem ser detectados, fala-se de um chamado GIST do tipo selvagem, embora a sua definição esteja actualmente em curso. No entanto, as alterações são frequentemente encontradas nos genes BRAF, RAS e SDH-A-D. GIST tipo selvagem são tipicamente vistos em associação com neurofibromatose, tríade de Carney ou síndrome de Carney-Stratakis.
GIST não metástático localizado
GIST localizado não-metastático deve ser ressecado sempre que possível. A ressecção completa é a única terapia curativa.
Tumores <2 cm podem alternativamente ser monitorizados endosonograficamente e só ressecados se o tamanho progredir.
Ressecção
O principal objectivo de uma ressecção cirúrgica curativa de um GIST é conseguir uma situação R0 (sem restos de tumores macroscópicos ou microscópicos na margem da incisão). A ressecção R0 é geralmente conseguida se se mantiver uma distância de segurança de 1-2 cm do tumor. A extensão da intervenção cirúrgica depende fortemente do tamanho e da localização do GIST. Um GIST pequeno a médio no corpo do estômago pode muitas vezes ser removido com uma simples ressecção gástrica parcial laparoscópica. No entanto, se o GIST estiver localizado no duodeno, por exemplo, a extensão da ressecção pode ter de ser alargada a uma duodenopancreatectomia de Whippel. Em contraste com a maioria dos outros tumores malignos do tracto gastrointestinal (por exemplo adenocarcinoma, tumores neuroendócrinos), a ressecção de um GIST não requer a dissecção dos gânglios linfáticos locorregionais devido à raridade das metástases dos gânglios linfáticos (prevalência <1%). Apenas no GIST pediátrico raro ou em adultos jovens (<40 anos) o risco de metástases linfonodais é significativamente mais elevado (20-59%), o que pode, evidentemente, influenciar as tácticas cirúrgicas. Em princípio, uma ressecção laparoscópica visa, se possível, devido a uma recuperação mais rápida. No entanto, no decurso da ressecção, a cápsula tumoral não deve romper-se em nenhuma circunstância, pois de outra forma ocorrerá uma sementeira peritoneal de células tumorais, resultando, em regra, numa situação de tumor paliativo. Os grandes GISTs, em particular, têm frequentemente uma cápsula muito macia e frágil que pode romper-se rapidamente se manuseada de forma descuidada (laparoscopicamente). Portanto, as vantagens da ressecção laparoscópica devem ser sempre bem ponderadas contra os riscos de ruptura do tumor no decurso de uma “laparoscopia acrobática de ponta”, especialmente no caso de grandes tumores.
Terapia adjuvante
Apesar da ressecção R0 bem sucedida, os pacientes podem desenvolver metástases ao longo do tempo. O risco de desenvolver metástases depende principalmente do índice mitótico, tamanho do tumor e localização no tracto gastrointestinal – estes factores são registados no chamado índice de Miettinen (Tab. 1) [1]. As tabelas de recaídas desenvolvidas por Heikki Joensuu [2] são mais bem classificadas e, portanto, reflectem melhor o risco individual de recaída. Todos os estudos que investigaram o benefício da terapia adjuvante utilizaram o inibidor da tirosina quinase (TKI) imatinib. Os critérios de inclusão, bem como a duração da terapia, variaram de estudo para estudo. Com base nos dados do ensaio SSGXVIII/AIO [3], que mostrou um benefício de sobrevivência de três anos versus um ano de terapia imatinibular, recomenda-se actualmente uma duração terapêutica de três anos. Se uma duração terapêutica mais longa (um total de cinco ou seis anos) faz ou não sentido, está hoje em dia a ser investigada em estudos. Embora o ensaio SSGXVIII/AIO apenas incluísse pacientes com critérios de “alto risco” – com base no consenso modificado da NIH aplicado na altura – hoje em dia são oferecidos aos pacientes com um risco moderado a elevado de recaída terapêutica adjuvante de acordo com Miettinen. Especialmente em doentes com risco moderado, é importante comparar os benefícios com os efeitos secundários (tais como mucosite, cãibras musculares, náuseas) numa discussão. Em contraste com os estudos, recomenda-se agora uma análise de mutação no início da terapia. Se uma mutação imatinibial, por exemplo PDGFR D842V, estiver presente, uma terapia tão cara e também tão onerosa não faz sentido. Se os pacientes com uma mutação exon 9 também beneficiam de uma dose de imatinibe mais elevada (800 mg/d) num cenário adjuvante, em analogia com os dados do cenário paliativo, não é actualmente claro. Contudo, a experiência demonstrou que uma dose de 800 mg/d não pode ser continuada durante um período de tempo mais longo devido à toxicidade associada.
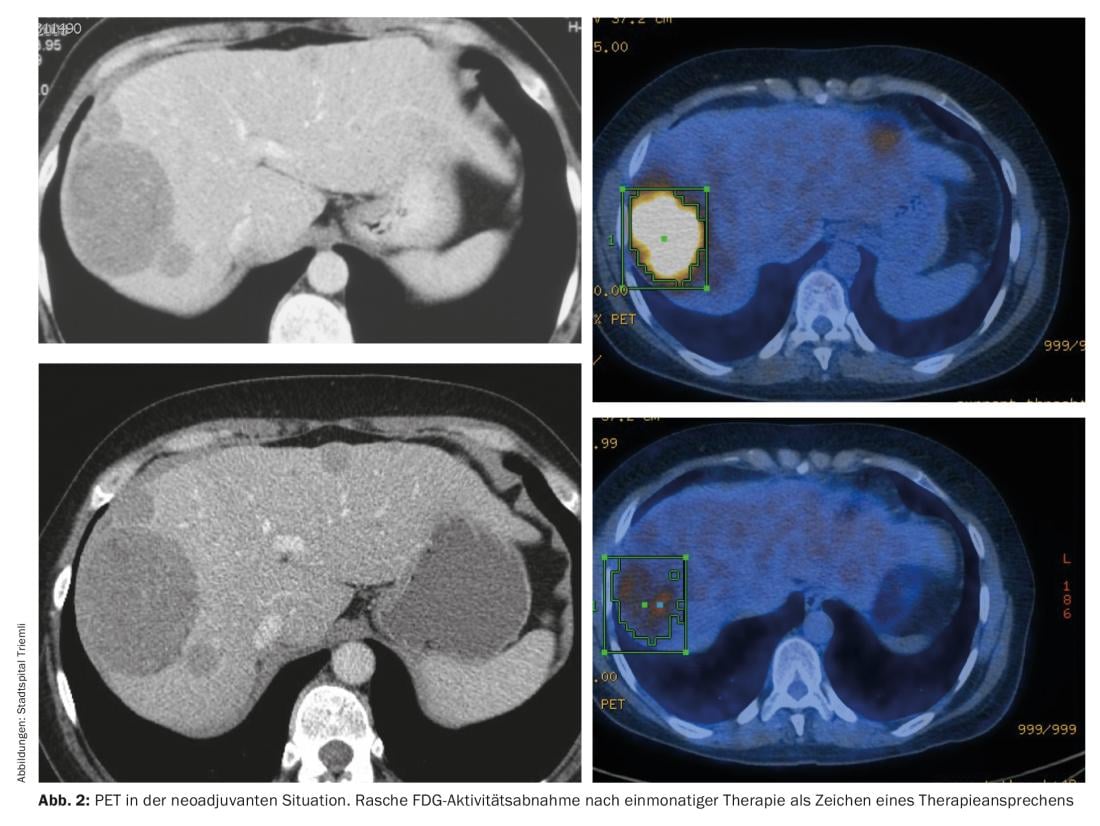
Terapia neoadjuvante
Para tumores localmente avançados, a opção de terapia neoadjuvante deve ser sempre discutida no conselho interdisciplinar de tumores – especialmente se a cirurgia mutilante for necessária para uma ressecção completa. Os pré-requisitos para a terapia neoadjuvante são um diagnóstico histologicamente verificado de GIST e a presença de uma mutação imatinib-sensível. Recomenda-se a realização de imagens de proximidade para evitar uma progressão indesejada. Usando PET, uma declaração relativa à resposta pode ser feita logo um mês após o início da terapia (Fig. 2).
A duração óptima da terapia neoadjuvante não é clara, mas a maioria da literatura declara seis a nove meses [4].
Pós-tratamento
Após a cirurgia, bem como durante e após a terapia adjuvante, são recomendados exames clínicos e imagiológicos regulares. Infelizmente, não existe um esquema de acompanhamento baseado em provas. Durante os primeiros dois anos após a cirurgia ou após a interrupção da terapia adjuvante, realizamos imagens abdominais a cada três a seis meses – em momentos de menor risco de recaída (durante a terapia adjuvante em curso; três a cinco anos após a cirurgia ou após a interrupção da terapia imatinibular) apenas a cada seis a doze meses. Devido à imagem em série e à exposição à radiação associada, uma ressonância magnética é preferível a uma TC, especialmente em pacientes jovens.
GIST metástático, não regenerável
Terapia medicamentosa: Graças à utilização de TKIs, o prognóstico dos pacientes com GIST metastásico melhorou significativamente de uma média de dez para cerca de 55 meses. Se estiver presente uma mutação sensível ao imatinib, o imatinib 400 mg/d é a terapia de primeira linha de escolha. Em pacientes com uma mutação exon 9, recomenda-se uma dose de 800 mg/d, baseada principalmente nos dados meta-GIST [5]. Em caso de progressão, os TKIs sunitinib [6] e regorafenib [7], que foram investigados em ensaios da fase III, estão disponíveis. Muitas vezes, os pacientes ainda se encontram em bom estado geral após terem passado pelas três linhas de terapia estabelecidas (imatinibe, sunitinibe, regorafenibe), pelo que se gostaria de lhes oferecer uma terapia eficaz. A menos que possam ser incluídos num julgamento, um rechaço com imatinib faz certamente sentido, embora o benefício do PFS tenha sido muito limitado em comparação com o placebo no julgamento RIGHT. Mecanisticamente, assume-se que os clones imatinib sensíveis que eram resistentes às terapias TKI anteriores ganharam a vantagem. Embora este efeito só tenha sido estudado para o imatinibe, pode provavelmente ser extrapolado para as outras TKIs.
Outros TKIs como o pazopanibe [8] ou o ponatinibe [9] só foram comparados em ensaios da fase II com “melhores cuidados de apoio”. Conduziram a um prolongamento significativo mas infelizmente muito limitado do PFS. Em primeiro lugar, estabilizaram a doença. Uma resposta clara, no sentido de uma resposta parcial ou completa, infelizmente só raramente foi vista. Os investigadores estão portanto a depositar as suas esperanças noutras substâncias tais como o cabozantinibe ou o inibidor do ponto de controlo nivolumab.
Uma abordagem de estudo completamente diferente mas muito interessante é tratar pacientes de GIST com citostáticos convencionais como a doxorubicina ou o paclitaxel após anos de terapia TKI. A esperança é que o GIST, que costumava ser resistente à quimioterapia, tenha mudado tanto devido à longa terapia TKI, que agora é sensível à quimioterapia.
Embora os TKIs imatinib, o sunitinib e o regorafenib sejam as chamadas “terapias orientadas”, infelizmente ocorrem toxicidades relativamente consideráveis ao longo do tempo. Sob solitinibe, 20% dos pacientes desenvolveram toxicidade de grau III (principalmente fadiga, síndrome do pé de mão), sob regorafenibe mesmo até 60% (hipertensão, síndrome do pé de mão). A fim de contrariar estes efeitos secundários numa fase inicial, é necessária uma avaliação regular por um médico ou enfermeiro. Do mesmo modo, os doentes devem ser sensibilizados para o problema da conformidade com os medicamentos, bem como para as interacções.
Sempre que um paciente com doença de GIST estiver sob terapia sistémica, o comportamento terapêutico deve ser avaliado clínica e radiologicamente a intervalos regulares. Enquanto os colegas da radiologia utilizam os critérios RECIST para a avaliação terapêutica na grande maioria das entidades tumorais, os critérios Choi devem ser utilizados para os pacientes com GIST. Estes incluem também a densidade de tumores na avaliação e reflectem melhor, portanto, o comportamento biológico do GIST [10].
Terapia não-droga: Se um paciente mostrar progressão, é útil uma avaliação interdisciplinar. Isto significa que, para além das opções medicinais, as opções cirúrgicas são também plenamente utilizadas. Especialmente se houver progressão focal e desenvolvimento de resistência de metástases individuais à terapia medicamentosa, a ressecção destas metástases resistentes à terapia também deve ser discutida. A tomografia computorizada FDG-PET é uma ferramenta de diagnóstico útil para a localização da progressão focal. A ressecção destas metástases focalmente resistentes à terapia pode prevenir uma maior escalada de medicamentos em alguns pacientes. Caso contrário, a ressecção cirúrgica das metástases só é indicada em caso de complicações sintomáticas (dor, obstrução intestinal ou hemorragia gastrointestinal). Como alternativa à ressecção cirúrgica paliativa de metástases individuais, deve ser considerada a utilização de outros métodos ablativos locais, tais como radioterapia estereotáxica ou radiofrequência ou radioterapia. Ablação por micro-ondas deve ser considerada.
Mensagens Take-Home
- Os pacientes diagnosticados com GIST devem ser sempre discutidos num quadro interdisciplinar de tumores antes de iniciar a terapia.
- Para GIST com risco intermédio a elevado de recorrência, a terapia imatinibular adjuvante deve ser avaliada com o paciente após a ressecção bem sucedida.
- Os pacientes com GIST metastásico beneficiam não só dos inibidores da tirosina quinase imatinib, sunitinib e regorafenibe, que são aprovados na Suíça e estão cobertos por seguros de saúde, mas também de medidas locais tais como cirurgia, RFA ou radioterapia.
Literatura:
- Miettinen M, et al: Seminários em Patologia Diagnóstica 2006; 23: 70-83.
- Joensuu H, et al: Lancet Oncology 2012; 13: 265-274.
- Joensuu H, et al: JAMA 2012; 307(12): 1265-1272.
- Rutkowski P, et al: Ann Surg Oncol 2013; 20: 2937-2943.
- Grupo de Meta-Análise de Tumores Gastrointestinais: JCO 2010; 28: 1247-1253.
- Demetri G, et al: Lancet 2006; 368: 1329-1338.
- Demetri G, et al: Lancet 2013; 381: 295-302.
- Mir O, et al: Lancet Oncol 2016; 17: 632-641.
- Heinrich M, et al: J Clin Oncol 2015; abstracto 10535.
- Benjamin RS, et al: J Clin Oncol 2007; 25(13): 1760-1764.
InFo ONCOLOGy & HEMATOLOGy 2017; 5(3): 24-28











