A aprovação de algumas imunoterapias para EM na Suíça difere em parte consideravelmente das dos países vizinhos. Um grupo de neurologistas, com a participação da Sociedade Suíça de EM e do SNS, elaborou, portanto, recomendações no sentido de um consenso terapêutico.
De acordo com a Sociedade Internacional de EM, a esclerose múltipla afecta cerca de 10.000 pacientes na Suíça [1], embora se possa assumir, à semelhança dos dados de outros países, que há também um número mais elevado de pessoas afectadas na Suíça [2]. A incidência da doença está a aumentar [3]. Sendo uma doença inflamatória crónica desmielinizante do SNC, a maioria da EM está a recair [4]. Contudo, devido a novas opções terapêuticas, os 10-15% da EM progressiva primária (PPMS) tornaram-se recentemente o foco de interesse. Até à data, não é conhecida nenhuma terapia com uma abordagem curativa. Contudo, o panorama da terapia modificadora de cursos expandiu-se consideravelmente nos últimos anos, de modo que existem agora cerca de uma dúzia de terapias modificadoras de cursos disponíveis para reduzir a taxa de recaídas ou a progressão da incapacidade, entre outras coisas, e a actividade que pode ser detectada por ressonância magnética. Devido a diferentes mecanismos de acção, modos de aplicação e perfis de risco-benefício, está a tornar-se possível uma terapia cada vez mais individualizada. Desta forma, é possível reagir especificamente a situações actuais da vida e objectivos desejados, tais como a capacidade de andar, aspectos profissionais ou a gravidez [5].
Esta complexidade crescente requer directrizes nas quais são discutidos a indicação, potenciais benefícios, bem como os aspectos de segurança e os perfis de efeitos secundários. A maioria destas directrizes são geralmente válidas. Isto inclui, por exemplo, a recomendação de iniciar a imunoterapia logo que possível após o diagnóstico [5].
Contudo, vários aspectos tais como diferentes avaliações de risco-benefício, diferentes procedimentos de aprovação ou diferentes prioridades políticas, legais e específicas de cada país conduzem frequentemente a aprovações divergentes de terapias individuais em alguns países vizinhos [6].
Por exemplo, existem por vezes diferenças significativas em termos de aprovação (por exemplo, terapia de primeira contra segunda linha, grupos de doentes) e requisitos de segurança para imunoterapias para EM na Suíça, em comparação com o espaço europeu (Agência Europeia de Medicamentos, EMA).
Além disso, na Suíça, é necessária uma avaliação custo-benefício pelo Serviço Federal de Saúde Pública (FOPH) para a inclusão de um medicamento na lista de especialidades (SL), institucionalmente separada da autorização de comercialização. O SL enumera os preparativos que são reembolsados pelo seguro de saúde obrigatório e potenciais limitações.
Em comparação com os países vizinhos, estas condições especiais conduzem a diferenças significativas na utilização de certas preparações. As abordagens específicas na Suíça baseiam-se nestas diferentes aprovações e limitações, pelo que são necessárias considerações correspondentes específicas de cada país.
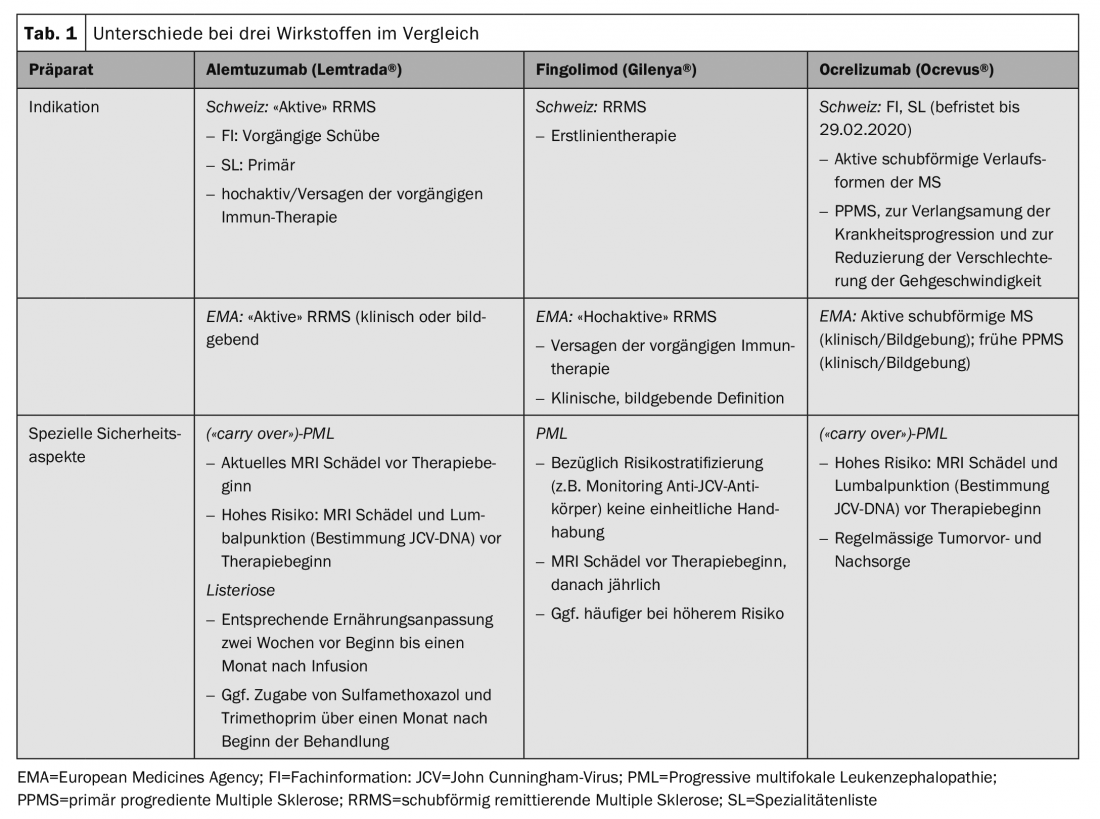
Estes aspectos específicos na Suíça, juntamente com recomendações práticas de acção, foram resumidos por um grupo de neurologistas com enfoque na terapia da EM e coordenados no sentido de um consenso com o conselho consultivo científico da Sociedade Suíça de Esclerose Múltipla e da Sociedade Neurológica Suíça (SNS) [7]. Existem diferenças práticas em particular para as substâncias alemtuzumab (Lemtrada®), fingolimod (Gilenya®) e ocrelizumab (Ocrevus®), bem como para o transplante autólogo de células estaminais hematopoiéticas (aHSCT) (Tab. 1).
Indicação
A utilização de algumas preparações requer um certo grau de actividade da doença, pelo que o termo EM “activa” ou mesmo “altamente activa” não está geralmente claramente definido e é interpretado de forma diferente nos textos de autorização de introdução no mercado. Assim, a avaliação do médico assistente desempenha um papel decisivo, o que por sua vez tem implicações no que diz respeito a uma possível aplicação de uma garantia de custos.
De acordo com o SmPC suíço, o alemtuzumab pode ser utilizado em EM recorrente activa (RRMS). Isto é definido clinicamente em termos de pelo menos duas recaídas nos dois anos anteriores ao início da terapia (com pelo menos uma recaída no ano imediatamente anterior). O SL restringe ainda mais a indicação e requer ou um fracasso da terapia prévia ou, na ausência de terapia prévia, EM “primária altamente activa”, mais uma vez sem uma definição clara dos termos. De acordo com o SL, é necessária uma aprovação de custos para pacientes não tratados com uma forma de progressão altamente activa, que – devido à falta de uma definição – requer uma avaliação da situação individual, que fica assim ao critério do médico que trata. Especialmente para este grupo de pacientes, para quem o início atempado de uma terapia eficiente é de particular relevância, parece-nos importante salientar que os aspectos formais não devem conduzir a um atraso significativo.
As limitações do IF e do SL correspondem em parte aos critérios de inclusão dos estudos relevantes para a aprovação [8,9]. Contudo, correlaciona-se com a prática clínica actual que a pré-terapia não se limita ao acetato de glatiramer ou interferon-β – como foi o caso no ensaio central – mas deve também aplicar-se às outras imunoterapias aprovadas.
Em contraste com esta indicação relativamente rigorosa na Suíça, existe uma autorização mais geral na área da EMA, através da qual tanto os resultados clínicos como os de imagem podem ser utilizados para confirmar a actividade da doença. Isto, por sua vez, coloca maiores exigências à avaliação individual do risco-benefício do médico que prescreve.
Existe também uma maior diferença em termos de aprovação para o fingolimod. É aprovado como tratamento de primeira linha na Suíça, mas apenas como tratamento de segunda linha na região da EMA. Isto pode eventualmente ser explicado por uma interpretação diferente de risco-benefício, ou sobretudo com uma interpretação diferente da população estudada dos estudos de aprovação. Nos ensaios FREEDOMS, 57% dos doentes foram tratados – ingénuos, no ensaio TRANSFORMS 44% [10,11]. Também se encontram aspectos divergentes com esta preparação no que diz respeito à segurança. Na Suíça, uma interrupção terapêutica só é prescrita quando o valor linfocitário é inferior a 100/μl, enquanto que o limite na área EMA é de 200/μl.
Ao contrário da autorização europeia, que se baseia na população estudada dos estudos de registo, a indicação para ocrelizumab na Suíça é formulada de forma muito mais geral tanto pelo Swissmedic como no SL. É necessária uma forma de progressão activa e recaída, mas isto não é mais explicado ou limitado. Para o tratamento da EM progressiva primária (PPMS), a terapia foi incluída no SL sem restrições, o que é compreensível devido à falta de alternativas imunoterapêuticas. Neste caso, o objectivo da terapia com Ocrevus® é retardar a progressão da doença, devendo esta referir-se não só à capacidade de andar, mas também à preservação de outras funções residuais relevantes, tais como a função braço/mão ou capacidades motoras finas, no sentido de uma avaliação individual do risco-benefício. Nesta situação em particular, é essencial uma avaliação detalhada e, se possível, quantificada da progressão da doença antes e durante a terapia (“Expanded Disability Status Scale”, EDSS; “Multiple Sclerosis Functional Composite”, MSFC).
Especialmente os pacientes mais jovens com um curso mais curto da doença e uma actividade de doença detectável pela imagem (lesões que absorvem contrastes) parecem beneficiar da terapia. Por outro lado, contudo, não é automaticamente verdade que os pacientes sem actividade de imagiologia não são elegíveis para terapia.
Existem também diferentes abordagens para o transplante autólogo de células estaminais hematopoiéticas (aHSCT), que foi aprovado em alguns casos na região EMA ou pode ser utilizado de acordo com a opinião de peritos e foi aprovado na Suíça pela FOPH em 01.07.2018 para reembolso pelo OKP sob condições rigorosas. Os pacientes tratados, por exemplo, devem ser registados num registo. Devido às amplas alternativas terapêuticas para as formas recaídas da doença, aos efeitos secundários potencialmente graves deste tratamento invasivo e à falta de estudos controlados e aleatorizados, a terapia continua a ser controversa. Actualmente, recomenda-se que sejam utilizados apenas em casos cuidadosamente seleccionados e em centros académicos altamente especializados. Os critérios para os quais uma terapia correspondente poderia ser discutida incluem o menor grau de incapacidade possível a moderado (até EDSS 6,5), uma idade mais jovem do paciente (<50 anos), uma duração mais curta da doença (<10 anos) e o fracasso de uma imunoterapia anterior altamente activa.
Aspectos especiais de segurança
Aspectos gerais de segurança, tais como controlos laboratoriais, não são objecto deste artigo nem da recomendação consensual e podem ser encontrados nas respectivas informações técnicas.
Em princípio, as terapias devem ser realizadas por neurologistas experientes em EM em centros que garantam um acompanhamento e avaliação seguros dos doentes e possam detectar e tratar os efeitos secundários numa fase precoce.
Neste contexto, deve também ser feita uma menção especial aos exames de imagem e aos controlos de progresso. A imagem tomográfica por RM está a tornar-se cada vez mais importante não só no campo do diagnóstico, mas também no contexto das investigações de segurança. Por este motivo, independentemente da imunoterapia estabelecida, o acompanhamento deve utilizar protocolos normalizados e ser avaliado por neuroradiologistas com experiência adequada [12].
Os casos de leucoencefalopatia multifocal progressiva (LPM), uma infecção viral oportunista do SNC, foram descritos sob vários agentes imunoterapêuticos. Assim, das substâncias aqui discutidas, vários casos foram descritos sob a palavra fingolimod, correspondendo a um risco geral de 1/15.000 pacientes, bem como vários casos de “carry over” sob ocrelizumab e alemtuzumab após terapia prévia com natalizumab ou fingolimod [13].
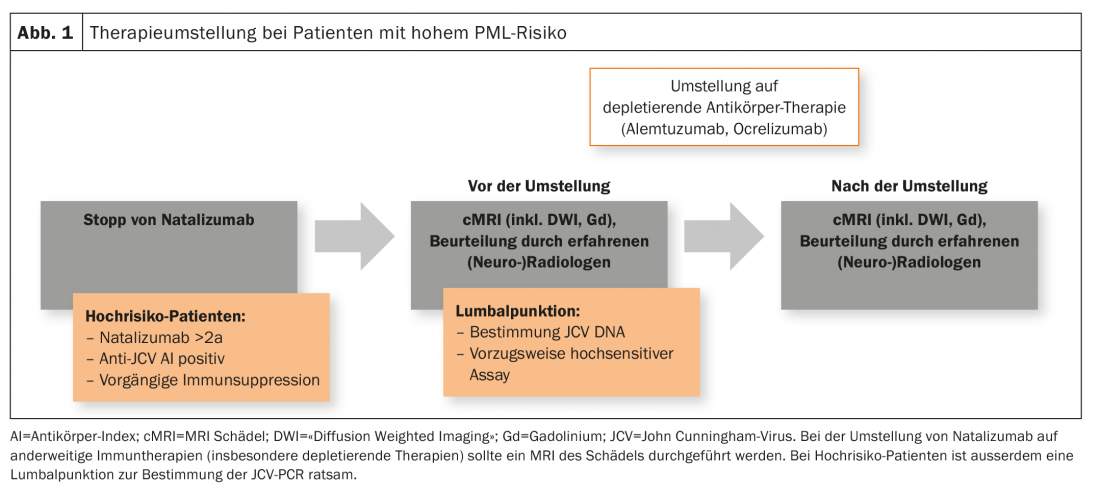
Os doentes de alto risco (duração da terapia com natalizumab ≥2 anos, anticorpos anti-JCV positivos, imunossupressão prévia) devem receber uma ressonância magnética craniana actual como parte de uma mudança na terapia. Além disso, é também aconselhável uma punção lombar com determinação de ADN JCV (de preferência num ensaio de alta sensibilidade). Isto aplica-se em particular à mudança de terapia de natalizumab para terapias esgotantes como o alemtuzumab ou ocrelizumab, mas também é realizada em certos centros quando se muda de ou para o fingolimod (Fig. 1). No entanto, não existe consenso sobre isto na Suíça.
Relatório de Avaliação Pública Suíça
Como parte da revisão da Lei dos Produtos Terapêuticos (TPA, Art. 67), a Swissmedic publica informações adicionais de interesse geral na área dos produtos terapêuticos. Por exemplo, no caso de medicamentos para uso humano, é elaborado um relatório de avaliação sumário (“Swiss Public Assessment Report”, SwissPAR) na sequência de uma decisão de aprovação ou rejeição de uma autorização de introdução no mercado a fim de aumentar a transparência do procedimento de autorização. Isto é tanto mais importante quanto outros países (por exemplo, países em desenvolvimento) recebem a sua sugestão da aprovação suíça [6,7].
Literatura:
- Federação Internacional de MS: Atlas de MS. www.msif.org/about-us/who-we-are-and-what-we-do/advocacy/atlas, último acesso 28.02.19.
- Dippel FW, et al: Dados dos seguros de saúde confirmam uma elevada prevalência de esclerose múltipla. Akt Neurol 2015; 42(4): 191-196.
- Koch-Henriksen N, et al: A incidência de EM aumentou acentuadamente ao longo de seis décadas na Dinamarca, particularmente com o seu início tardio e nas mulheres. Neurologia 2018; 90(22): 1954-1963.
- Noseworthy JH, et al: Esclerose múltipla. N Engl J Med 2000; 343(13): 938-952.
- Montalban X, et al: ECTRIMS/EAN Guideline on the pharmacological treatment of people with multiple sclerosis. Mul Scler 2018; 24(2): 96-120.
- Dalla Torre Di Sanguinetto S, et al: A Comparative Review of Marketing Authorization Decisions in Switzerland, the EU, and the USA. Ther Innov Regul Sci 2019; 53(1): 86-94.
- Achtnichts L, et al.: Specific aspects of Immunotherapy for Multiple Sclerosis in Switzerland: a structured Commentary. Neurociência Clínica e Translacional [no prelo).
- Cohen JA, et al: Alemtuzumab vs. interferon beta 1a como tratamento de primeira linha para pacientes com esclerose múltipla recorrente-remitente: um ensaio aleatório controlado de fase 3. Lancet 2012; 380(9856): 1819-1828.
- Coles AJ, et al: Alemtuzumab para pacientes com recidiva de esclerose múltipla após terapia modificadora da doença: um ensaio aleatório controlado de fase 3. Lancet 2012; 380(9856): 1829-1839.
- Kappos L, et al: Um Teste de Placebo-Controlado de Fingolimod Oral em Relapsing Multiple Sclerosis. N Enl J Med 2010; 362: 387-401.
- Cohen JA, et al: Dedilhador oral ou interferão intramuscular para a esclerose múltipla com recidiva. N Enl J Med 2010; 362(5): 402-415.
- Traboulsee A, et al: Recomendações Revistas do Grupo de Trabalho do Consórcio de Centros de EM para um Protocolo Padronizado de RM e Directrizes Clínicas para o Diagnóstico e Acompanhamento da Esclerose Múltipla. Am J Neuroradiol 2016; 37(3): 394-401.
- Berger JR, et al: Leucoencefalopatia multifocal progressiva após tratamento de dedoilimod. Neurologia 2018; 90(20): 1815-1821.
InFo NEUROLOGIA & PSYCHIATRY 2019; 17(2): 28-30.











