Numa dissecção aguda da aorta, a parede da aorta rasga-se primeiro do interior, fazendo com que as camadas da parede se separem. O resultado: é criado um lúmen adicional. O que fazer?
Numa dissecção aguda da aorta, a parede aórtica rasga primeiro do interior e a consequente separação das camadas da parede (íntima-média da adventícia) cria um lúmen adicional (a que chamamos o verdadeiro lúmen) para além do lúmen original do vaso (a que chamamos o falso lúmen). O correlato clínico é uma dor torácica aguda, frequentemente migratória. A classificação clássica dá uma dissecção envolvendo a aorta ascendente, a definição dissecção Tipo A, uma dissecção envolvendo o arco aórtico sem a aorta ascendente; a definição dissecção Tipo Não-A-não-B e uma dissecção envolvendo a aorta descendente, a definição dissecção Tipo B [1].
A localização da laceração primária (entrada) determina o curso clínico da dissecção aguda da aorta. O princípio essencial da doença subjacente é que, após o desenvolvimento da entrada primária, a propagação na parede da aorta ocorre com e contra o fluxo sanguíneo, levando ao alargamento da dissecção [2].
A localização da entrada primária pode muitas vezes ser atribuída a um segmento da aorta. Contudo, apenas a sua extensão final ao longo e contra o fluxo sanguíneo determina a evolução clínica, a nossa definição da doença (tipo A, tipo não-A-não-B ou tipo B) e a medida terapêutica invasiva imediata ou retardada resultante, para além da terapia medicamentosa, que inicialmente consiste sobretudo em baixar a tensão arterial [3,4].
Propagação contra a corrente sanguínea
A dissecção aguda com entrada primária na aorta ascendente, independentemente da propagação e extensão, é sempre referida como dissecção tipo A e a reparação cirúrgica aguda é o padrão de ouro, uma vez que a propagação retrógrada para a raiz da aorta leva a regurgitação aguda da válvula aórtica de alto grau devido ao prolapso comissural e a transudação através da parede da aorta leva ao tamponamento pericárdico. Neste caso, a ruptura da aorta é um processo metacrónico que pode ocorrer imediatamente, com um atraso de tempo ou, em casos individuais, de forma alguma [5].
Uma entrada primária na aorta descendente é chamada dissecção de tipo B, mas mais uma vez, a localização da entrada primária e a extensão fazem uma diferença significativa no tratamento, ou se uma dissecção aguda de tipo B já causou complicações, ou se são esperadas complicações, ou se é provável que a dissecção seja descomplicada. Definimos “complicado” como a ocorrência de má perfusão de órgãos devido a obstrução dinâmica ou estática através da membrana dissecante de ramos laterais ou terminais da aorta (medula espinal, estômago/intestino, rim e extremidades); mas também sintomas de dor persistente (a dor é um biomarcador muito bom no decurso dos primeiros dias) e uma diferença na pressão sanguínea entre as extremidades superiores e inferiores (no sentido de uma pseudocoarctação causada pela membrana dissecante) são classificados como cursos “complicados”. Qualquer forma de derrame pleural sangrento e, compreensivelmente, qualquer forma de ruptura coberta e descoberta são também pontuadas como “complicadas”. Se todos os sintomas acima mencionados estiverem ausentes, falamos de uma dissecção do tipo B “sem complicações”, desde que o diâmetro total da aorta dissecada não exceda 40 mm.
Consideramos as dissecções como “potencialmente complicadas” se cumprirem critérios morfológicos que muitas vezes precedem as complicações acima mencionadas, as mais importantes são a localização da entrada primária no lado interior do arco aórtico (porque na propagação retrógrada nenhuma barreira anatómica pode impedir a progressão do processo para o arco aórtico e para a aorta ascendente, que é frequentemente impedida no lado exterior do arco pelos vasos da cabeça e do pescoço) e uma curta distância entre a entrada primária e a artéria subclávia esquerda (distâncias inferiores a 2 cm são aqui consideradas curtas) [2,6,7].
Propagação ao longo da corrente sanguínea
O nosso foco principal durante muitos anos foi quase exclusivamente a propagação ao longo da corrente sanguínea, o que é intuitivamente correcto, uma vez que uma entrada primária localizada imediatamente ao nível da artéria subclávia esquerda mostra o seu efeito apenas nos segmentos a jusante da aorta, especialmente ao nível dos vasos viscerais e renais, através do colapso da luz verdadeira com má perfusão dos órgãos terminais afectados. [3,8].
Mecanismos para a má perfusão de órgãos
A causa principal é a compressão estática ou dinâmica do lúmen verdadeiro. A presença ou ausência de malperfusão depende muito da localização da entrada primária e da dinâmica da membrana dissecante ao longo do ciclo cardíaco, tendo a localização da entrada primária em segmentos angulados da aorta (como o arco aórtico e a a aorta descendente proximal) uma correlação mais forte com a ocorrência de malperfusão [2–5].
Mecanismos para a formação de aneurismas
A principal razão para a formação do aneurisma é a diferença na pressão sanguínea entre o lúmen verdadeiro e falso e o ângulo em que o fluxo sanguíneo atinge a parede da aorta. Estes factores são por sua vez determinados pela localização da entrada principal e também pelo número e tamanho das comunicações entre a lumina (anteriormente também referidas como entradas múltiplas e reentradas). Outro factor importante é o tamanho da comunicação mais distal entre a luz ou também como o rasgo mais distal (reentrada), uma vez que – no caso de uma reentrada pequena ou ausente – a pressão arterial média no falso lúmen pode ser significativamente mais elevada do que no lúmen verdadeiro, resultando num aumento da resistência periférica [9,10].
Estratégia terapêutica activa
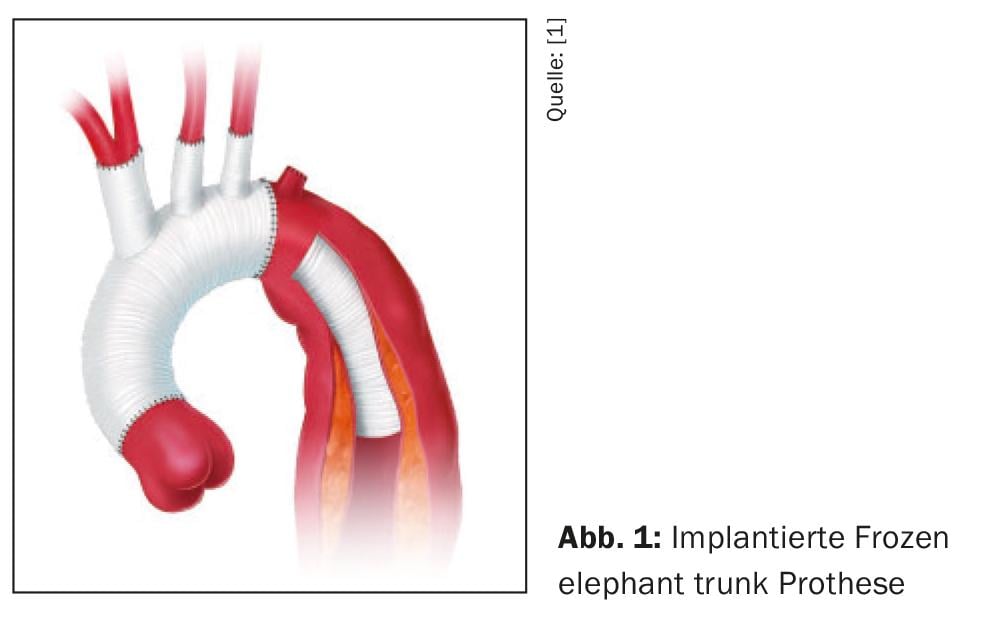
O princípio básico de qualquer estratégia terapêutica activa é sempre o de fechar a entrada primária quer por ressecção e substituição do vaso em cirurgia aberta, quer excluindo a entrada primária da corrente sanguínea através da inserção de um stent, quer como “reparação da aorta endovascular torácica (TEVAR)”, quer em cirurgia aberta pela técnica chamada Frozen Elephant Trunk (FET). (Fig. 1). A aproximação resultante do cilindro intima-media e adventícia leva a uma descompressão do lúmen verdadeiro com restauração simultânea dos diâmetros transversais regulares dos segmentos a jusante da aorta e assim a uma estabilização da membrana de dissecação, No entanto, o número e o tamanho da comunicação entre a luminária também têm influência, pelo que é sempre necessário realizar um alongamento do stent, uma vez que grandes comunicações entre a luminária ainda podem provocar síndromes persistentes de má perfusão apesar do encerramento bem sucedido da entrada primária. Portanto, em casos individuais é também necessário colocar stents não cobertos (abertos) sobre as saídas dos vasos viscerais e renais.
Saída dos grandes ramos laterais do lúmen verdadeiro e/ou falso
No decurso do evento agudo, todos os ramos continuam inicialmente a afastar-se do lúmen verdadeiro, e os cilindros intima/media dos grandes ramos laterais estendem-se inicialmente como tubos através do lúmen falso recentemente criado até ao respectivo órgão final. Uma vez que estes cilindros intima/media são muito frágeis, rasgam-se frequentemente mais cedo ou mais tarde dentro do falso lúmen, o que resulta então morfologicamente na circunstância de partida do falso lúmen. É essencial estar consciente de que este é um efeito secundário e que a comunicação resultante entre a luminária é sempre do tamanho do diâmetro de saída do ramo lateral. Por esta razão, o fluxo sanguíneo através desta comunicação entre o lúmen verdadeiro e falso é suficiente para a perfusão de órgãos finais na maioria dos casos, e a oclusão da entrada primária com a prevenção da perfusão no falso lúmen não tem efeitos adversos no fluxo sanguíneo para os respectivos órgãos finais, independentemente de ter sido utilizada a cirurgia aberta, TEVAR ou a técnica FET. [12].
Resumo da fisiopatologia
Deve-se ter sempre presente que as definições actuais (tipo A, tipo não-A-não-B, dissecção tipo B) são apenas aproximações para descrever o mesmo processo fisiopatológico em que o início (entrada primária) e o respectivo fim (ao longo e contra o fluxo sanguíneo) da dissecção fazem a diferença fundamental no curso clínico e a necessidade de uma estratégia de tratamento activa.
Qual é a melhor estratégia de tratamento para a dissecção sem complicações do tipo B?
Durante muitos anos, o curso clínico da dissecção aguda tipo B foi interpretado como a dissecção “inofensiva” da aorta (especialmente em comparação com a dissecção frequentemente dramática tipo A), uma vez que raramente havia necessidade de acção na situação aguda [13]. No entanto, um olhar mais atento à história natural da doença mostrou que um grande número de doentes desenvolve complicações em determinados momentos e depois precisa de ser tratado activamente [14]. Constatou-se que as causas e o timing variam com a má perfusão de órgãos, propagação retrógrada para o arco aórtico e a aorta ascendente (dissecção retrógrada tipo A) predominando na fase aguda da doença e depois formação de aneurisma predominando nas fases subaguda e crónica [15]. A resposta à questão de quais os pacientes que frequentarão qual o curso primário e quem desenvolverá complicações secundárias foi demonstrada principalmente em parâmetros morfológicos e funcionais e levou à definição de grupos de alto risco [16,17].
Calendário da doença
A fase aguda é definida desde o início imediato do evento primário da dor até ao dia 14 seguinte, entre o dia 15 e o dia 90 falamos da fase subaguda e a partir do dia 91 falamos da fase crónica [13].
ensaio INSTEAD
O ensaio INSTEAD (Investigação de Enxertos de STEnt na Dissecção da Aorta) e o seguimento a longo prazo (ensaio INSTEAD-XL) compararam prospectivamente se o implante de stent profilático adicional (TEVAR) tem uma vantagem sobre a terapia medicamentosa óptima apenas em pacientes com dissecção do tipo B não complicada entre 2 e 52 semanas após o evento agudo. Após 5 anos, os doentes que receberam TEVAR profilático adicional mostraram um efeito positivo significativo na sobrevivência e progressão da doença subjacente relacionada com a a aorta [18,19].
Ensaio ADSORB
O ensaio ADSORB (Endoprótese de Dissecção Aguda ou Melhor Tratamento Médico) compara prospectivamente se o TEVAR adicional tem uma vantagem sobre a terapia médica óptima apenas em pacientes com dissecção aguda tipo B não complicada entre 0 e 2 semanas após o evento agudo. O ponto final primário aqui foi uma combinação do estado de trombose lúmen verdadeiro e, dilatação da aorta ou eventos aórticos adversos (ruptura) a um ano. A conclusão a que se chegou foi que o TEVAR poderia conseguir tanto a remodelação positiva da aorta como a redução do diâmetro com trombose consecutiva (intencional) do falso lúmen, mas que era necessário esperar resultados a longo prazo, que não estão disponíveis neste momento [20].
Estes dois estudos representam o mais alto nível de evidência disponível neste momento. O ensaio INSTEAD XL, em particular, levou a uma modificação das últimas Directrizes Aórticas ESC e elevou o TEVAR profiláctico em dissecação tipo B sem complicações para uma recomendação de Classe IIA, Nível B.
Curso natural de dissecação tipo B sem complicações
Após a fase aguda, ocorre a cronificação e a membrana dissecante encontra-se numa fase de transição entre o estado agudo altamente elástico e frágil para um estado estático. O efeito da completa reposição das camadas das paredes é melhor nas primeiras semanas após o evento agudo [21]. É muito raro que complicações como a má perfusão de órgãos ou a propagação retrógrada na aorta ascendente (dissecção retrógrada tipo A) ainda ocorram nesta fase; contudo, há sempre um aumento do diâmetro transversal máximo da aorta. Esta circunstância de aumento do diâmetro pode ser antecipada com base em critérios morfológicos ou rastreada nos controlos de angiografia computorizada (CTA) e pode então ser parada pela TEVAR numa fase inicial e, no melhor dos casos, invertida [16].
Estratégia de tratamento óptima para dissecção aguda não complicada do tipo B
Com base nas provas actualmente disponíveis, é correcto recomendar a terapia medicamentosa ideal como base de tratamento para qualquer dissecção aguda do tipo B. A análise morfológica precisa permite a identificação de subgrupos de alto risco que beneficiam prognósticos de TEVAR precoce. Estes são, em última análise, muitos pacientes, em alguns colectivos, até 80%. O ensaio INSTEAD e o seu seguimento de 5 anos (ensaio INSTEAD XL) fornecem-nos as melhores provas actualmente disponíveis para o benefício de uma estratégia endovascular em pacientes com dissecção do tipo B não complicada. O TEVAR profilático deve ser considerado se a anatomia for adequada [19]. Nos últimos anos, este conhecimento alargado já encontrou o seu caminho em directrizes internacionais e documentos de consenso de especialistas [22,23].
Estudo de caso 1 – Dissecação aguda complicada tipo BUm homem de 57 anos de idade sofre de uma súbita dor aguda no peito que começa entre as omoplatas e se irradia para a virilha. Após 5 minutos, desenvolve primeiro perturbações sensoriais e depois paraparesia e finalmente paraplegia da extremidade inferior direita; o médico de urgência chamado ao local detecta clinicamente um défice de pulso na virilha direita e suspeita de uma dissecção aguda da aorta, tendo em conta os sintomas de dor vagarosa e o défice de pulso. Além disso, o paciente desenvolve clinicamente um abdómen agudo com dor e guarda. É transferido para a sala de emergência mais próxima, onde é realizada uma AIC de toda a aorta, com base no diagnóstico suspeito. Resultado da CTA: A CTA mostra uma dissecção de tipo B com a entrada primária no arco aórtico interno essencialmente sem distância à artéria subclávia esquerda. Há um colapso da luz verdadeira ao nível dos vasos viscerais e renais e a artéria ilíaca comum direita está também funcionalmente ocluída. Curso clínico: O lactato de soro sobe para 10 mmol/l e a diurese pára. Há uma necessidade aguda de acção para fechar a entrada primária para descomprimir o lúmen verdadeiro e restaurar o fluxo sanguíneo para os segmentos a jusante da aorta e extremidade inferior direita. Constelação que favorece um TEVAR primário. Como parte do diagnóstico da ATC, foram também examinados os vasos da cabeça e do pescoço. A artéria vertebral esquerda é pequena e não contribui para a competência do Círculo de Willisi. Nesta constelação, pode ser realizado um TEVAR primário com sobretensão da saída da artéria subclávia esquerda para resolver a situação aguda, a probabilidade de desencadear isquemia aguda do membro superior é baixa, mas deve ser realizada uma medição da saturação periférica de oxigénio no braço esquerdo e o procedimento posterior deve ainda depender da evolução clínica (claudicação de esforço). Constelação favorecendo o TEVAR e a revascularização simultânea da artéria subclávia esquerda: A artéria vertebral esquerda é um vaso muito grande e o círculo de Willisi é interrompido, o que significa que no caso de uma artéria vertebral direita hipoplásica, a artéria esquerda é de importância fundamental. Portanto, um bypass carotídeo-subclávio é realizado antes do implante do stent para preservar a circulação cerebral posterior e para preservar a entrada na artéria espinal anterior (evitando a isquemia da medula posterior). Constelação que favorece a implantação de FET primário: O doente tem uma aorta ascendente e um aneurisma do arco aórtico com um diâmetro transversal máximo de 5 cm, o que significa que não existe uma zona de aterragem proximal adequada e não é possível realizar o TEVAR. |
Subgrupos “de alto risco” com dissecação aguda tipo B – Localização da entrada principal
A localização da entrada primária no lado interior do arco aórtico demonstrou ser um dos factores de risco morfológico mais significativos para a presença ou ocorrência de complicações da dissecção aguda tipo B, especialmente a má perfusão de órgãos e a dissecção retrógrada tipo A nos primeiros 14 dias após o evento agudo [2,16,17].
Distância entre a entrada primária e a saída da artéria subclávia esquerda
A distância entre a entrada primária e a saída da artéria subclávia esquerda é também um preditor significativo, com o risco a diminuir significativamente com uma maior distância [16, 24-26].
Tamanho da entrada principal
A dimensão da entrada primária é também prognosticalmente relevante, particularmente em relação ao aumento precoce do diâmetro transversal máximo da aorta, a partir de 10 mm de diâmetro transversal máximo o risco aumenta significativamente para a expansão e ruptura precoce da aorta. O melhor método, mas por razões pragmáticas raramente utilizado principalmente é a ecocardiografia transesofágica (TEE) [25]. A razão para isto deve-se também a um pico de tensão arterial frequentemente associado ao ETE, que geralmente se quer evitar na dissecção da aorta.
Diâmetro total da aorta e diâmetro do falso lúmen
Um diâmetro total de 40 mm ou superior medido inicialmente no diagnóstico da ATC e um diâmetro inicial do lúmen fibroso igual ou superior a 22 mm também demonstraram ser factores de previsão de aumento de tamanho ao longo do tempo e justificar a colocação de stent endovascular [17,27,28].
Número e tamanho das comunicações entre a luminária
O número e o tamanho das comunicações entre lumina em toda a aorta toracoabdominal também demonstraram ser factores de influência significativa para o aumento do tamanho ao longo do tempo. Mesmo depois do TEVAR, as comunicações de grande calibre entre os lúmenes distais à endoprótese podem funcionar como uma nova entrada primária. Um mecanismo semelhante pode ser observado se, após TEVAR, a membrana de dissecção na extremidade distal do stent se rasgar para dentro do lúmen errado devido a forças de cisalhamento excessivas (geralmente com um stent sobredimensionado), isto é conhecido como Stent-graft Induced New Entry(dSINE) distal [29,30].
Trombose do falso lúmen em graus variáveis
A trombose parcial do falso lúmen também demonstrou ser um substituto prognóstico para um resultado desfavorável. A trombose parcial pode frequentemente ser caracterizada como um fenómeno de fluxo com imagens mais modernas, mas a hipótese de aumento da pressão arterial média no falso lúmen devido ao atraso na saída (menor comunicação interluminal distal) continua a ser a mesma que a resistência periférica é aumentada no falso lúmen [10].
TEVAR para cada paciente com dissecção tipo B sem complicações?
O objectivo do TEVAR profilático permanece para evitar a formação posterior de aneurisma e as complicações tardias associadas, uma vez que a má perfusão e a dissecção espontânea retrógrada tipo A só ocorrem durante a fase aguda. Contudo, a dissecção retrógrada tipo A também pode ocorrer durante o TEVAR e isto, combinado com outras complicações muito raras mas que ocorrem relacionadas com o procedimento, tais como acidente vascular cerebral e isquemia sintomática da medula espinal, são as razões pelas quais a indicação deve continuar a ser bem justificada. Uma aorta ascendente ectática, um arco aórtico ectático e procedimentos de transposição extensivos para alcançar uma zona de aterragem proximal adequada são outros factores de risco [31,32].
Estudo de caso 2 – Dissecação aguda tipo B não complicadaUma mulher de 64 anos sofre de dores agudas no peito que começam entre as omoplatas e continuam até ao nível do diafragma. Ela perde a consciência durante 30 segundos, depois a dor melhora. O médico de urgência faz um diagnóstico clínico suspeito de síndrome coronária aguda e encaminha o paciente para o departamento de urgência mais próximo, com uma estação de cateteres, para posterior diagnóstico. Mais investigações: É colhida uma amostra de sangue, as enzimas cardíacas são normais mas o D-dímero está elevado. É realizada uma AIC para excluir embolia pulmonar ou dissecção da aorta. CTA mostra uma dissecção de tipo B com uma entrada primária no lado exterior do arco aórtico sem evidência de má perfusão. constelação que favorece uma abordagem essencialmente conservadora: A distância da entrada primária à artéria subclávia esquerda é de 3 cm, o diâmetro transversal máximo da entrada primária é de 5 mm, o diâmetro total da aorta é de 37 mm e o diâmetro do falso lúmen é de 16 mm. Não há imagens ou sinais clínicos de malperfusão. Nesta constelação, existe uma situação de baixo risco e é iniciado um procedimento essencialmente conservador com terapia e controlo óptimos da AIC. Constelação que favorece o TEVAR profilático:
Apesar da dissecção formal “sem complicações” do tipo B, estas duas constelações podem ser consideradas constelações de “alto risco” e deve ser realizada uma terapia TEVAR precoce para fechar a entrada primária. Basicamente – se o TEVAR for realizado em circunstâncias planeadas, deve ser colocado um dreno do LCR antes do procedimento de protecção da medula espinal (o dreno do LCR é a fasciotomia da medula espinal). |
Avaliação do risco de potenciais complicações associadas à terapia
O risco residual de AVC está no intervalo percentual baixo de um dígito. Aqui, é possível fazer uma declaração prévia precisa, avaliando a AIC de diagnóstico no que diz respeito às lesões arterioscleróticas na proximidade das saídas dos ramos supraaórticos e assim compreender ou excluir um risco potencial de embolia através da manipulação de cateteres.
Uma questão importante continua a ser a isquemia sintomática da medula espinal de vários graus, desde distúrbios sensoriais a paraplegia completa. Nos últimos anos, tem havido um salto quântico de conhecimento sobre os mecanismos subjacentes e a sua prevenção. Deve-se notar que a medula espinal, análoga à arcada de fornecimento arterial visceral de Riolan, tem mecanismos de apoio extra e intraspinal que podem compensar, até certo ponto, a perda de sangue aguda e crónica. Antes de mais, o conceito de “quatro territórios” deve ser discutido aqui [33]. Isto pressupõe a existência anatómica de quatro tributários arteriais da medula espinal, que são de valor igual, nomeadamente a artéria subclávia (com a sua continuação na artéria vertebral e, portanto, na artéria espinal anterior), as artérias segmentares torácicas (vasos intercostais), as artérias segmentares lombares (vasos lombares) e a artéria iliacae internae, todas elas formando tributárias para as artérias radiculomedulares anteriores e, portanto, para a artéria espinal anterior. Se um destes tributários arteriais for ocluído (por exemplo, se várias artérias segmentares torácicas forem cobertas por um stent), isto não tem um impacto significativo no risco de isquemia sintomática da medula espinal. No entanto, se dois tributários forem ocluídos ao mesmo tempo (por exemplo, sobreposição adicional da artéria subclávia esquerda), isto aumenta significativamente o risco de paraplegia, uma vez que esta extensão do fluxo sanguíneo reduzido já não pode ser compensada. Mesmo uma fase de hipotensão pronunciada por si só pode aumentar o risco de paraplegia (por exemplo, TEVAR agudo em rotura). A natureza tem a possibilidade de compensar a redução aguda do fornecimento de sangue, por exemplo, da secção torácica da medula espinal, através dos músculos autóctones das costas e de induzir a germinação de vasos capilares na área insuficientemente suprida [34]. Dentro da medula espinal existem até mesmo – recipientes colaterais formados que podem intervir em tais situações, mas a capacidade desta rede colateral é apenas limitada e qualquer forma de hipotensão intra ou pós-operatória contribui para o risco [35].
Uma medida muito útil na situação eletiva para prevenir a isquemia medular sintomática é a aplicação de uma drenagem do líquido cefalorraquidiano antes da operação. Cada tecido, incluindo a medula espinal, reage à isquemia aguda com inchaço do tecido, mas a medula espinal é muito limitada na sua capacidade de inchaço no canal espinal estreito devido à presença do seu fluido portador, ou seja, o líquido cefalorraquidiano, e – análogo à isquemia dos membros sem fasciotomia – há uma compressão do leito capilar e, portanto, um círculo vicioso, que termina com a perda de órgãos; a este respeito, a drenagem do líquido cefalorraquidiano pode ser descrita como uma fasciotomia da medula espinal. [36]. Mesmo em casos de isquemia medular sintomática secundária, por exemplo, alguns dias após a cirurgia, a aplicação de uma drenagem do LCR está frequentemente associada a um sucesso clínico impressionante.
Outra medida de monitorização muito útil no TEVAR é a medição de potenciais evocados motores e somatossensoriais (MEPs/ SSEPs) [37]. Isto torna possível detectar áreas de isquemia funcional numa fase precoce e contrariá-las em conformidade, por exemplo, aumentando a pressão arterial média ou aumentando o hematócrito; estas medidas também podem ser muito úteis na fase inicial da isquemia aguda da medula espinal.
Nos últimos anos, a técnica FET foi estabelecida no tratamento de uma variedade de patologias agudas e crónicas da aorta torácica, mas também em pacientes com dissecção complexa do tipo B que não têm uma zona de aterragem proximal adequada para a ancoragem do stent. Esta indicação, embora rara, deve ser considerada se o risco avaliado de dissecação retrógrada do tipo A for elevado. Os resultados deste procedimento para esta indicação são muito bons em centros experientes [33]. A cirurgia aberta clássica através de uma toracotomia lateral esquerda, por outro lado, já não tem qualquer importância hoje em dia.
As operações de fenestração aberta, nas quais a membrana de dissecação é parcialmente excisada, também são hoje obsoletas. Além disso, o único tratamento intervencional de um órgão final mal-fundido não tem qualquer valor, uma vez que a causa da má perfusão continuaria a existir através da entrada primária aberta e permaneceria por resolver.
Escolher o momento certo para o tratamento
As provas actualmente disponíveis sugerem que um intervalo de tempo mais longo entre o evento agudo e o TEVAR (mais de 2 semanas) é favorável em termos de complicações relacionadas com o procedimento, assumindo a estabilidade clínica [38,39].
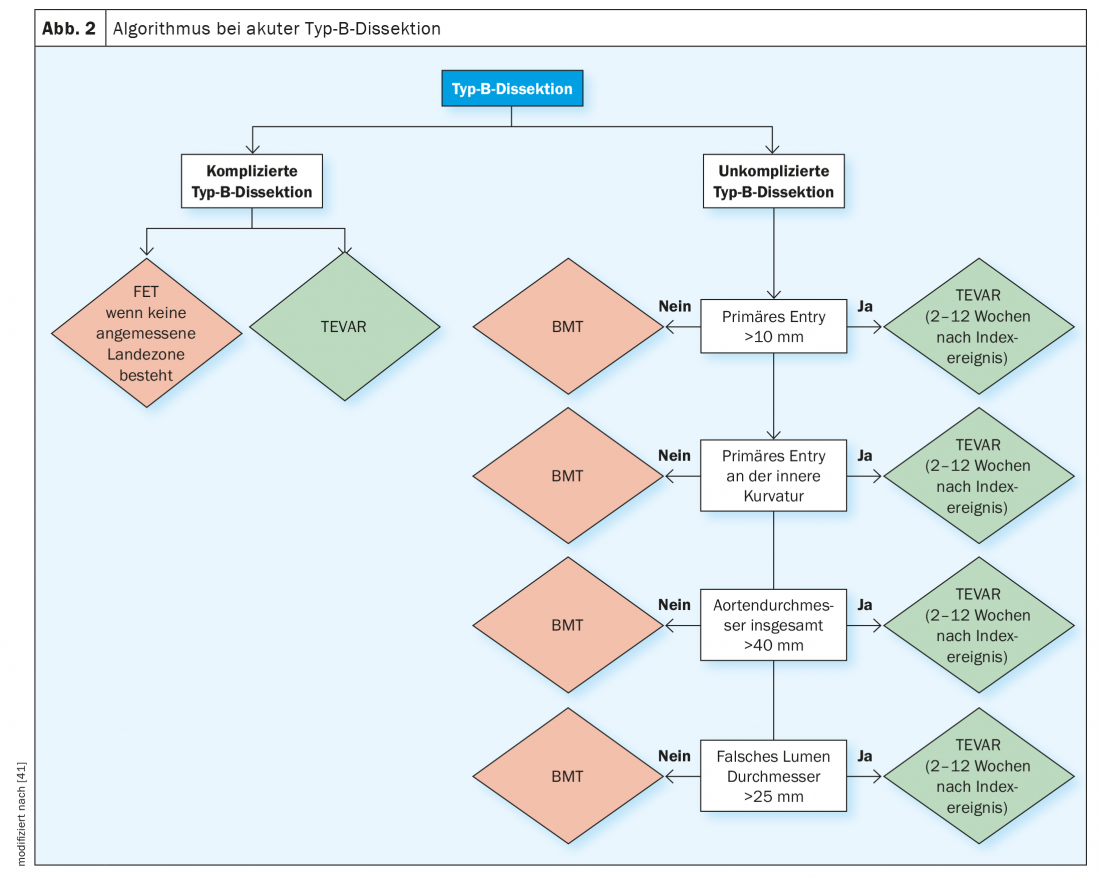
Algoritmo de diagnóstico e tratamento recomendado
O diagnóstico de dissecção aguda e subaguda sem complicações de tipo B requer um algoritmo de avaliação complexo no qual os parâmetros de substituição mencionados para complicações precoces e tardias devem ser avaliados antes de se fazer o diagnóstico de dissecção “sem complicações” de tipo B. A figura 2 mostra o algoritmo de diagnóstico que também é recomendado pelas principais sociedades profissionais para definir estes subgrupos de alto risco e depois tomar o caminho de tratamento correcto em cada caso.
Mensagens Take-Home
- A incidência de dissecção verdadeiramente descomplicada do tipo B é inferior ao que se pensava anteriormente.
- Um diagnóstico de exclusão por etapas para confirmar ou excluir substitutos “de alto risco” deve ser aplicado utilizando a angiografia CT antes de se estabelecer o diagnóstico de “sem complicações”.
- O potencial de remodelação positiva da aorta (redução do diâmetro, aproximação das camadas das paredes) diminui com o tempo, e isto deve ser tido em conta na escolha do tempo de tratamento (“janela de oportunidade de 90 dias”).
- A atenção à manutenção da perfusão medular tanto quanto possível através dos quatro principais tributários arteriais é um factor crítico na redução do risco residual de isquemia sintomática da medula espinal.
- A drenagem do LCR é uma medida altamente eficaz para a prevenção e também para a terapia da isquemia sintomática da medula espinal.
- Nos doentes que necessitam de tratamento mas que estão em alto risco de dissecção retrógrada do tipo A, a técnica FET deve ser considerada.
Literatura:
- Czerny M, Schmidli J, Adler S, et al: Current options and recommendations for the treatment of thoracic aortic patologies involving the aortic arch- an expert consensus document of the European Association for Cardio-Thoracic Surgery (EACTS) and the European Society of Vascular Surgery (ESVS). Eur J Cardiothorac Surg 2019(55): 133-162.
- Loewe C, Czerny M, Sodeck GH, et al: Um novo mecanismo pelo qual uma dissecção aguda da aorta tipo B é principalmente complicada, torna-se complicada, ou permanece descomplicada. Ann Thorac Surg 2012; 93: 1215-1522.
- Ante M, Mylonas S, Skrypnik D, et al: Prevalência dos preditores tomográficos computorizados DISSECT em dissecção aórtica tipo B não complicada de Stanford. Eur J Vasc Endovasc Surg 2018; 56: 525-533.
- Weiss G, Wolner I, Folkmann S, et al: A localização da laceração de entrada primária na dissecção aguda da aorta tipo B afecta o resultado precoce. Eur J Cardiothorac Surg 2012; 42: 571-576.
- Erbel R, Aboyans V, Boileau C, et al: 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases – Documento que cobre as doenças agudas e crónicas da aorta torácica e abdominal do adulto – The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2873-2926.
- Rylski B, Reser D, Kari F, et al: dissecção aguda não A, não B da aorta: definição, tratamento e resultado. Eur J Cardiothorac Surg 2017; 52: 1111-1117.
- Grimm M, Loewe C, Gottardi R, et al: Novidades sobre os mecanismos e tratamento do hematoma intramural que afecta toda a aorta torácica. Ann Thorac Surg 2008; 86: 453-456.
- Trimarchi S, Jonker FH, van Bogerijen GH, et al: Previsão do alargamento da aorta na dissecção da aorta de tipo B. Ann Cardiothorac Surg 2014; 3: 285-291.
- Czerny M, Eggebrecht H, Rousseau H, et al: stent-graft distal induziu nova entrada depois de TEVAR ou FET – percepções sobre uma nova doença da EuREC. Ann Thorac Surg 2020, e-pub antes da impressão.
- Tsai TT, Evangelista A, Nienaber CA, et al: Registo Internacional de Dissecção Aguda da Aorta. Trombose parcial da falsa luz em pacientes com dissecção aguda da aorta do tipo B. N Engl J Med 2007; 357: 349-59.
- Evangelista A, Isselbacher EM, Bossone E, et al: Insights from the International Registry of Acute Aortic Dissection: Uma experiência de 20 anos de investigação clínica colaborativa. Circulação 2018; 137: 1846-1860.
- Czerny M, Rodler S, Fakhimi S, et al: Resultados a médio prazo de TEVAR em doentes com aneurismas envolvendo a aorta descendente proveniente de dissecções crónicas do tipo B. Ann Thorac Surg 2010; 90:90-94.
- Evangelista A, Isselbacher EM, Bossone E, et al: Insights from the International Registry of Acute Aortic Dissection: Uma experiência de 20 anos de investigação clínica colaborativa. Circulação 2018; 137: 1846-1860.
- Pape LA, Awais M, Woznicki EM, et al: Apresentação, diagnóstico, e resultados da dissecção aguda da aorta: tendências de 17 anos do registo internacional de dissecção aguda da aorta. J Am Coll Cardiol 2015; 66: 350-358.
- Zeeshan A, Woo EY, Bavaria JE, et al: Reparação endovascular torácica da aorta para dissecção aguda complicada da aorta tipo B: superioridade em relação à terapia cirúrgica e médica convencional aberta. J Thorac Cardiovasc Surg 2010; 140(6 Suppl): S109-15.
- Trimarchi S, Jonker FH, van Bogerijen GH, et al: Previsão do alargamento da aorta na dissecção da aorta de tipo B. Ann Cardiothorac Surg 2014; 3: 285-291.
- Ante M, Mylonas S, Skrypnik, et al: Prevalência dos preditores tomográficos computorizados DISSECT em dissecção aórtica tipo B não complicada de Stanford. Eur J Vasc Endovasc Surg 2018; 56: 525-533.
- Nienaber C, Rousseau H, Eggebrecht H, et al: Uma comparação aleatória de estratégias para dissecação aórtica não complicada do tipo B – o ensaio INSTEAD (INvestigation of STEnt-grafts in Aortic Dissection). Circulação 2009; 120: 2519-2528.
- Nienaber CA, Kische S, Rousseau H, et al: Endovascular repair of type B aortic dissection: resultados a longo prazo da investigação aleatória de endopróteses em ensaio de dissecção da aorta. Circ Cardiovasc Intervent 2013; 6: 407-416.
- Brunkwall J, Kasprzak P, Verhoeven E, et al: A reparação endovascular da dissecção aguda não complicada da aorta tipo B promove a remodelação da aorta; resultados de 1 ano do ensaio ADSORB. Eur J Vasc Endovasc Surg 2014; 48: 285-291. Erratum in Eur J Vasc Endovasc Surg 2015; 50: 130.
- Moulakakis KG, Mylonas SN, Dalainas I, et al: Gestão de dissecções agudas complicadas e descomplicadas do tipo B. Uma revisão sistemática e uma meta-análise. Ann Cardiothorac Surg 2014; 3: 234-246.
- Erbel R, Aboyans V, Boileau C, et al: 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases – Documento que cobre as doenças agudas e crónicas da aorta torácica e abdominal do adulto – The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2873-2926.
- Grabenwöger M, Alfonso F, Bachet J, et al: Declaração de posição ESC/EACTS sobre a reparação da aorta endovascular torácica (TEVAR). Eur J Cardiothorac Surg 2012; 42: 17-24.
- Weiss G, Wolner I, Folkmann S, et al: A localização da laceração de entrada primária na dissecção aguda da aorta tipo B afecta o resultado precoce. Eur J Cardiothorac Surg 2012; 42: 571-576.
- Evangelista A, Salas A, Ribera A, et al: Resultado a longo prazo da dissecção da aorta com falso lúmen patente: papel preditivo do tamanho e localização do rasgão de entrada. Circulação 2012; 125: 3133-3141.
- Codner JA, Lou X, Duwayri YM, et al: A distância do rasgão intimal primário da artéria subclávia esquerda prevê o crescimento da aorta em dissecção aórtica do tipo B sem complicações. J Vasc Surg 2019; 69: 692-700.
- Song JM, Kim SD, Kim JH, et al: Preditores de longo prazo de alterações aneurismáticas descendentes da aorta em doentes com dissecção da aorta. J Am Coll Cardiol 2007; 50: 799-804.
- Fattori R Cao P, De Rango P, et al: Documento de consenso interdisciplinar de especialistas sobre o tratamento endovascular da dissecção aórtica do tipo B. J Am Coll Cardiol 2013; 61: 1661-1678.
- Czerny M, Eggebrecht H, Rousseau H, et al.: O stent-graft distal induziu nova entrada depois de TEVAR ou FET – percepções sobre uma nova doença da EuREC. Ann Thorac Surg 2020, no prelo.
- Lou X, Duwayri YM, Jordan WD Jr, et al: The Safety and Efficacy of Extended TEVAR in Acute Type B Aortic Dissection. Ann Thorac Surg 2020, no prelo.
- Cochennec F, Tresson P, Cross J, et al: Reparação híbrida de dissecções do arco aórtico. J Vasc Surg 2013; 57: 1560-1567.
- Eggebrecht H, Thompson M, Rousseau H, et al; em nome do Registo Europeu de Complicações na Reparação Endovascular da Aorta. Dissecção retrógrada da aorta ascendente durante ou após a colocação do stent da aorta torácica – observações do Registo Europeu sobre complicações da reparação endovascular da aorta (EuREC). Circulação 2009; 120: S276-281.
- Czerny M, Eggebrecht H, Sodeck G, et al: Mecanismos de isquemia sintomática da medula espinal após TEVAR- Insights from the European Registry of Endovascular Aortic Repair Complications (EuREC). J Endovasc Ther 2012; 19: 37-43.
- Etz CD, Kari FA, Mueller CS, et al: O conceito de rede colateral: remodelação da rede colateral arterial após sacrifício experimental da artéria segmentar. J Thorac Cardiovasc Surg 2011; 141: 1029-1036.
- Heber U, Mayrhofer M, Gottardi R, et al: The intraspinal arterial collateral network – uma nova base anatómica para a compreensão e prevenção de paraplegia durante a reparação aórtica. Eur J Cardiothorac Surg 2020, no prelo.
- Etz C, Weigang E, Hartert M, et al: Contemporary espinal medula protection during thoracic and thoracoabdominal aortic surgery and endovascular aortic repair: A position paper of the vascular domain of the European Association for Cardio-Thoracic Surgery. Eur J Cardiothorac Surg 2015; 47: 943-957.
- Maier S, Shcherbakova M, Beyersdorf F, et al: Benefícios e riscos do cateter profiláctico de fluido cerebro-espinhal e evocado potencial de monitorização na isquemia sintomática da medula espinhal reparação endovascular da aorta torácica de baixo risco. Thorac Cardiovasc Surg 2018; 67: 379-384.
- Kreibich M, Berger T, Morlock J, et al: A técnica da tromba de elefante congelado para o tratamento da dissecção aguda complicada da aorta do tipo B. Eur J Cardiothorac Surg 2018; 53: 525-530.
- Desai ND, Gottret JP, Szeto WY, et al: Impact of timing on major complications after thoracic endovascular aortic repair for acute type B aortic dissection. J Thorac Cardiovasc Surg 2015; 149(2 Suppl): S151-156.
- Heijmen R, Fattori R, Thompson M, et al: Resultados a médio prazo e remodelação da aorta após reparação endovascular torácica para dissecção aguda, subaguda e crónica da aorta: o Registo VIRTUE. Eur J Vasc Endovasc Surg 2014; 48: 363-371.
- Czerny M, Pacini D, Aboyans V, et al.Opções e recomendações actuais para a utilização da reparação endovascular da aorta torácica na doença aórtica torácica aguda e crónica: um documento de consenso de peritos do Grupo de Trabalho da Sociedade Europeia de Cardiologia (ESC) de Cirurgia Cardiovascular, do Grupo de Trabalho do ESC sobre Aorta e Doenças Vasculares Periféricas, da Associação Europeia de Intervenções Cardiovasculares Percutâneas (EAPCI) do ESC e da Associação Europeia de Cirurgia Cardíaco-Torácica (EACTS). Eur J Cardiothorac Surg 2021 Jan 4;59(1): 65-73.
CARDIOVASC 2022; 21(3): 6-12