A gama de doenças pulmonares intersticiais é ampla. Foram feitos progressos terapêuticos em muitas áreas durante a última década. No caso da fibrose pulmonar idiopática (IPF), não havia praticamente nenhuma possibilidade de oferecer uma terapia significativa aos pacientes afectados até ao início dos anos 2010. Entretanto, porém, estão disponíveis medicamentos que atrasam significativamente a progressão da doença.
Em Maio, foi renovada a directriz em língua alemã sobre o diagnóstico de ILD. “Doença pulmonar intersticial é um termo que ainda usamos, embora a doença parenquimatosa difusa do pulmão se encaixasse muito melhor no quadro”, disse o Prof. Apresentou o historial do caso de um dos seus pacientes, que utilizou para demonstrar como o procedimento de diagnóstico é classicamente realizado de acordo com as directrizes. Ele e um colega prestaram especial atenção ao diagnóstico diferencial de um ponto de vista radiológico.
O paciente foi exposto a isocianatos
Um paciente de 62 anos apresentou ao Prof. Pfeifer em Setembro de 2016 com uma suspeita de doença pulmonar intersticial. O principal sintoma era dispneia ao esforço, mas também um aumento da tosse irritável. Caso contrário, o homem não apresentou anomalias significativas, nem febre nem perda de peso, nem foram observadas queixas articulares, alterações de pele ou sintomas de doença.
A exposição a, por exemplo, animais de estimação ou mofo no ambiente familiar não estava presente, no entanto, o paciente trabalhava como moldador de plástico e estava assim exposto a isocianatos e vapores. No passado, uma clínica de reabilitação já tinha procurado o reconhecimento como doença profissional, mas esta foi rejeitada. O homem tinha alergias ao pólen das gramíneas, mas de resto não tinha um perfil de risco particular. Não bebia álcool e era um não fumador desde 1989, antes do qual tinha 10 anos de embalagem.

Sabia-se que as condições pré-existentes eram de hipertensão arterial e asma brônquica durante 15 anos, mas esta última era assintomática e não proeminente na altura da apresentação. Teve síndrome da apneia obstrutiva do sono com terapia nCPAP e cirurgia nasal no ano anterior. O doente tomava verapamil 120 mg, valsartan 160 mg, Symbicort 320/9 μg e salbutamol.
Ao exame, foi observado um crepitar inspiratório basal bilateral, caso contrário não foram encontradas anomalias particulares para além de obesidade e tensão arterial elevada. A medição da função pulmonar mostrou uma restrição na curva de fluxo-volume. TLC foi 73,5%, VC 70,7% e FVC 64,1%. A capacidade de difusão mostrou uma ligeira limitação.
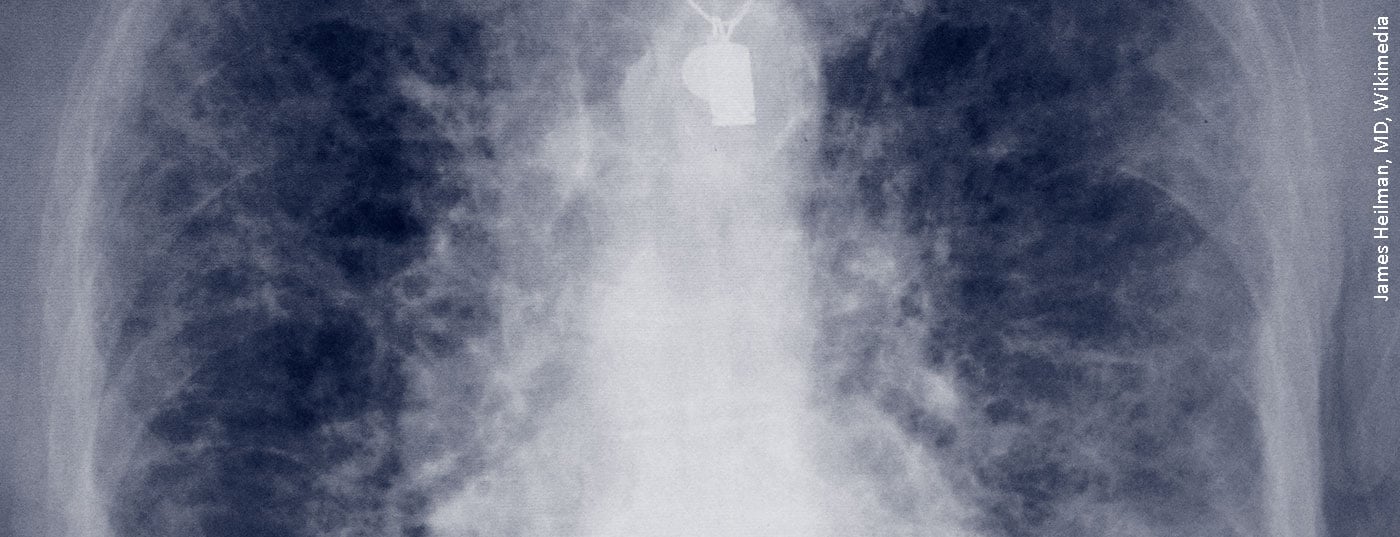
Clarificação radiológica na HRCT
A tomografia computorizada de alta resolução (TCAR) foi realizada no Departamento de Radiologia do Hospital Donaustauf. O Dr. Okka Hamer, Chefe da Radiologia, salientou que esta TC de fatias finas deve ser o padrão quando se trata de clarificar a DPI. A TCAR mostrou reticulações de ambos os lados, afectando a periferia do pulmão. “Esta imagem seria hoje classificada como provável, ou seja, provável UIP”, disse o Prof Hamer, devido às reticulações, bronquelectasias de tracção, falta de favos de mel seguros e falta de sinais que se opunham a um padrão UIP. Há quatro anos, os colegas do Conselho para as Doenças Pulmonares Intersticiais nomearam-no como possível, ou seja, possível UIP (Pneumonia Intersticial Comum) de acordo com a classificação da época. No entanto, a pneumonia intersticial não específica (NSIP) foi também discutida como um diagnóstico diferencial. Uma criobiopsia transbrônquica e uma apresentação reumatológica foram recomendadas para maiores esclarecimentos.
O laboratório de reumatologia mostrou o título de ANA a 1:320, o factor reumatóide foi 26,6 IU/ml (<15,0). Apesar destas anomalias, contudo, não foi encontrada nenhuma indicação clara de uma doença sistémica reumática inflamatória durante a apresentação reumatológica.
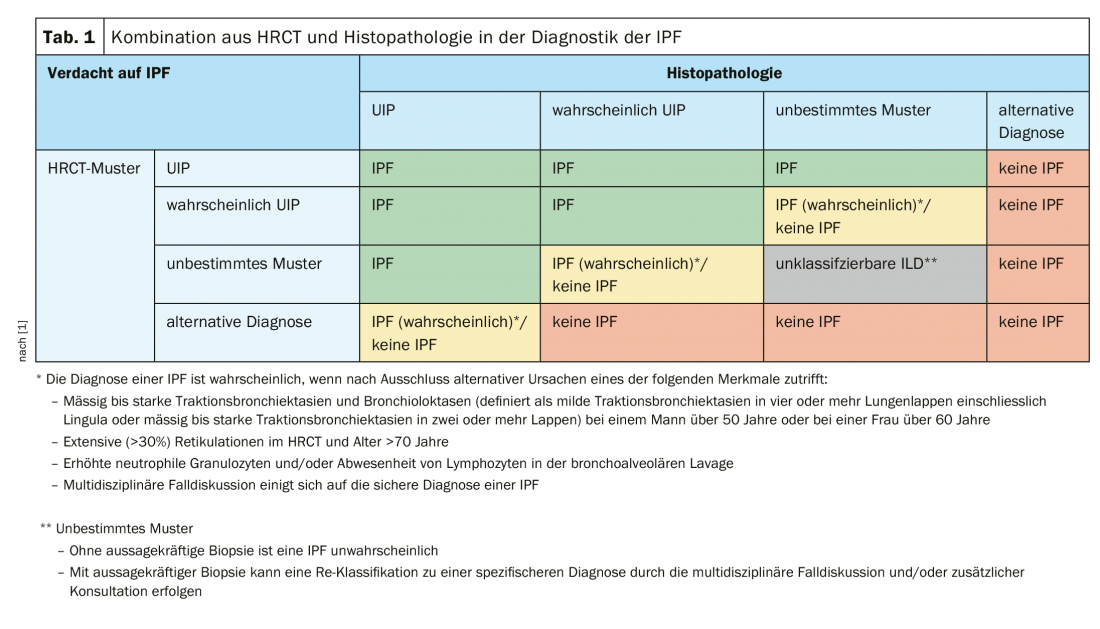
O procedimento dos médicos em 2016 também corresponde às directrizes das actuais directrizes S2k dos países de língua alemã (Fig. 1). Estes declaram que um lavado broncoalveolar (BAL) e uma criobiopsia devem ser realizados em doentes com suspeita de IPF e um padrão HRCT indeterminado ou alternativo para UIP. Pfeifer observou que, em contraste, a criobiopsia ainda é vista de forma muito crítica nas directrizes internacionais. Está listado mas só é recomendado em centros muito experientes. Em muitos países, o VATS (cirurgia toracoscópica video-assistida) continua a ser o método de primeira escolha.
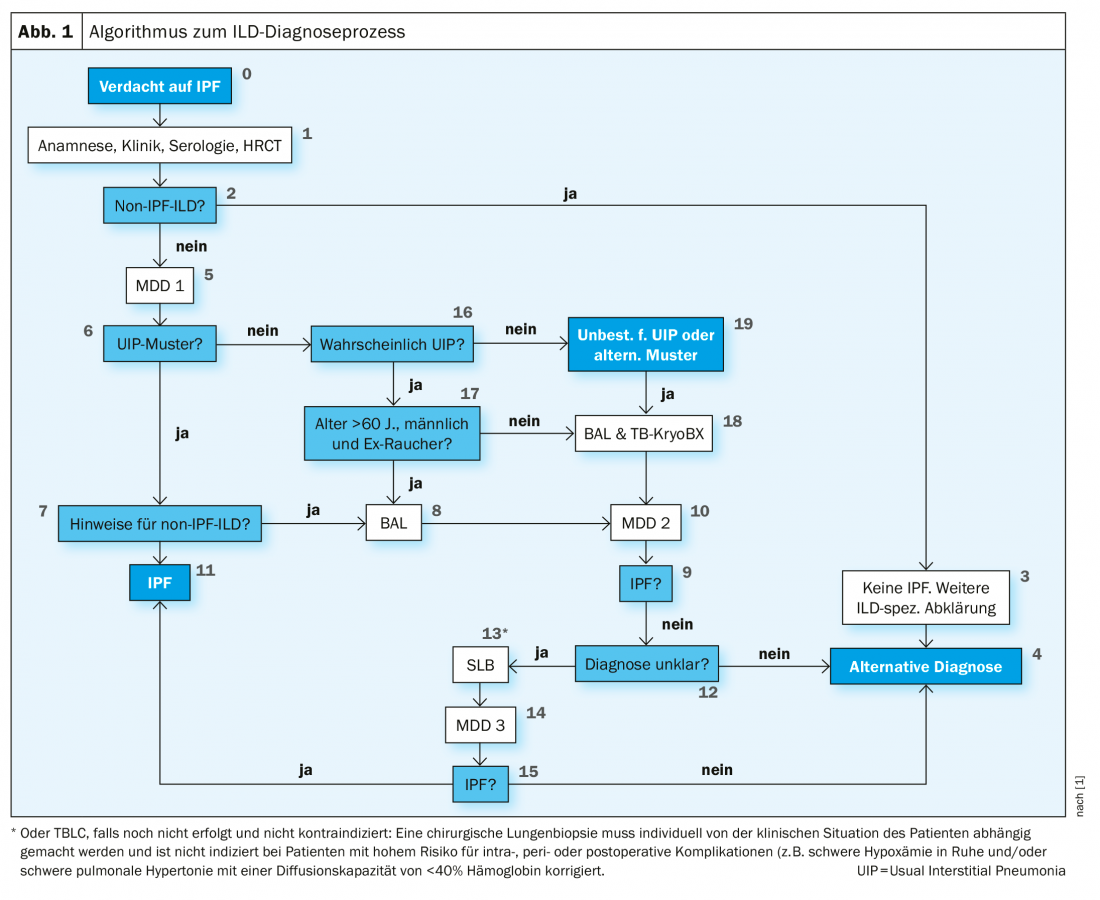
A terapia trouxe estabilização
No entanto, mesmo a criobiopsia não forneceu confirmação histológica no paciente. Nem um BAL que tinha sido levado a cabo levou ao objectivo. No Conselho de Administração do ILD seguinte, foi então decidido realizar um VATS. Aqui, o lobo superior mostrava enfisema pulmonar panacinar, por um lado, e o quadro de pneumonia crónica de hipersensibilidade, por outro, possivelmente no contexto da exposição ocupacional ao isocianato. Na zona do lobo inferior, havia um padrão UIP completo com nódulos alveolares e fibroblastos. Isto acabou por conduzir a uma terceira e última placa ILD na qual a presença do IPF foi assumida. Os médicos recomendaram iniciar a terapia antifibrótica com pirfenidona ou nintedanibe. Este procedimento reflecte também as recomendações da orientação S2k, que estipulam uma combinação de TCAR e histopatologia no diagnóstico da IPF (Tab. 1).
Sob terapia, foi observada uma estabilização significativa sem progressão entre o início de 2017 e o início de 2019. No entanto, em Março de 2019, o paciente foi diagnosticado com síndrome mielodisplásica com excesso de explosivos (MDS-EB 1) no contexto de uma reacção de febre. No entanto, após consulta com o hemato-oncologista, a terapia com o nintedanib continuou, mas o paciente acabou por morrer da doença. No entanto, os médicos tratantes não conseguiram encontrar qualquer prova de uma relação causal entre a terapia antifibrótica e a ocorrência da doença maligna do sangue.

Em resumo, este relatório de caso é um caso quase clássico, que pode ser utilizado como exemplo para ilustrar como tal caso pode ser processado de uma forma estruturada no trabalho diário e de acordo com as directrizes, a fim de o classificar e iniciar a terapia com base nesta classificação.
Fonte: Seminário online “Diagnóstico e terapia diferencial em ILD”, Boehringer Ingelheim Partner’s Satellite, streamed-up.com
Literatura:
- Behr J, et al: Pneumologia 2020; 74(5): 263-293; doi: 10.1055/a-1179-2905.
InFo PNEUMOLOGY & ALLERGOLOGY 2020; 2(3): 28-30 (publicado 22.9.20, antes da impressão).