A prevalência da doença hepática não-alcoólica (NAFLD) e da diabetes tipo 2 está a aumentar em todo o mundo. Obesidade, dislipidemia e resistência à insulina são os principais factores de risco para NAFLD e esteatohepatite (NASH). O rastreio específico e medidas adequadas podem reduzir as consequências e complicações específicas do fígado e relacionadas com a diabetes.
A doença hepática gorda não-alcoólica (NAFLD) é a causa mais comum de doença hepática crónica na Europa e nos EUA [1]. A NAFLD é considerada uma manifestação hepática de síndrome metabólica, mas também pode ocorrer independentemente. A obesidade é considerada um factor de risco comum para a NAFLD e a diabetes tipo 2 (Síntese 1) . “No grupo de diabéticos de tipo 2, a prevalência da NAFLD é duas vezes maior do que na população geral”, explica o PD Dr. Thomas Karrasch do Hospital Universitário Giessen e Marburg (D) referindo-se a um estudo publicado na revista Diabetes Care [22,23]. Por um lado, a diabetes promove a progressão da NAFLD para steatohepatite não alcoólica (NASH) e aumenta o risco de cirrose e carcinoma hepatocelular; por outro lado, a NAFLD está associada a um risco acrescido de desenvolvimento de diabetes tipo 2 [5].
O risco de progressão de doença hepática gorda é aumentado
Cerca de 30% dos doentes com NAFLD têm NASH e cerca de 10-20% da cirrose e várias formas de carcinoma hepatocelular (HCC) são atribuídas à NAFLD [2,3]. O aumento observado na incidência de HCC nos países industrializados ocidentais é atribuído, entre outras coisas, ao aumento da NAFLD e da NASH [4]. Num estudo, os diabéticos de tipo 2 tinham o dobro do risco de progressão da NAFLD [7]. Estudos recentes do Estudo Alemão sobre Diabetes indicam que especialmente o subtipo de diabetes severamente resistente à insulina mostra um aumento mais forte dos marcadores substitutos de fibrose nos primeiros 5 anos após o diagnóstico de diabetes [6]. A detecção de doentes NAFLD com uma constelação de risco para o desenvolvimento do CHC ganhará importância nos próximos anos, de acordo com a correspondente conclusão da versão de consulta da directriz S3 “Diagnóstico e terapia do carcinoma hepatocelular e dos carcinomas biliares” publicada em 2021. É importante identificar um risco acrescido de HCC com base em marcadores preditivos e monitorizá-lo no contexto da detecção precoce [8]. De acordo com a directriz alemã NAFLD, uma combinação de sistemas de avaliação laboratorial e demográfica e diagnósticos instrumentais não invasivos pode ser utilizada para este fim [3,10].
|
Actualmente, há muito em curso no campo da investigação de opções de medicamentos para o tratamento da NAFLD. Diferentes conceitos terapêuticos estão a ser testados experimentalmente e clinicamente, de modo que se podem esperar num futuro próximo recomendações terapêuticas específicas para o número crescente de doentes com NAFLD e diabetes [2,19]. De acordo com uma revisão publicada em 2021 no Journal Expert Review of Clinical Pharmacology , das substâncias activas actualmente em investigação, o ácido obetichólico mostra os resultados intermédios mais promissores nos estudos da fase III [15]. |
Detecção precoce: índice FIB-4 e NFS como pontuações não invasivas
Os pacientes em fases iniciais da NAFLD são geralmente assintomáticos. Foram introduzidas pontuações de substituição como o índice de fibrose-4 (FIB-4) e a pontuação de fibrose específica da NAFLD (NFS) para detectar pacientes em risco [11]. O NFS tem em conta a idade, o índice de massa corporal (IMC), a diabetes mellitus/impaired fasting glucose, a contagem de plaquetas, a albumina e o quociente de de-ritis (AST/ALT) [12]. Embora a pontuação FIB-4 seja mais fácil de calcular utilizando os parâmetros de idade, AST, ALT e contagem de plaquetas, o seu valor preditivo positivo é de apenas 65% em comparação com cerca de 90% no caso do NCCR [11]. Estes procedimentos não invasivos podem ser utilizados como testes complementares para determinar esteatose hepática e fibrose.
FibroScan® e PAC: procedimentos de diagnóstico com alta sensibilidade
O diagnóstico laboratorial da NAFLD pode ser indicado pela elevação da alanina-aminotransferase (ALT, GPT) com aspartato aminotransferase normal (AST, GOT), embora até dois terços dos doentes com NAFLD tenham enzimas hepáticas normais [13,14]. A sonografia do fígado pode revelar esteatohepatite mas não consegue distinguir entre NAFLD e NASH [11]. O Parâmetro de Atenuação Controlada (CAP), a elastografia transitória (FibroScan®) ou a ressonância magnética (MRI) do fígado têm uma sensibilidade mais elevada do que o ultra-som [10]. O CAP é um método não invasivo para quantificar NASH baseado na elastografia transitória, uma técnica que utiliza ultra-sons e ondas elásticas de baixa frequência cuja velocidade de propagação está intimamente relacionada com a rigidez dos tecidos [11].
Ressonância magnética para quantificação do teor de gordura hepática
As técnicas de RM não invasivas permitem a determinação precisa do teor de gordura do fígado e são actualmente preferidas à biopsia hepática para quantificação do teor de gordura [2]. Contudo, a biopsia hepática é ainda o método mais apropriado para diagnosticar alterações inflamatórias no contexto da HAS e é também considerada pioneira para o diagnóstico de fibrose hepática.
Um diagnóstico confirmado de NAFLD requer provas de fígado gordo por imagem (sonografia, ressonância magnética) ou histologia hepática. O critério para NAFL é uma proporção de 5% ou mais de hepatócitos gordos [16]. O diagnóstico diferencial deve excluir o consumo excessivo de álcool (ingestão de álcool nas mulheres <20 g/dia, nos homens <30 g/dia) e outras causas de danos hepáticos, tais como hepatite viral, esteato-hepatite alcoólica (ASH) e esteato-hepatite associada a drogas (DASH) [17].
| Ligação fisiopatológica entre as perturbações metabólicas e a NASH
Fisiopatologicamente, a NASH baseia-se em danos hepatocitários induzidos por lipídios, inflamação mediada por células imunitárias e fibrose hepática consecutiva [9]. A resistência à insulina e a obesidade favorecem a acumulação excessiva de gordura nos hepatócitos, aumentando a sensibilidade dos hepatócitos ao stress oxidativo, às endotoxinas e à acção das citocinas, resultando na inflamação dos tecidos [11]. Estes eventos promovem a transição da esteatose simples para a esteatose e para a esteatose e a NASH, respectivamente, que se caracteriza por esteatose, infiltração de células inflamatórias e balonamento de hepatócitos e necrose focal [17]. A inflamação crónica e os danos hepáticos podem levar a cirrose, insuficiência hepática e carcinoma hepatocelular. |
Redução do peso para reduzir o risco de progressão
Uma redução do peso corporal está associada a uma menor prevalência de NAFL e pode levar a uma redução da fibrose na NASH. Consequentemente, as mudanças alimentares e a actividade física são pilares importantes no tratamento da NAFLD, bem como na prevenção da progressão. A eficácia da intervenção no estilo de vida depende do grau de redução de peso alcançado. Uma perda de peso de cerca de 5% provoca uma diminuição de aproximadamente 30% no teor de gordura hepática [2]. Num estudo prospectivo ao longo de um período de 7 anos, foi demonstrado que uma redução do peso de 5% leva à remissão da doença em 75% dos doentes com NAFLD [18]. Nutricionalmente, recomenda-se uma redução de hidratos de carbono de absorção rápida, especialmente produtos que contêm fructos e ácidos gordos saturados [2]. Para além de uma dieta equilibrada, a actividade física regular (combinação de resistência e musculação) pode ter um efeito aditivo [19]. Em casos de obesidade grave e diabetes tipo 2, a cirurgia bariátrica pode levar a uma redução pronunciada do teor de gordura hepática em paralelo com a perda de peso.
Quais são as implicações farmacoterapeuticas?
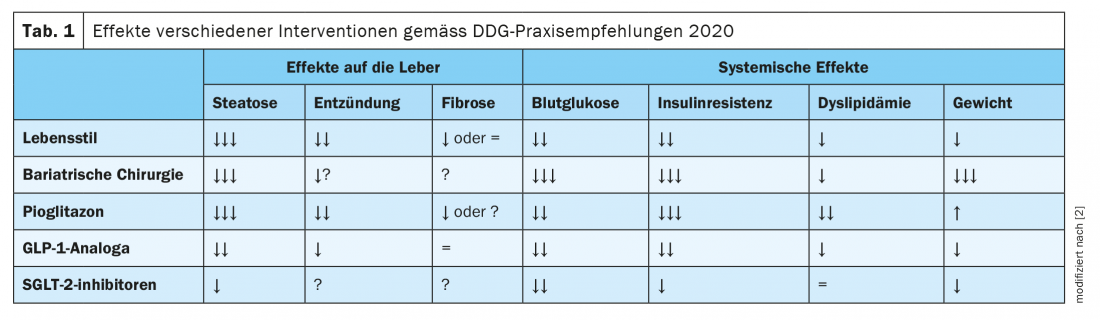
Embora ainda não tenha sido aprovada nenhuma terapia farmacológica para a NAFLD. No entanto, se a diabetes tipo 2 estiver presente, podem ser utilizados medicamentos específicos para tratar a diabetes, o que também tem um efeito benéfico na NAFLD. As directrizes conjuntas da Associação Europeia para o Estudo do Fígado (EASL), da Associação Europeia para o Estudo da Diabetes (EASD) e da Associação Europeia para o Estudo da Obesidade (EASO) bem como as da Associação Americana para o Estudo das Doenças do Fígado recomendam a utilização de pioglitazona se não houver contra-indicações (insuficiência cardíaca, historial de cancro da bexiga, aumento do risco de fracturas ósseas). [19,20]. Estudos demonstraram efeitos benéficos nos parâmetros relacionados com NAFLD tanto em diabéticos como em não diabéticos. “Pioglitazona é actualmente a droga com as melhores provas”, diz o Dr. Karrasch [23]. Entre outras descobertas, uma meta-análise de oito ensaios clínicos aleatórios envolvendo 516 doentes com NASH biopsia comprovada mostrou que a terapia com tiazolidinadiona (rosiglitazona ou pioglitazona) estava associada a um grau melhorado de fibrose e redução da NASH. Este efeito também foi observado em doentes sem diabetes [21]. Além disso, estudos recentes sugerem que os agonistas GLP-1 (peptídeo tipo glucagon 1) como o liraglutido e os inibidores SGLT-2 (transportador de glicose dependente do sódio 2) podem reduzir a gordura hepática na NAFLD e a diabetes tipo 2 [2]. As recomendações práticas da Sociedade Alemã de Diabetes (DDG) resumem os efeitos das diferentes intervenções sobre a NAFLD e a diabetes, que são apresentadas noquadro 1 [2].
Congresso: Conferência Anual da DGIM 2021
Literatura:
- Centro Alemão de Investigação da Diabetes, www.dzd-ev.de/forschung/ursachen-und-behandlung-der-nicht-alkoholischen-fettlebererkrankung-nafld/index.html, (acedido pela última vez em 16.06.2021)
- Stefan N, et al: Diabetes e fígado gordo. Diabetologia 2020; 15 (Suppl 1): S156-S159.
- Roeb E, et al: [S2k Guideline non-alcoholic fatty liver disease]. Z Gastroenterol, 2015. 53(7): 668-723.
- ASL Clinical Practice Guidelines: Gestão do carcinoma hepatocelular. J Hepatol 2018; 69(1): 182-236.
- Tomah S, Alkhouri N, Hamdy O: Doença hepática gordurosa não alcoólica e diabetes tipo 2: qual é a posição dos Diabetologistas? Clin Diabetes Endocrinol 2020; 6(9), https://doi.org/10.1186/s40842-020-00097-1
- Zaharia OP, et al: Risco de doenças associadas à diabetes em subgrupos de pacientes com diabetes recentemente detectada: um estudo de seguimento de 5 anos. Lancet Diabetes Endocrinol 2019; 7: 684-694.
- Simeone JC, et al: Curso clínico da doença hepática gorda não alcoólica: uma avaliação da gravidade, progressão, e resultados. Clin Epidemiol 2017(9) 679-688.
- AWMF: Versão de consulta da directriz S3 “Diagnóstico e terapia do carcinoma hepatocelular e dos carcinomas biliares”, www.leitlinienprogramm-onkologie.de (último acesso 16.06.2021)
- Hirsova P, Gores GJ : Morte celular mediada por receptor de morte e sinalização pró-inflamatória em esteato-hepatite não alcoólica. Célula Mol Gastroenterol Hepatol 2015; 1: 17-27
- Roeb E, Geier A: Esteato-hepatite não alcoólica (NASH) – recomendações de tratamento actuais e desenvolvimentos futuros. Z Gastroenterol 2019; 57(4): 508-517.
- Heitmann J, et al: Doença hepática gordurosa não alcoólica e psoríase – existe uma rede comum de pró-inflamatórios? JDDG 2021; 19(4): 517-529.
- Sterling RK, et al: Desenvolvimento de um índice simples não invasivo para prever uma fibrose significativa em doentes com infecção por HIV/HCV. Hepatol 2006; 43(6): 1317-1325.
- Weiß J, Rau M, Geier A. Doença hepática gorda não-alcoólica: epidemiologia, curso clínico, investigação, e tratamento. Dtsch Arztebl Int 2014; 111: 447-452.
- Dowman JK, Tomlinson JW, Newsome PN: Revisão sistemática: o diagnóstico e o estadiamento de doença hepática gorda não alcoólica e esteato-hepatite não alcoólica. Aliment Pharmacol Ther 2011; 33: 525-540.
- Rau M, Geier A: Uma actualização sobre o desenvolvimento de medicamentos para o tratamento de doenças não-alcoólicas do fígado gordo – desde os ensaios clínicos em curso até à terapia futura. Revisão de peritos em farmacologia clínica 2021; 14(3): 333-340.
- Roeb E: Esteatohepatite não-alcoólica: Fígado gordo com complicações | PZ – Pharmazeutische Zeitung (pharmazeutische-zeitung.de), https://www.pharmazeutische-zeitung.de/ausgabe-342018/fettleber-mit-komplikationen/, (último acesso 16.06.2021)
- Rau M, Geier A: Doença hepática, Gordura não alcoólica. In: Kuipers E: Enciclopédia de Gastroenterologia.2ª Edição. Oxford: Academic Press, Elsevier 2020: 408-413.
- Zelber-Sagi S, et al: Preditores da incidência e remissão da NAFLD na população em geral durante um acompanhamento prospectivo de sete anos. J Hepatol 2012; 56: 1145-1151.
- Stefan N, Häring HU, Cusi K: Doença hepática gorda não alcoólica: causas, diagnóstico, consequências cardiometabólicas, e estratégias de tratamento. Lancet Diabetes Endocrinol 2019; 7: 313-324.
- Associação Europeia para o Estudo do Fígado (EASL); Associação Europeia para o Estudo do Fígado (EASL); Associação Europeia para o Estudo da Diabetes (EASD); Associação Europeia para o Estudo da Obesidade (EASO). EASL-EASD-EASO Directrizes de prática clínica para a gestão de doenças hepáticas gordurosas não-alcoólicas. Diabetologia 2016; 59: 1121-1140.
- Musso G, et al: Thiazolidinediones e Fibrose Fígica Avançada em Esteato-hepatite Não Alcoólica: Uma Meta-análise. JAMA Intern Med 2017; 177(5): 633-640.
- Eslam M, et al.: Uma nova definição de doença hepática gorda associada à disfunção metabólica: Uma declaração de consenso de peritos internacionais. J Hepatol 2020; 73(1): 202-209.
- Karrasch T: NASH/NAFLD de uma perspectiva endocrinológica-diabetológica. PD Dr. Thomas Karrasch. Conferência Anual da DGIM, 20.04.2021.
HAUSARZT PRAXIS 2021; 16(3): 45-46 (publicado 29.6.21, antes da impressão).