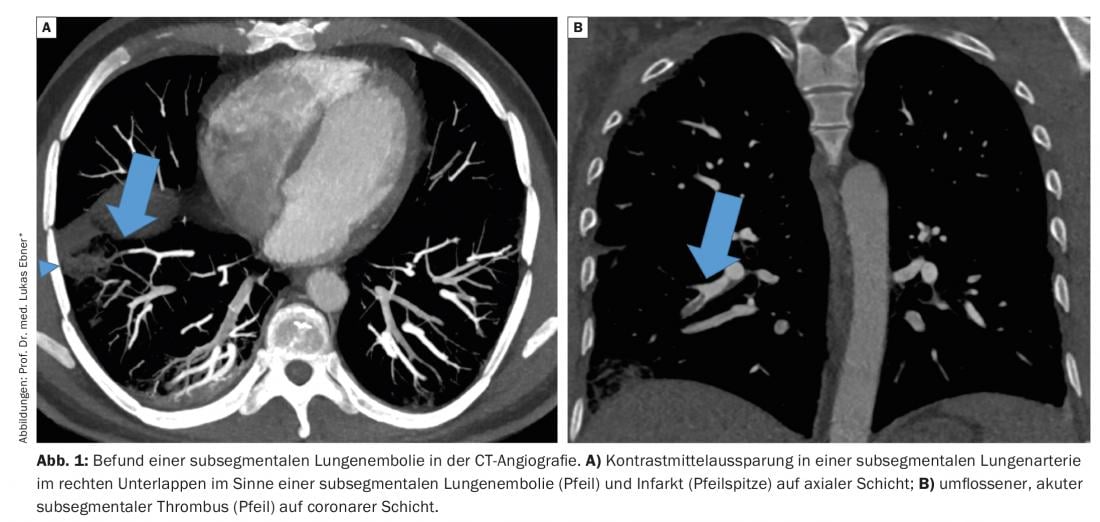
Os embolismos pulmonares (LE) são agrupados juntamente com tromboses venosas profundas como tromboembolismos venosos. Enquanto há 50 anos atrás, devido às limitadas possibilidades de diagnóstico, o diagnóstico era geralmente feito apenas post mortem ou com resultados clínicos claros tais como dispneia, dores no peito ou choque obstrutivo, o espectro da doença de LE mudou nas últimas décadas.
Os embolismos pulmonares (LE) são agrupados juntamente com tromboses venosas profundas como tromboembolismos venosos. Enquanto há 50 anos atrás, devido às limitadas possibilidades de diagnóstico, o diagnóstico era geralmente feito apenas post mortem ou com resultados clínicos claros tais como dispneia, dores no peito ou choque obstrutivo, o espectro da doença de LE mudou nas últimas décadas. Graças à rápida disponibilidade de testes de diagnóstico sensíveis, mesmo LE oligossintomática com queixas não específicas ou descobertas incidentais assintomáticas podem ser diagnosticadas, e não só podem ser visualizados embolias nas partes centrais da vasculatura pulmonar, mas também contrastar cavidades médias nas pequenas artérias pulmonares subsegmentárias – a chamada LE subsegmentária (Fig. 1). O significado clínico da LE subsegmental tem sido cada vez mais questionado nos últimos anos, e consequentemente o paradigma comum de que toda a LE requer uma terapia de anticoagulação tem sido desafiado. A seguir, discutimos a relevância clínica do LE subsegmental e resumimos as provas actuais sobre a terapia.
Sobrediagnóstico de embolias pulmonares clinicamente irrelevantes?
A introdução da angiografia CT multidetectores (CTA) no final dos anos 90 revolucionou o diagnóstico de LE e deslocou gradualmente outros procedimentos de diagnóstico. A maior resolução da AIC multidetectores em comparação com a cintilografia de ventilação/perfusão ou a AIC com detector único permite uma melhor visualização de pequenos vasos pulmonares, tais como as artérias pulmonares subsegmentárias, o que aumenta a sensibilidade para o diagnóstico de LE. Com a crescente disponibilidade de equipamento CT e a proliferação de exames CTA multidetectores, houve um aumento relevante nos diagnósticos LE: nos EUA, a incidência de LE aumentou 80% nos 8 anos que se seguiram à introdução da CTA multidetectores. Em contraste, a mortalidade diminuiu ligeiramente em 3% durante o mesmo período, sem qualquer alteração na prevalência dos factores de risco ou qualquer melhoria relevante no tratamento da LE. Ao mesmo tempo, contudo, houve também um aumento de 70% em complicações associadas à anticoagulação, tais como hemorragias gastrointestinais e intracranianas ou trombocitopénias secundárias. A mortalidade largamente estável com um aumento relevante dos diagnósticos de LE é indicativo de sobre-diagnóstico de LE clinicamente irrelevante. Uma explicação para isto é o aumento do diagnóstico de pequenos êmbolos, como o LE subsegmental, através dos métodos de diagnóstico mais sensíveis. Uma revisão sistemática mostrou que a percentagem de LE subsegmental com CTA multidetector duplicou em comparação com o CTA mais antigo (9,4% em comparação com 4,7%). Enquanto que com os CTAs multidetectores de 4 linhas os CTAs subsegmentais representavam 7,1% de todo o LE, com os CTAs multidetectores de 64 linhas já era de 15%. Estes resultados apoiam a hipótese de que os avanços tecnológicos nas técnicas de imagem são responsáveis pelo aumento do número de LE subsegmentais diagnosticados e têm contribuído para o aumento observado na incidência de LE. É provável que o LE subsegmental se torne ainda mais frequente à medida que a resolução dos novos scanners de TAC melhora.
Desafios no diagnóstico da embolia pulmonar subsegmentária
O diagnóstico correcto do LE subsegmental é difícil e a distinção entre o verdadeiro LE subsegmental e o artefacto nem sempre é clara. Isto foi ilustrado por um estudo que investigou o acordo entre radiologistas no diagnóstico de LE, dependendo da sua localização. Em contraste com o elevado acordo entre radiologistas no diagnóstico de LE proximal (kappa=0,83), era pobre para LE subsegmental (kappa=0,23). Num outro estudo, o LE subsegmental diagnosticado pela ATC foi comparado com um padrão de referência de múltiplas modalidades de exame: o valor preditivo positivo da ATC para o diagnóstico de embolia nas artérias pulmonares subsegmentares foi de apenas 25%. Cerca de 10-15% do LE subsegmental diagnosticado são interpretados como falsos positivos na segunda avaliação. Enquanto um estudo recentemente publicado mostrou mesmo uma taxa de falso-positivo superior a 50%, 8% dos resultados supostamente negativos do CTA não foram detectados LE subsegmental (resultados falsos-negativos). Estas descobertas sublinham a importância da boa qualidade de imagem para uma interpretação correcta das descobertas da AIC, porque o contraste subóptima, os artefactos respiratórios, a obesidade ou os tampões de muco podem influenciar negativamente a qualidade da imagem e, assim, levar a descobertas incorrectas e a um sobrediagnóstico do LE subsegmental. Um diagnóstico de LE falso-positivo não só resulta numa terapia anticoagulante desnecessária, muitas vezes vitalícia, com os efeitos secundários conhecidos, mas também pode ter outros efeitos negativos, tais como stress emocional ou exames de seguimento desnecessários.
Há provas de que a sensibilidade dos dímeros D é mais baixa em relação a um LE mais proximal. Num estudo de diagnóstico, entre os doentes com baixa probabilidade de pré-teste clínico e os dímeros D <1000 µg/l que foram confirmados como tendo LE, 10 de 11 encontravam-se em localização subsegmentária. Usando o algoritmo YEARS para o diagnóstico LE, onde um D-dímero D mais alto de 1000 µg/l é o limiar para realizar a AIC com baixa probabilidade de pré-teste clínico com base em 3 variáveis, são diagnosticados menos LE subsegmentais do que com um algoritmo baseado no habitual corte do D-dímero de 500 µg/l. A utilização de limiares de D-dímeros ajustados à idade leva também a uma redução no diagnóstico do LE subsegmental.
A circulação pulmonar como um filtro fisiológico?
Alguns peritos têm colocado a hipótese de que a circulação pulmonar, como filtro fisiológico, tem a tarefa de impedir a entrada de pequenos coágulos na circulação arterial. De acordo com esta hipótese, pequenos LE como os das artérias pulmonares subsegmentares poderiam também ocorrer em indivíduos saudáveis como resultado desta função de filtragem fisiológica. Num estudo de voluntários saudáveis, 16% tinham defeitos de perfusão na cintilografia pulmonar. Observações angiográficas mais antigas sobre o curso natural do LE mostram que embolias ainda maiores podem ser espontaneamente reabsorvidas por processos fibrinolíticos endógenos dentro de semanas.
Terapia anticoagulante: benefícios e riscos
Com base na evidência de sobrediagnóstico de LE, no risco de falsos positivos e na relevância clínica incerta de LE subsegmentária, não é claro se todas – incluindo as LE subsegmentárias – requerem terapia. O tratamento padrão habitual para o tromboembolismo venoso é a anticoagulação durante pelo menos 3 meses. Embora esta terapia seja muito eficaz na redução do risco de recorrência tromboembólica em 80-90%, também aumenta o risco de hemorragia. O risco anual de hemorragia grave situa-se entre 1-5%, dependendo das características do paciente. A hemorragia grave está associada a uma mortalidade de cerca de 11%, e em particular a hemorragia intracraniana, que representa cerca de 10% da hemorragia grave, conduz a uma morbilidade relevante com incapacidade potencial para toda a vida. O pequeno sangramento ocorre em quase metade dos pacientes em terapia de anticoagulação e não é apenas uma causa de stress e de redução da qualidade de vida, mas também um fardo para o sistema de saúde devido ao aumento de visitas, intervenções médicas e custos adicionais.
Devido aos efeitos das complicações hemorrágicas, os benefícios e riscos da terapia de anticoagulação devem ser sempre cuidadosamente ponderados, o que é especialmente verdadeiro para o tromboembolismo de relevância clínica pouco clara. Utilizando o exemplo de trombose venosa profunda distal isolada, poderia ser demonstrado que nem todos os pacientes com tromboembolismo venoso pequeno requerem terapia de anticoagulação. Em >90% das tromboses isoladas das veias distais das pernas, sem tratamento, não há extensão para os segmentos mais proximais das veias, no sentido de trombose das veias proximais das pernas, nem outras complicações. Num ensaio aleatório controlado com placebo em doentes de baixo risco com trombose sintomática isolada da veia distal da perna, a terapia de anticoagulação não foi superior ao placebo para prevenir o tromboembolismo venoso, mas aumentou significativamente o risco de hemorragia.
Nos últimos anos, a relação risco-benefício da terapia de anticoagulação também tem sido cada vez mais questionada em doentes com LE submersivo, uma vez que pequenos estudos observacionais têm descrito cursos sem complicações em doentes com LE submersivo mesmo sem anticoagulação.
Curso clínico em LE subsegmental com e sem anticoagulação
Se o prognóstico difere para o LE subsegmental ou mais proximal é controverso na literatura. Dados de estudos prospectivos mostraram um risco semelhante de recorrência tromboembólica, mortalidade e hemorragia em doentes anticoagulados não seleccionados, independentemente da localização anatómica do LE. Embora estes estudos não sugiram diferenças nos resultados clínicos em doentes tratados com LE submergmental ou mais proximal, não respondem à questão de se o prognóstico difere na LE submergmental com ou sem terapia de anticoagulação. Além disso, estes estudos não procuraram sistematicamente a trombose venosa profunda; como a trombose venosa profunda não diagnosticada pode aumentar o risco de recidiva tromboembólica, não fornecem dados prognósticos robustos para LE sub-mecânica isolada (sem concomitante trombose das veias da perna).
O LE subsegmental é falhado em muitos casos por certos procedimentos de diagnóstico sem quaisquer efeitos adversos (sem tratamento!). Num ensaio aleatório, os pacientes com suspeita de LE foram avaliados por CTA multidetectores, CTA monodetectores ou por cintilografia de ventilação/perfusão. Embora mais LE tenham sido diagnosticadas e assim tratadas com CTA multidetectores em comparação com as outras duas modalidades, não houve diferença no risco de recorrência do tromboembolismo após 3 meses nos pacientes não tratados nos 3 grupos. O LE adicional diagnosticado pelo CTA multidetector foi assim clinicamente insignificante. Esta observação fornece provas indirectas de que nem todos os LE pequenos e subsegmentares são clinicamente relevantes e requerem uma terapia de anticoagulação. A Sociedade Americana de Hematologia, por exemplo, nas suas directrizes publicadas em 2018, prefere realizar a cintilografia de ventilação/perfusão planar em vez da CTA para o diagnóstico de LE em determinadas situações, uma vez que esta última não só está associada ao aumento da exposição à radiação, como também leva a mais diagnósticos de LE submergíveis com significado clínico pouco claro.
Vários pequenos estudos de observação retrospectiva compararam o curso clínico com e sem anticoagulação em pacientes com LE subsegmental. Recentemente, 14 destes estudos foram resumidos numa revisão sistemática e meta-análise. Em 715 pacientes com LE subsegmental, não houve diferença significativa na recorrência ou mortalidade tromboembólica com ou sem anticoagulação (Tabela 1) . Estes resultados sugerem que os pacientes com LE subsegmental têm um prognóstico semelhante aos pacientes com terapia, mesmo sem terapia de anticoagulação. No entanto, os estudos incluídos têm limitações metodológicas relevantes (pequena dimensão da amostra, na sua maioria concepção de estudo retrospectivo), as populações de estudo incluídas eram muito heterogéneas e os critérios para a decisão de tratamento eram na sua maioria desconhecidos, razão pela qual os grupos de doentes com e sem anticoagulação são dificilmente comparáveis. Não existem actualmente dados de ensaios randomizados sobre a segurança de uma estratégia terapêutica sem anticoagulação.
O risco de hemorragia associado à anticoagulação merece especial atenção dada a questionável relevância do LE subsegmental. O risco de hemorragia relevante é altamente variável em doentes anticoagulados com LE subsegmentária e é relatado entre 1,7% e 34% dependendo das características do doente e da definição de hemorragia.

Gestão de pacientes com embolia pulmonar subsegmentária: o que dizem as directrizes?
Com base nas provas limitadas actualmente disponíveis, várias sociedades profissionais e grupos de peritos publicaram recomendações para o tratamento de doentes com LE submersivo nos últimos anos. As directrizes do American College of Chest Physicians (ACCP) sugerem um acompanhamento clínico sem terapia anticoagulante em pacientes seleccionados de baixo risco com LE sub-germental se for excluída a coexistência de trombose venosa profunda (recomendação fraca com evidência profunda). Se a ultra-sonografia de compressão for utilizada para avaliar apenas as veias proximais das pernas para a presença de trombose venosa profunda, são necessárias uma ou mais ultra-sonografias de curso para excluir a trombose de disseminação proximal. Em pacientes de alto risco (definidos como aqueles sem factores de risco reversíveis, pacientes imóveis ou hospitalizados, ou aqueles com cancro activo ou reservas cardiopulmonares insuficientes), a terapia anticoagulante deve ser preferida. É aconselhável incluir o risco de hemorragia na decisão de tratamento. Do mesmo modo, o American College of Emergency Physicians recomenda uma estratégia de tratamento individualizado com base no perfil de risco do paciente. A Sociedade Europeia de Cardiologia (ESC) recomenda que o diagnóstico de LE subsegmental seja confirmado por um radiologista de tórax experiente. Em pacientes ambulatórios sem cancro e sem trombose concomitante das veias das pernas, recomenda-se uma estratégia de monitorização clínica sem anticoagulação se apenas estiver presente um único LE subsegmental, enquanto que em todos os outros (incluindo pacientes com múltiplos LEs subsegmentais) é sugerida a anticoagulação. Não há provas para estas diferentes recomendações de tratamento em função do número de LE subsegmentais, e esta distinção não é feita em outras directrizes e recomendações de peritos.
Apesar destas recomendações de orientação, a maior parte dos pacientes com LE submergmental isolado são hoje anticoagulados, e a duração da terapia não difere dos pacientes com LE localizada proximalmente. Uma das razões possíveis para tal é a limitada evidência para uma estratégia de tratamento sem anticoagulação – até à data, faltam dados de estudos prospectivos ou randomizados suficientemente grandes e de alta qualidade.
Perspectivas
Um ensaio internacional de gestão prospectiva em curso está a investigar uma estratégia de tratamento sem anticoagulação em doentes de baixo risco com LE subsegmental que tiveram trombose venosa profunda proximal excluída por ultra-sonografia de compressão em série (ClinicalTrials.gov NCT01455818). Na Suíça, o ensaio SAFE-SSPE começou recentemente, um ensaio aleatório de não-inferioridade no qual pacientes de baixo risco com LE submergmental isolado (ou seja, sem trombose venosa profunda) são randomizados para terapia de anticoagulação ou placebo -(ClinicalTrials.gov NCT04263038). Os dois grupos de tratamento serão monitorizados clinicamente durante 90 dias e comparados em termos de risco de recorrência tromboembólica, hemorragia, mortalidade, qualidade de vida e pontos finais económicos. O estudo fornecerá informação sobre a possibilidade de evitar tratamentos desnecessários com anticoagulantes sanguíneos em doentes seleccionados com LE, reduzindo assim o risco de hemorragia. Se uma estratégia de tratamento sem anticoagulação se revelar segura, o estudo poderia iniciar um afastamento do actual paradigma da terapia de anticoagulação para todas as LE.
Até estarem disponíveis resultados robustos de estudos sobre a terapia óptima para pacientes com LE sub-membramental, é importante evitar o sobrediagnóstico e o sobretratamento. Investigações CTA desnecessárias podem ser evitadas utilizando algoritmos de diagnóstico validados com determinação da probabilidade de pré-teste clínico e testes de D-dímero. Para testes de D-dímeros de alta sensibilidade, os cut-offs ajustados à idade, que demonstraram ser seguros em ensaios aleatórios, podem contribuir ainda mais para a redução das tomografias computorizadas, o que por sua vez leva a uma redução da prevalência do LE subsegmental. O mesmo se aplica ao algoritmo YEARS acima mencionado, que é mais fácil de utilizar e pode, portanto, também melhorar a aderência ao procedimento de diagnóstico correcto quando se suspeita de LE. Outra forma de reduzir o sobrediagnóstico é utilizar o algoritmo PERC baseado em 8 critérios clínicos em pacientes com baixa suspeita clínica de LE. Se nenhum dos 8 critérios for positivo, podem ser omitidos mais diagnósticos nesta população de baixo risco sem faltar LE relevante, como demonstrou um estudo aleatório recentemente publicado. Devido aos desafios no diagnóstico do LE subsegmental explicado acima, o diagnóstico deve ser confirmado por um segundo radiologista experiente antes de ser tomada uma decisão de tratamento – nem todas as suspeitas de LE subsegmental são genuínas! A dificuldade diagnóstica do LE subsegmental foi recentemente abordada com a publicação de critérios radiológicos que devem ser considerados quando se faz um diagnóstico utilizando o CTA. De acordo com a Sociedade Americana de Hemtologia, a cintilografia de ventilação/perfusão plana também deve ser preferida à AIC como modalidade de diagnóstico de escolha em pacientes com probabilidade de pré-teste baixa ou moderada e elevada probabilidade de uma descoberta conclusiva, entre outras razões, para reduzir o risco para o diagnóstico de LE subsegmental. Se o LE subsegmental for confirmado, uma estratégia terapêutica sem anticoagulação pode ser avaliada em doentes seleccionados com um risco profundo de recorrência e complicação após a exclusão de trombose venosa profunda, especialmente tendo em conta as preferências do doente e o risco de hemorragia (Fig. 2). Isto requer ultra-sonografia de compressão das veias das pernas de ambos os lados, embora a estratégia óptima não seja conhecida (ultra-sonografia de compressão única de todas as veias proximais e distais das pernas versus ultra-sonografia de compressão em série apenas das veias proximais das pernas).
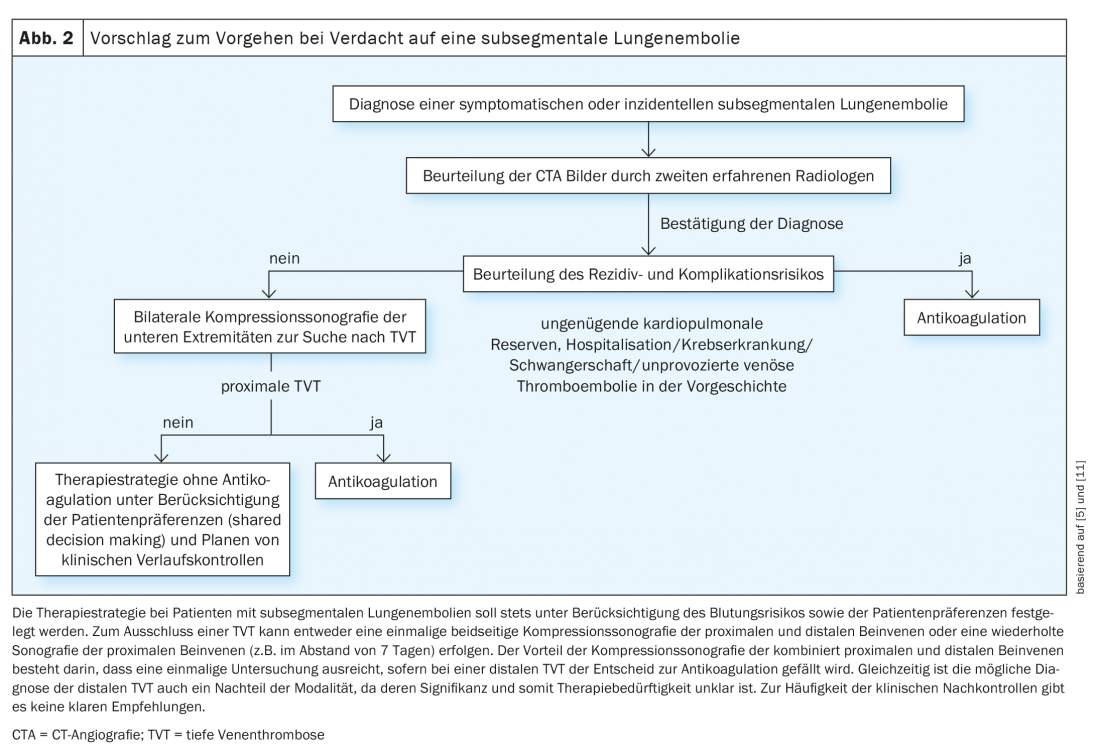
Em resumo, o significado clínico do LE subsegmental é pouco claro e controverso devido à fraca base de evidência sobre a terapia óptima. Dado o benefício incerto da terapia de anticoagulação em pacientes com LE subsegmentária e baixo risco de recorrência e complicações, os resultados de ensaios prospectivos e aleatorizados de alta qualidade serão de particular importância para evitar complicações hemorrágicas potencialmente desnecessárias associadas à anticoagulação e para ajudar a melhorar a qualidade dos cuidados de saúde.
Mensagens Take-Home
- Com o aumento dos exames CT e o progresso técnico, a incidência de embolias pulmonares subsegmentares (LE) aumentou ao longo dos anos; elas representam actualmente cerca de 15% de todas as LE.
- O significado clínico do LE submarino isolado não é claro.
- A estratégia de tratamento óptima para o LE submergmental isolado (sem trombose venosa profunda concomitante) é controversa devido à insuficiência de provas.
- As directrizes actuais sugerem uma estratégia de tratamento sem anticoagulação em doentes com LE subsegmentária, desde que se exclua a trombose venosa profunda simultânea e haja um risco profundo de recidiva e complicações.
Literatura:
- Wiener RS, Schwartz LM, Woloshin S: Quando um teste é demasiado bom: como os angiogramas pulmonares por TC encontram embolias pulmonares que não precisam de ser encontradas. BMJ 2013; 347: f3368.
- Wiener RS, Schwartz LM, Woloshin S: Tendências temporais na embolia pulmonar nos Estados Unidos: evidência de sobre-diagnóstico. Arquivos de Medicina Interna 2011; 171(9): 831-837.
- Carrier M, Righini M, Wells PS, et al: Embolia pulmonar subsegmental diagnosticada por tomografia computorizada: incidência e implicações clínicas. Uma revisão sistemática e uma meta-análise dos estudos dos resultados da gestão. Journal of Thrombosis and Haemostasis: JTH 2010; 8(8): 1716-1722.
- van der Pol LM, Bistervels IM, van Mens TE, et al: Prevalência mais baixa de embolia pulmonar subsegmentária após a aplicação do algoritmo de diagnóstico YEARS. British Journal of Haematology 2018; 183(4): 629-635.
- Kearon C, Akl EA, Ornelas J, et al: Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Peito 2016; 149(2): 315-352.
- Portador M, Righini M, Le Gal G: Embolia pulmonar sintomática subsegmentária: qual é o próximo passo? Journal of Thrombosis and Haemostasis: JTH 2012; 10(8): 1486-1490.
- Stoller N, Limacher A, Mean M, et al: Apresentação clínica e resultados em doentes idosos com embolia pulmonar submarina isolada sintomática. Thrombosis Research 2019; 184: 24-30.
- Lim W, Le Gal G, Bates SM, et al: American Society of Hematology 2018 guidelines for management of venous thromboembolism: diagnostic of venous tromboembolism. Blood Advances 2018; 2(22): 3226-3256.
- Bariteau A, Stewart LK, Emmett TW, Kline JA: Revisão sistemática e meta-análise dos resultados de pacientes com embolia pulmonar subgmentária com e sem tratamento anticoagulante. Acad Emerg Emerg Med 2018.
- Baumgartner C, Klok FA, Carrier M, et al: Clinical Surveillance vs. Anticoagulation For low-risk patiEnts with isolated SubSegmental Pulmonary Embolism: protocol for a multicentre randomised placebo-controlled non-inferiority trial (SAFE-SSPE). BMJ Aberto 2020; 10(11): e040151.
- Swan D, Hitchen S, Klok FA, Thachil J: O problema do sub-diagnóstico e do sobre-diagnóstico da embolia pulmonar. Thrombosis Research 2019; 177: 122-129.
InFo PNEUMOLOGIA & ALERGOLOGIA 2021; 3(1): 4-8