O tratamento da EM, a doença auto-imune do sistema nervoso central que mais frequentemente leva à incapacidade na idade adulta jovem, fez muitos pequenos e também alguns avanços maiores nas últimas duas décadas. O panorama terapêutico mudou significativamente, de modo que agora estão disponíveis diferentes opções terapêuticas com diferentes mecanismos de acção.
A esclerose múltipla ainda não pode ser curada, apesar de muitos avanços terapêuticos, mas pode muitas vezes ser controlada. O tratamento da doença auto-imune do sistema nervoso central, que mais frequentemente leva à incapacidade na idade adulta jovem, fez muitos pequenos e também alguns avanços maiores nas últimas duas décadas, e o panorama terapêutico mudou significativamente, de modo que agora estão disponíveis diferentes opções terapêuticas com diferentes mecanismos de acção. Assim, a heterogeneidade da doença e as características e necessidades do paciente individual podem ser melhor abordadas.
Desde o final de 2020, foi aprovado na Suíça um novo medicamento para o tratamento da esclerose múltipla recorrente (RRMS), que será examinado em mais pormenor neste artigo da CME. Este é o ozanimod, um modulador selectivo do receptor de esfingosina-1-fosfato (S1P) que se liga especificamente aos subtipos 1 e 5 do receptor S1P. Como resultado, os linfócitos são retidos na periferia e já não podem intervir no processo inflamatório no sistema nervoso central (SNC); além disso, mecanismos adicionais de acção no SNC são potencialmente concebíveis. O medicamento é aprovado na Suíça como terapia de primeira linha para pacientes adultos RRMS.
O mecanismo de acção de Ozanimod em resumo
Na EM, a entrada de certas células inflamatórias através de certas barreiras no sistema nervoso central (SNC) é um ponto chave que pode ser influenciado com ozanimod. Ozanimod, como modulador selectivo do receptor de esfingosina-1-fosfato (S1P), retém estas células inflamatórias em órgãos linfóides secundários (tais como gânglios linfáticos ou baço). A ligação de ozanimod aos receptores S1P em linfócitos imaturos leva à activação e internalização destes receptores. Como resultado, a saída dos linfócitos dos gânglios linfáticos para a corrente sanguínea é inibida, pelo que o número de linfócitos no sangue diminui e estes já não podem intervir no processo inflamatório no SNC; são também concebíveis outros mecanismos de acção directa do SNC, por exemplo, sobre a função das células gliais.
Diferença em relação a outros moduladores de receptores S1P
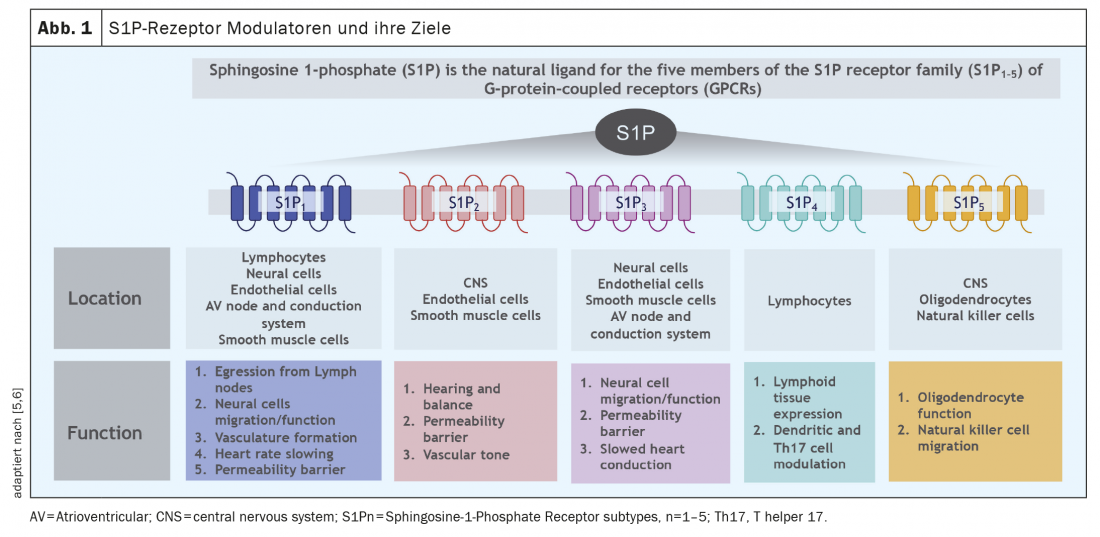
Além de ozanimod, existem outros dois moduladores de receptores S1P no panorama terapêutico suíço da EM: Fingolimod e siponimod. Uma característica comum a estas substâncias é a ligação aos receptores S1P, pelo que existe uma selectividade diferente para os subtipos de receptores individuais, dependendo da substância. Enquanto ozanimod se liga altamente selectivamente à subfamília receptora S1P1 e S1P5, o fingolimod não se liga selectivamente a dois escolhidos, mas mais especificamente a todos os 5 subtipos de receptores S1P, ao receptor S1P2 com baixa afinidade (ver abaixo). Contudo, dependendo da célula e do tecido, os subtipos dos receptores S1P são expressos de forma diferente; uma visão geral da distribuição destes receptores é dada na Figura 1. Em resumo, os receptores S1P1 encontram-se principalmente nos linfócitos, enquanto que o receptor S1P5 é expresso principalmente no SNC. Assim, a ligação selectiva a estes subtipos receptores também faz sentido do ponto de vista fisiopatológico. Tal como o ozanimod, o siponimod liga-se selectivamente aos receptores S1P1 e S1P5, mas os medicamentos diferem na farmacocinética (o ozanimod é largamente degradado em 2 metabolitos activos em poucas horas) e possivelmente também na selectividade para os subtipos receptores, uma vez que o ozanimod liga-se selectivamente in vitro com alta afinidade especialmente aos receptores S1P1 e menos aos receptores S1P5 [1].
Pontos finais de uma terapia eficaz da EM
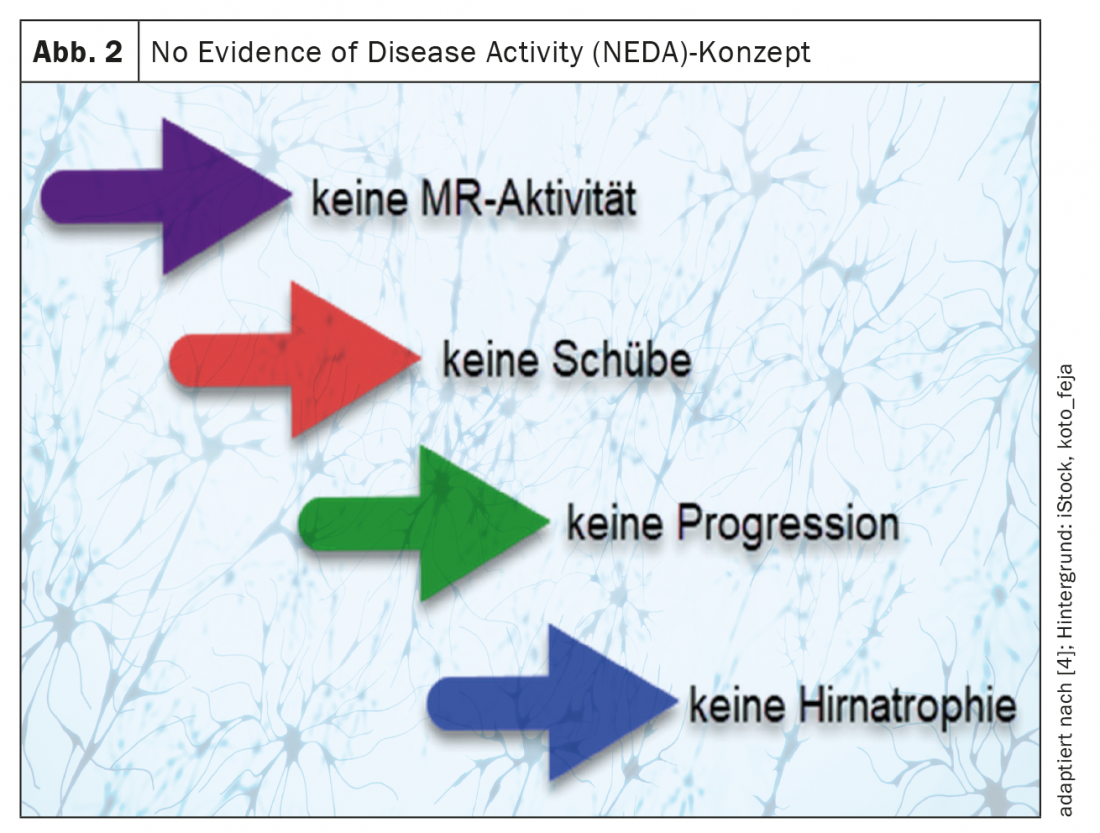
Hoje em dia, graças a imunoterapias eficazes, podem ser estabelecidos objectivos terapêuticos mais elevados do que os previstos há algumas décadas atrás. Um conceito comum, especialmente em estudos terapêuticos, é o conceito “No Evidence of Disease Activity” (NEDA) [2,3].
Aqui por
- Sem actividade de RM (lesões novas e/ou alargadas T2 hiperintensas e/ou lesões absorventes de contraste T1),
- sem eventos de empuxo,
- nenhuma progressão rasteira na Escala de Estado de Deficiência Expandida (EDSS) (“NEDA3”) [2–4] e frequentemente também
- nenhuma atrofia cerebral definida como objectivos terapêuticos (“NEDA 4”) (Fig. 2) [2– 5].
No entanto, devido a dificuldades metodológicas e técnicas, a medição da atrofia cerebral quantitativa ainda não é realizada regularmente na prática clínica [10,11]. Além disso, o conceito NEDA 3 é principalmente impulsionado pela actividade imagiológica, que deve ser vista criticamente de uma perspectiva clínica. Na prática clínica diária, o foco tem sido até agora em pontos finais que podem ser regularmente objectivados sem muito esforço, como o EDSS, mas aspectos como a cognição ou a fadiga também estão a receber mais atenção. Cada vez mais, a RM (craniana) está a ser utilizada como um instrumento sensível para a avaliação da eficácia e da segurança. A médio prazo, a medição quantitativa da atrofia cerebral (por exemplo, graças à segmentação automática das secções cerebrais por “aprendizagem mecânica”) também encontrará provavelmente cada vez mais o seu caminho na prática clínica diária [11].
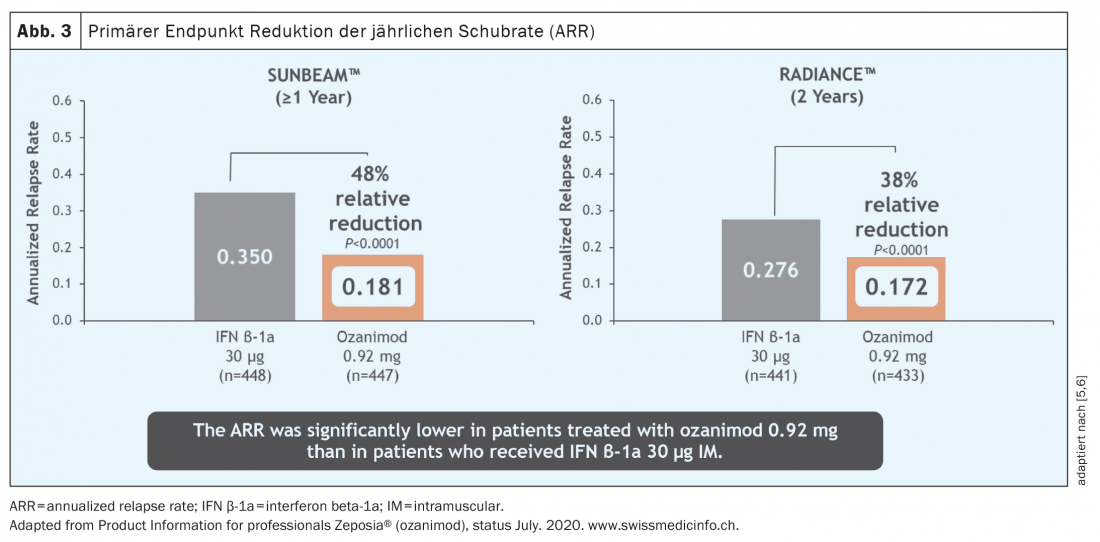
No que diz respeito aos dados do estudo, a qualidade do estudo é também particularmente importante. Com ozanimod, por exemplo, dois grandes estudos diferentes foram conduzidos em paralelo. Se, como no caso do ozanimod, ambos os estudos chegarem essencialmente aos mesmos resultados, então pode assumir-se uma situação de estudo robusta. Os dois estudos relevantes para aprovação, RADIANCE [5] e SUNBEAM [6], são estudos multicêntricos, duplo-cegos e duplo-cegos da fase 3 comparando o ozanimod com o interferon beta1a do comparador activo e diferem principalmente nos diferentes períodos de observação de 24 e 12 meses, respectivamente.
Eficácia de Ozanimod
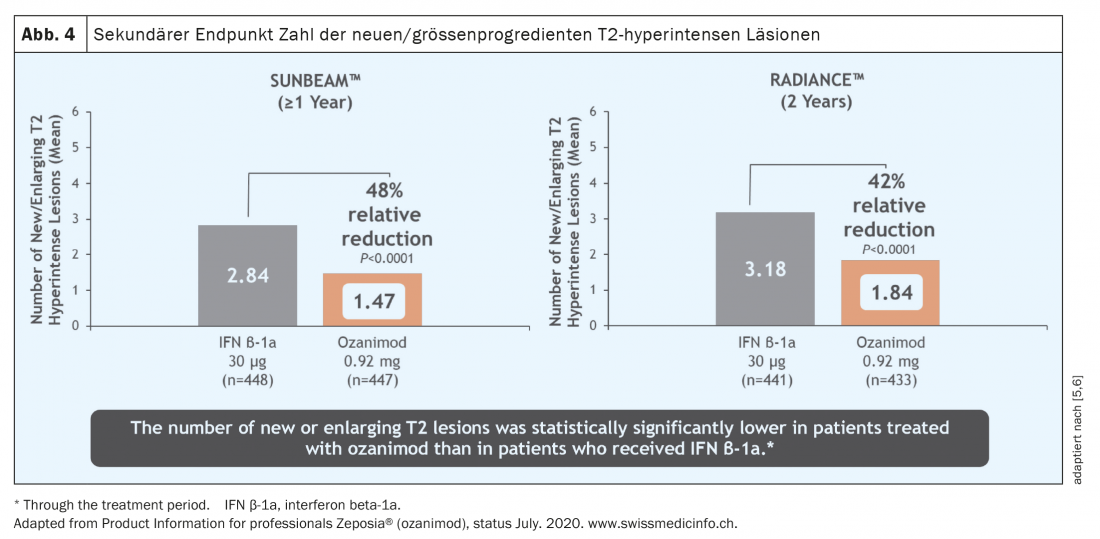
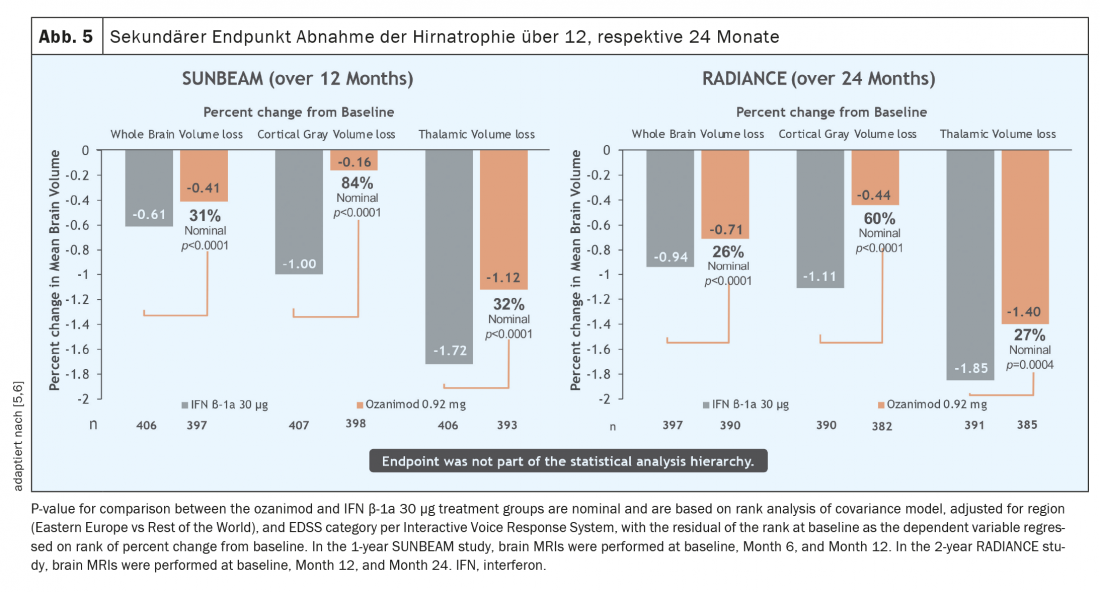
Durante um período de um e dois anos, a taxa de recidivas foi significativamente reduzida numa população de doentes que estava activa antes do início da terapia (Fig. 3) [5 – 7]. É de salientar que nestes estudos o ozanimod não foi testado contra placebo mas sim contra um comparador activo (interferon beta-1A Avonex®), o que realça a eficácia clínica do ozanimod. Além disso, foi observada uma redução significativa da actividade inflamatória detectável por MR-tomografia (Fig. 4) . No entanto, durante o período de estudo relativamente curto de 12 e 24 meses respectivamente, não foi possível demonstrar qualquer efeito na progressão da deficiência. No entanto, os dados tomográficos iniciais de ambos os estudos mostraram um efeito em termos de atrofia cerebral total, atrofia talâmica e atrofia cortical (Fig. 5) . Além disso, foi observada uma velocidade de processamento cognitivo mais rápida em doentes com ozanimod do que no grupo de comparação, fornecendo assim as primeiras indicações de um possível efeito positivo também nos pontos finais cognitivos. Assim, para além dos parâmetros “clássicos” como a carga de lesão T2 e eventos de recaída, os parâmetros “mais recentes” como a cognição e a atrofia foram também incluídos nos estudos centrais do ozanimod. Note-se, contudo, que nestes estudos a medida de atrofia foi apenas um parâmetro secundário e a velocidade de processamento cognitivo foi um parâmetro exploratório, pelo que estes resultados devem ser vistos com algumas advertências. Aqui, os dados a longo prazo trarão resultados mais precisos.
Efeitos secundários
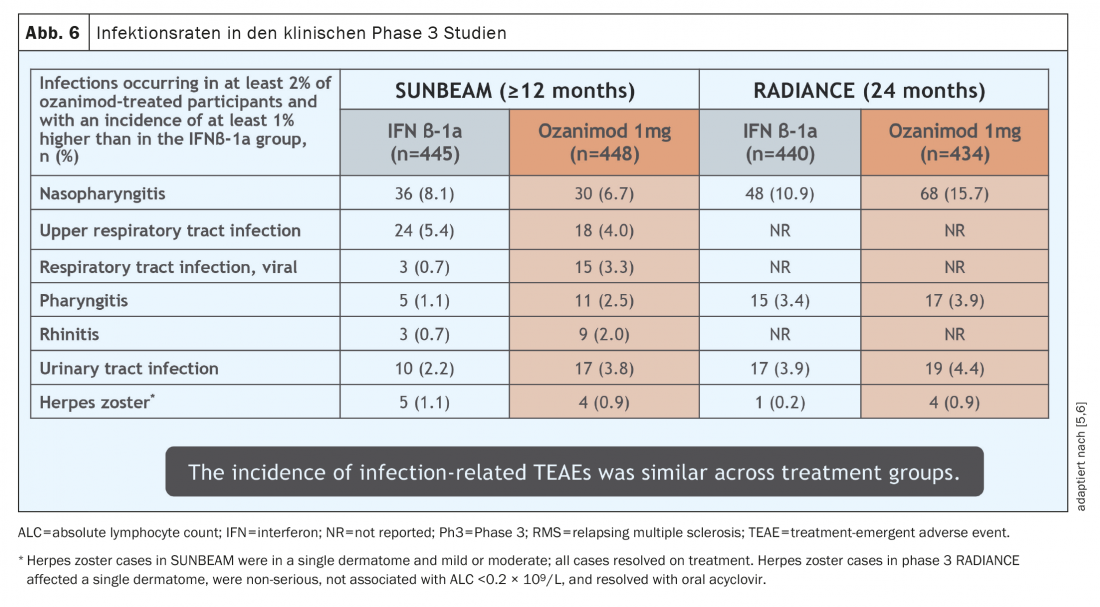
Os efeitos secundários que ocorreram nos estudos de aprovação quando a Ozanimod foi tomada foram essencialmente os mesmos que os experimentados com outras substâncias de tratamento SP1 que se encontram no mercado há muitos anos. O efeito secundário detectado mais frequentemente foi um ligeiro aumento das infecções respiratórias e urinárias (Fig. 6) . Todas estas infecções tomaram um curso suave. Em alguns casos (0,1- 0,3%), o edema macular ocorreu em doentes com condições pré-existentes (uveíte, diabetes mellitus ou doenças subjacentes/coexistentes da retina) com risco aumentado, e o herpes zoster foi observado em 0,6%. De acordo com o mecanismo de acção, a redução linfocitária no sangue periférico é de aproximadamente 45 – 50%, o que, no entanto, não representa um efeito secundário per se devido ao mecanismo de acção do ozanimod com retenção de linfócitos nos órgãos linfóides secundários.linfopenia transitória grau 4 de acordo com o CTCAE ocorreu em 2,5 – 4,2% dos pacientes nos estudos centrais (<0,2 G/l), mas estas não estavam associadas ao aumento de infecções e não levaram à descontinuação da terapia. Ainda não há sinais de doenças oportunistas, mas são necessários mais e mais dados para uma avaliação mais aprofundada. É importante notar que, nos ensaios centrais, os parâmetros hepáticos elevados (definidos como >3× valor normal superior) ocorreram em 5 a 6% dos doentes, exigindo a interrupção da terapia em 1,1% dos doentes [5,6]. Deve notar-se que nenhum destes casos cumpriu até agora a lei de Hy, que descreve a probabilidade de a insuficiência hepática poder ser atribuída a um medicamento específico [12].
Para minimizar os efeitos secundários cardíacos, o ozanimod é titulado gradualmente ao longo de 7 dias. Como resultado, a taquicardia sinusal ocorreu em 2 pacientes (0,5%) e a bradicardia sinusal num paciente (0,2%) nos estudos centrais, razão pela qual a terapia teve de ser descontinuada num paciente (0,2%).
Contra-indicações de Ozanimod
As seguintes contra-indicações devem ser consideradas antes de iniciar a terapia com ozanimod [adaptiert nach 8,9]:
- Hipersensibilidade ao ozanimod ou a qualquer dos outros ingredientes.
- Nos últimos 6 meses: Infarto do miocárdio, angina instável, AVC, ataque isquémico transitório, insuficiência cardíaca descompensada que requer hospitalização ou Classe III/IV
- História ou presença actual de bloqueio atrioventricular (AV) de segundo grau (tipo II) ou de bloqueio AV de terceiro grau ou síndrome do nó sinoatrial (excepção: marcapasso funcional presente).
- Apneia do sono grave não tratada
- Estado imunodeficiente
- Aumento do risco de infecções oportunistas, incluindo pacientes que estão actualmente a receber terapia imunossupressora ou que estão imunocomprometidos
- Infecções activas graves ou infecções crónicas activas (por exemplo, hepatite, tuberculose).
- Doenças malignas activas
- Insuficiência hepática grave (Child-Pugh classe C)
- Edema macular existente
- Gravidez
Outros aspectos de segurança [adaptiert nach 7,8]
Uma vez que os estudos centrais excluíram doentes com pré-tratamentos imunossupressores (fingolimod, natalizumab, alemtuzumab, cladribina, ocrelizumab, ciclofosfamida, mitoxantrona, irradiação corporal total e transplante de medula óssea), o ozanimod deve ser utilizado com precaução em tais doentes.
Ao interromper a terapia com ozanimod, deve ser considerada a possibilidade de um agravamento grave da doença, uma vez que tal foi relatado em até 10% dos casos após a interrupção de outro modulador do receptor S1P [13]. Contudo, não é claro se isto também se aplica ao ozanimod com um perfil de receptores e farmacocinética diferente.
É também importante evitar a co-medicação de ozanimod com inibidores de BCRP (Breast Cancer Resistance Protein) (como a ciclosporina), inibidores de MAO (Monoaminooxidase) (como a selegilina) e indutores de CYP2C8 (Cytochrome P2C8) (como a rifampicina) e inibidores (como a gemfibrozil).
Nas mulheres em idade fértil, a gravidez deve ser excluída antes de iniciar a terapia e a contracepção eficaz deve ser utilizada durante o tratamento com Zeposia e durante 3 meses após a interrupção da terapia com Zeposia.
Monitorização antes e durante a terapia com Ozanimod [adaptiert nach 8,9]
Antes de iniciar a terapia, todos os doentes devem ter os seus parâmetros hepáticos verificados e um hemograma diferencial. Nas mulheres em idade fértil, a gravidez também deve ser excluída e a contracepção segura instalada (indicada até 3 meses após a interrupção da terapia).
Além disso, o estado de vacinação de todos os pacientes deve ser actualizado. Os doentes sem história clinicamente confirmada de varicela e sem uma vacinação completa contra VZV devem ser testados para anticorpos contra VZV e vacinados se não forem detectados anticorpos (cuidado: vacina viva; a vacinação deve ser completada pelo menos 1 mês antes do início da terapia). Não existem dados clínicos sobre a segurança e eficácia da vacinação durante a terapia com ozanimod. No que respeita à doença COVID e à vacinação, apesar das preocupações teóricas devidas ao mecanismo de acção, não existem até à data sinais de segurança específicos no que respeita ao ozanimod [14]. De acordo com as directrizes suíças e internacionais, a vacinação COVID é recomendada em doentes com Ozanimod [15,16]. As vacinas vivas atenuadas devem ser evitadas durante e até 3 meses após a terapia com ozanimod e devem ser completadas pelo menos 1 mês antes de se iniciar a terapia.
Antes de iniciar a terapia, deve ser tomado um ECG em todos os pacientes para detectar qualquer distúrbio de condução. Ao iniciar a terapia, deve ser realizada uma monitorização cardíaca de seis horas com ECG em doentes de risco cardíaco seleccionados. Isto é recomendado em doentes com RH em repouso <55 bpm, bloco AV de 2º grau [Mobitz Typ I] ou st.n. Infarto do miocárdio antes de >6 meses ou insuficiência cardíaca indicada. Além disso, pacientes com St.n. paragem cardíaca, eventos cerebrovasculares anteriores a >6 meses, hiper-tonia descontrolada, síncope recorrente e bradicardia sintomática, prolongamento significativo do QTc, ou tratamento com medicamentos antiarrítmicos, deve ser feita uma co-avaliação cardiológica para saber se a terapia com ozanimod pode ser iniciada e como a monitorização deve ser organizada. Em todos os outros pacientes, ao contrário do que sucede com o dedo mindinho, a monitorização cardíaca de seis horas já não é necessária. No entanto, recomenda-se a monitorização regular da pressão arterial para todos os doentes em terapia.
Além disso, a monitorização dos testes de função hepática é indicada antes do início da terapia e em doentes sem sintomas após 1, 3, 6, 9 e 12 meses (seguida de monitorização periódica) [8]. Como parte destas verificações, deve também ser feito um hemograma diferencial antes de se iniciar a terapia e de 3 em 3 meses durante o primeiro ano, a fim de não falhar uma linfopenia excessivamente grave (verificações periódicas subsequentes).
Os doentes de risco oftalmológico com factores de risco de edema macular (uveíte st.n., diabetes mellitus, doenças da retina) devem ser regularmente observados pelo seu oftalmologista antes e durante a terapia. Na ausência de factores de risco de edema macular, no entanto, ao contrário do dedilimod, não é necessária qualquer apresentação oftalmológica antes de se iniciar a terapia.
No caso de infecções graves sob ozanimod (que ocorreram em menos de 1% nos estudos centrais), a interrupção da terapia deve ser avaliada. Devido ao longo tempo de eliminação (especialmente dos metabolitos activos), a monitorização das infecções deve ser realizada por um período máximo de 3 meses após a interrupção da terapia.
Procedimento prático na adaptação a Ozanimod [adaptiert nach 8,9]
Ao passar de medicamentos imunossupressores para ozanimod, a duração da acção bem como os mecanismos de acção destes tratamentos devem ser tidos em conta para evitar efeitos imunossupressores aditivos não intencionais. Por exemplo, no caso de terapia prévia com medicamentos que reduzem os linfócitos, aguardar que a contagem de linfócitos normalize antes de iniciar a terapia com Ozanimod. Deve também notar-se que, nos ensaios centrais, as terapias prévias com fingolimod, natalizumab, alemtuzumab, anti-CD4, cladribina, rituximab, ocrelizumab, ciclofosfamida, mitoxantrona, irradiação corporal total e transplante de medula óssea foram excluídas em qualquer altura antes de um paciente entrar no ensaio clínico, e consequentemente não há dados clínicos disponíveis para estes grupos de pacientes. Contudo, estas terapias prévias não são definidas como contra-indicações à terapia, de modo que a terapia com ozanimod é certamente possível mesmo depois destas terapias prévias, embora a duração da acção, bem como os mecanismos de acção das terapias prévias, devam ser tidos em conta a fim de evitar efeitos imunossupressores aditivos não intencionais. O tratamento com ozanimod pode normalmente ser iniciado imediatamente após a descontinuação dos interferões ou acetato de glatiramer se houver valores laboratoriais não notáveis (especialmente valores diferenciais do hemograma e do fígado).
No início da terapia, é necessário um regime de titulação de dose do primeiro ao sétimo dia. Após a titulação da dose de 7 dias, a dose de manutenção é de 0,92 mg por via oral uma vez por dia, tomada continuamente a partir do 8º dia. As cápsulas de Ozanimod devem ser engolidas inteiras e podem ser tomadas com uma refeição ou independentemente das refeições. Se uma dose de Ozanimod não for tomada, a próxima dose programada deve ser tomada no dia seguinte.
O lugar de Ozanimod na actual paisagem terapêutica da EM
Ozanimod é aprovado na Suíça para o tratamento de primeira linha de pacientes adultos com EM recorrente e só pode ser prescrito por um neurologista consultor [17]. Ao contrário da Suíça, o ozanimod só pode ser utilizado na área da EMA se houver sinais de actividade da doença (clinicamente, ou MR-tomograficamente), enquanto na Suíça este critério não tem de ser cumprido [8,18]. As populações do estudo incluíram pacientes adultos com RRMS com doença activa, e os critérios de inclusão exigiam uma recaída nos últimos 12 meses, ou uma recaída nos últimos 24 meses com evidência de uma lesão com contraste na RMN nos últimos 12 meses, mais um EDSS abaixo de 5,5. A maioria dos pacientes da população do estudo já apresentava anomalias neurológicas (escala EDSS 2,5 – 2,7) (o que, no entanto, não é um pré-requisito para a terapia com Ozanimod na Suíça), a idade média era de cerca de 35 anos e uns bons dois terços dos participantes do estudo eram do sexo feminino. Consequentemente, a clientela adequada não é um grupo de pacientes especiais altamente seleccionado, mas sim pacientes que são encontrados na consulta todos os dias. O pré-tratamento com outros medicamentos também não exclui a terapia com ozanimod (embora seja necessária uma maior vigilância, dependendo da terapia anterior). Estudos pós-hoc não detectaram pacientes específicos que não responderam ao modulador do receptor S1P, pelo que o ozanimod parece ser uma opção terapêutica para diferentes perfis de pacientes. Ozanimod foi bem tolerado nos estudos centrais (e agora também nos primeiros ensaios clínicos), não há efeitos colaterais gastrointestinais significativos e a administração oral uma vez por dia também é simples. Estes factores permitem aos pacientes integrar muito bem o tratamento na sua rotina diária, de modo que existem bons pré-requisitos para um elevado nível de aderência terapêutica.
Conclusão
Cada nova preparação é uma adição bem-vinda ao armamentarium dos terapeutas de EM. A EM não pode ser curada, mas pode muitas vezes ser controlada. No entanto, nem todos os medicamentos funcionam igualmente bem para todos os pacientes. Por conseguinte, é essencial uma abordagem individual da pessoa em questão. Aqui, Ozanimod é outro bloco de construção para proporcionar às pessoas afectadas uma terapia individualizada, eficaz, segura e bem tolerada.
Mensagens Take-Home
- A esclerose múltipla ainda não pode ser curada, apesar de muitos avanços, mas pode muitas vezes ser controlada.
- Ozanimod é um modulador selectivo do receptor de esfingosina-1-fosfato (S1P) que se liga especificamente aos subtipos 1 e 5 do receptor S1P.
- Ao ligar ozanimod a estes receptores S1P, os linfócitos já não podem interferir com o processo inflamatório no sistema nervoso central.
- A preparação tem sido aprovada na Suíça desde finais de 2020 como terapia de primeira linha para pacientes adultos com esclerose múltipla recorrente (RRMS).
- Ozanimod é tomado oralmente 1× ao dia e foi bem tolerado nos estudos sem efeitos secundários gastrointestinais significativos. Estes dados são consistentes com as observações iniciais da prática clínica diária.
Literatura:
- Scott FL, Clemons B, Brooks J, et al: Ozanimod (RPC1063) é um potente receptor-1 (S1P1) e receptor-5 (S1P5) de esfingosina-1-fosfato agonista com actividade auto-imune modificadora de doenças. Br J Pharmacol. 2016;173(11): 1778-1792.
- Giovannoni G, Turner B, Gnanapavan S, et al: É tempo de não visar nenhuma actividade de doença evidente (NEDA) na esclerose múltipla? Mult Scler Relat Disordord. 2015 Jul;4(4): 329-333. doi: 10.1016/j.msard.2015.04.006. Epub 2015 8 de Maio. PMID: 26195051.
- Ziemssen T, Derfuss T, de Stefano N, et al: Optimizar o sucesso do tratamento na esclerose múltipla. J Neurol. 2016 Jun;263(6): 1053-1065. doi: 10.1007/s00415-015-7986-y. Epub 2015 Dez 24. PMID: 26705122; PMCID: PMC4893374.
- Kappos L, De Stefano N, Freedman MS, et al: Inclusão da perda de volume cerebral numa medida revista de “nenhuma evidência de actividade da doença” (NEDA-4) na esclerose múltipla recorrente-remitente. Mult Scler. 2016
- Cohen JA, Comi G, Selmaj KW; RADIANCE Trial Investigators, et al: Safety and efficacy of ozanimod versus interferon beta-1a in relapsing multiple sclerosis (RADIANCE): um ensaio multicêntrico, randomizado, 24 meses, fase 3. Lancet Neurol. 2019
- Comi G, Kappos L, Selmaj KW, SUNBEAM Study Investigators, et al: Safety and efficacy of ozanimod versus interferon beta-1a in relapsing multiple sclerosis (SUNBEAM): um ensaio multicêntrico, randomizado, mínimo 12 meses, fase 3. Lancet Neurol. 2019
- Cohen JA, Comi G, Arnold DL, RADIANCE Trial Investigators, et al: Eficácia e segurança do ozanimod na esclerose múltipla: Extensão cega por dose de um estudo fase II randomizado. Mult Scler. 2019
- Medicines Compendium of Switzerland, compendium.ch, a partir de 01/2021
- swissmedicinfo.ch, Estado 01/2021
- Rocca MA, Battaglini M, Benedict RH, et al: Quantificação da atrofia da RM do cérebro em EM: Dos métodos à aplicação clínica. Neurologia. 2017
- Sastre-Garriga J, Pareto D, Battaglini M, et al: MAGNIMS recomendações consensuais sobre o uso de medidas de atrofia cerebral e da medula espinal na prática clínica. Nat Rev Neurol. 2020;16(3): 171-182.
- Robles-Diaz M, Lucena MI, Kaplowitz N, Spanish DILI Registry, et al.: LatinDILI Network; Safer and Faster Evidence-based Translation Consortium. Utilização da lei de Hy e de um novo algoritmo composto para prever falhas hepáticas agudas em pacientes com lesões hepáticas induzidas por drogas. Gastroenterologia. 2014 Jul;147(1): 109-118.e5.
- Evangelopoulos ME, Miclea A, Schrewe L, et al: Frequência e características clínicas de ressaltos de esclerose múltipla após a retirada do dedalimode. CNS Neurosci Ther. 2018 Oct;24(10): 984-986.
- Berger JR, Brandstadter R, Bar-Or A: COVID-19 e terapias modificadoras de doenças de EM. Neurol Neuroimmunol Neuroinflamm. 2020 Maio
- www.multiplesklerose.ch/de/aktuelles/detail/anti-sars-cov2-impfung-und-multiple-sklerose (recuperado em 08.03.2021)
- www.msif.org/news/2020/02/10/the-coronavirus-and-ms-what-you-need-to-know (recuperado em 08.03.2021)
- Lista de especialidades Suíça, Gabinete Federal de Saúde Pública, www.spezialitätenliste.ch/ShowPreparations.aspx (recuperada em 08.03.2021)
- Agência Europeia dos Medicamentos, ema.europa.eu (recuperada em 08.03.2021)
InFo NEUROLOGIA & PSYCHIATry 2021; 19(3): 12-18.