- O tratamento a longo prazo com upadacitinib (UPA, RINVOQ®) durante um período máximo de 5,5 anos não revela novos sinais de segurança [1].
- O UPA tem um perfil de segurança consistente no tratamento da dermatite atópica (DA), da artrite reumatoide (AR), da artrite psoriática (APS) e da espondiloartrite axial (EA), embora a incidência de acontecimentos adversos varie devido a diferenças na população de doentes e nas comorbilidades relacionadas com a doença[1].
UPA na dermatite atópica
A dermatite atópica (DA) é a doença inflamatória crónica da pele mais comum em todo o mundo e representa um fardo considerável na vida dos doentes e das suas famílias [2]. Além disso, a DA está associada a várias comorbilidades alérgicas, auto-imunes e cardiovasculares [3]. Para os doentes com DA moderada a grave que são refractários ao tratamento tópico, existem terapias sistémicas específicas que reduzem as recaídas e também atenuam os efeitos psicológicos da doença [1, 4-6]. O UPA é um inibidor oral e reversível da Janus quinase (JAK) que actua especificamente na JAK1 e, em menor grau, também na JAK2, JAK3 ou TYK2. O UPA é utilizado numa dose de 15 mg uma vez por dia para o tratamento da DA, AR, APS e EA [7].
A UPA demonstrou uma forte eficácia em todos os 12 estudos na DA, AR, PsA e AS. No entanto, a utilização segura é igualmente crucial para o tratamento [7]. Os dados do estudo de vigilância ORAL, que comparou o inibidor da JAK tofacitinib com um inibidor do fator de necrose tumoral (TNF) em doentes idosos com AR e factores de risco cardiovascular, sublinham a necessidade de caraterizar melhor o perfil de segurança dos inibidores da JAK – também porque a segurança de cada inibidor da JAK difere nos vários grupos de doentes com doenças inflamatórias imunomediadas (DIMI) [1]. Uma nova publicação de Burmester et al. mostra agora o perfil de segurança a longo prazo da UPA durante um período de até 5,5 anos em várias doenças reumáticas e até 2,75 anos na DA. Não surgiram novos sinais de segurança durante este período [1].
Tratamento a longo prazo com UPA
No total, a segurança da UPA foi investigada em 6000 doentes com AD, RA, PsA e AS com mais de 15 000 doentes-ano (PY). Os dados de segurança de 12 estudos de Fase IIb/III para cada doença foram agrupados em todos os estudos. Três destes estudos, com um total de 2693 participantes, foram efectuados na AD. Este valor corresponde a 2035,8 PY.
Tabela 1: Dados demográficos básicos e características da doença da UPA em doentes com DA
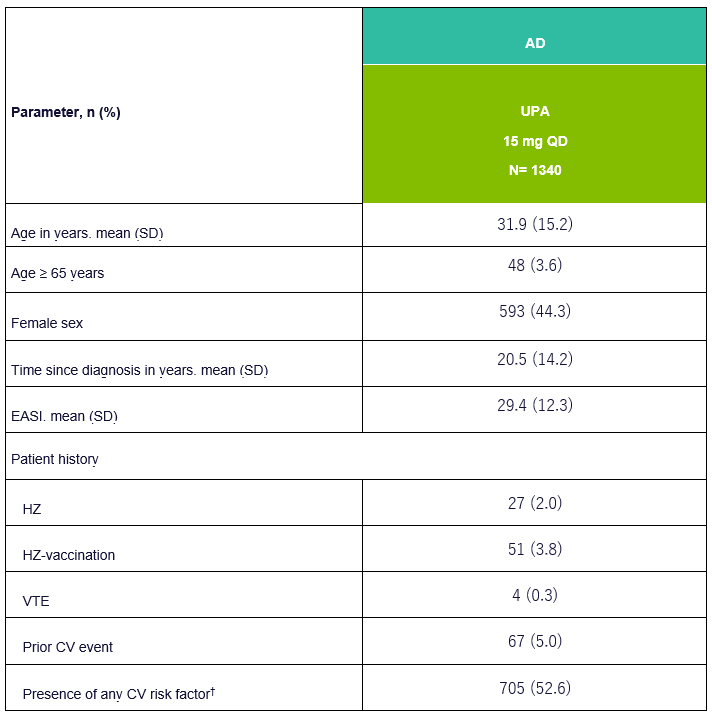
EASI, Eczema Area and Severity Index; TEV, Tromboembolismo Venoso; CV, Cardiovascular; HZ, Herpes Zoster; †Os factores de risco CV incluem eventos cardiovasculares na história clínica, hipertensão arterial, diabetes mellitus, consumo de tabaco/nicotina, aumento do valor de LDL-C e diminuição do valor de HDL-C. Adaptado de [1]
Não há novos sinais de segurança durante a UPA na AD
Infecções graves com UPA 15 mg ocorreram na AD a uma taxa de 2,5 eventos por 100 PY (2,5 E/100 PY) e raramente levaram à interrupção do tratamento. A infeção grave mais comum em todas as populações inquiridas foi a COVID-19, seguida do herpes zoster na população AD. Esta era geralmente ligeira ou moderada, sem envolvimento do sistema nervoso central ou de órgãos internos, raramente levava à interrupção da terapêutica e normalmente só afectava um único dermatoma. Além disso, não foi possível estabelecer uma correlação entre a duração do tratamento e a ocorrência de herpes zoster [1]. A vacina contra o herpes zoster está disponível. A vacina deve ser administrada 4 semanas antes do tratamento com um agente imunomodulador ativo, como a UPA [7]. Outras infecções oportunistas com UPA 15 mg foram listadas como 1,8 eventos por 100 PY, dos quais foi relatado principalmente eczema herpético. A tuberculose (TB) foi registada separadamente e a TB ativa foi registada em 0,03 E/100 PY em doentes com AD ao abrigo da UPA. O evento adverso emergente do tratamento (TEAE) mais comum associado à UPA foi uma infeção do trato respiratório superior [1].
Os eventoscardiovasculares adversos graves (MACE) incluíram os seguintes Morte, enfarte do miocárdio não fatal e apoplexia não fatal. Você foram notificados em doentes com DA a uma taxa de 0,03/100 PY. Não foi encontrada correlação entre a duração da ingestão de UPA e a ocorrência de MACE. Além disso, a maioria dos doentes que sofreram um MACE tinham pelo menos um fator de risco cardiovascular [1].
As tromboses venosas profundas e as embolias pulmonares foram registadas como tromboembolismo venoso (TE V). Ocorreram a uma taxa de 0,04 E/100 PY, sendo que a maioria dos doentes tinha pelo menos um fator de risco cardiovascular e/ou tromboembólico. Não foi encontrada correlação entre a duração da exposição à UPA e a ocorrência de TEV [1].
As doenças malignas (excluindo o cancro da pele não melanoma, CCNM) foram registadas ao abrigo da UPA 15 mg a 0,2 E/100 PY. Não se registou qualquer alteração significativa desta taxa durante todo o período de ingestão de UPA. Os eventos NMSC não foram geralmente graves e não levaram à interrupção do tratamento. Foram registados NMSC na população UPA 15 mg com 0,3 E/100 PY [1].
Anomalias laboratoriais
Foram também notificados efeitos secundários dependentes da dose, tais como anemia, neutropenia, linfopenia, disfunção hepática e elevação da creatina fosfoquinase (CPK) em doentes com DA a tomar UPA. A maioria das anomalias laboratoriais foi classificada como globalmente ligeira e transitória e apenas algumas levaram à descontinuação da medicação do estudo [1].
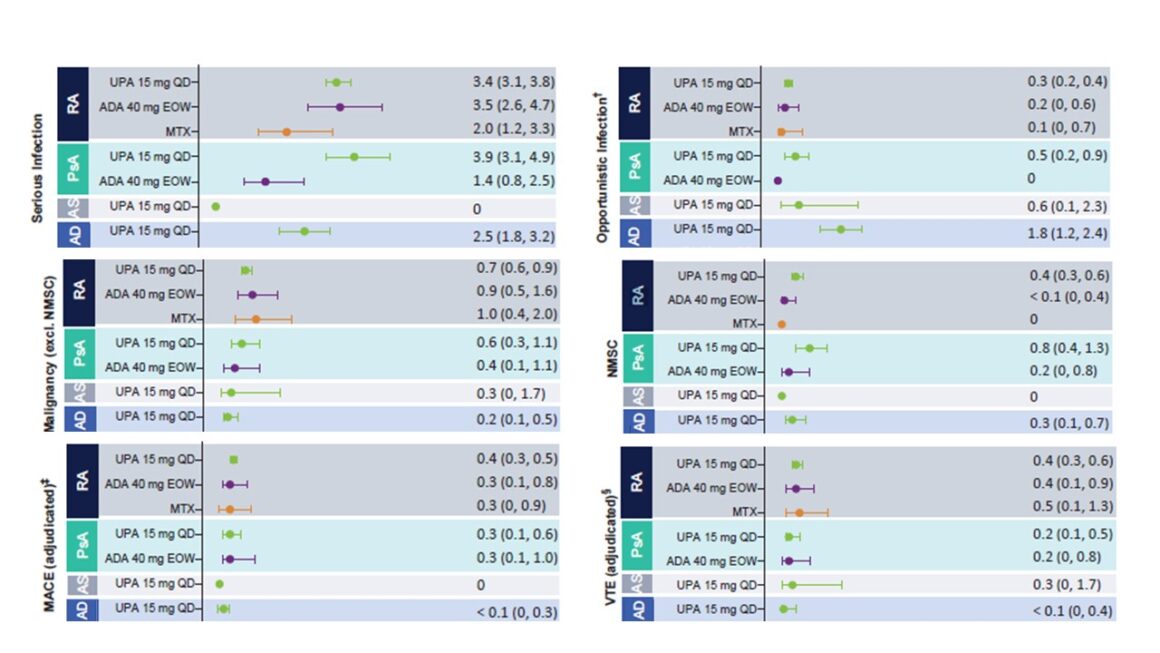
Figura 1: Taxas ajustadas à exposição de eventos adversos emergentes do tratamento (TEAEs) de particular interesse. Adaptado de [1]
Esta análise de segurança não revela riscos de segurança novos ou inesperados no âmbito da UPA, em comparação com os relatórios anteriores. Um risco aumentado de herpes zoster e níveis aumentados de CPK estão associados à inibição da JAK e são consistentes com o perfil de segurança geral dos inibidores da JAK. As infecções por herpes zoster eram na sua maioria não graves e limitadas a um dermatoma, enquanto os níveis elevados de CPK eram na sua maioria assintomáticos e transitórios. Embora tenham sido notificados eventos de TEV em doentes que receberam UPA, as taxas foram consistentes com as taxas de fundo para as condições individuais. [1].
Conclusão
Em resumo, a UPA foi geralmente bem tolerada. O perfil de segurança é comparável para a DA, AR, APS e EA, embora a incidência de acontecimentos adversos varie devido a diferenças na população de doentes e nas comorbilidades relacionadas com a doença. Mesmo com um tratamento a longo prazo com UPA de até 5,5 anos ou 2,75 anos na DA, não foram detectados novos sinais de segurança.
A publicação completa de Burmester et al. pode ser consultada aqui.
JAK, Janus Kinase; TYK, tirosina quinase; IMIDs, Doenças Inflamatórias Imunomediadas; EASI, Índice de Área e Gravidade do Eczema; HZ, Herpes Zoster; MACE, Evento Cardiovascular Adverso Grave; NMSC, Cancro da Pele Não Melanoma; UPA, Upadacitinib; VTE, Tromboembolismo Venoso; TEAEs, Eventos Adversos Emergentes do Tratamento; LDL-C, Lipoproteína de Baixa Densidade-Colesterol; HDL-C, Lipoproteína de Alta Densidade-Colesterol; CPK, Creatina Fosfoquinase.
Referências:
1. Burmester, G.R., et al, Safety profile of upadacitinib over 15 000 patient-years across rheumatoid arthritis, psoriatic arthritis, ankylosing spondylitis and atopic dermatitis. RMD Open, 2023. 9(1).
2 Ali, F., J. Vyas, e A.Y. Finlay, Counting the Burden: Atopic Dermatitis and Health-related Quality of Life (Dermatite atópica e qualidade de vida relacionada com a saúde). Ata Derm Venereol, 2020. 100(12): p. adv00161.
3 Langan, S.M., A.D. Irvine, e S. Weidinger, Atopic dermatitis. Lancet, 2020. 396(10247): p. 345-360.
4 Song, A., S.E. Lee, e J.H. Kim, Immunopathology and Immunotherapy of Inflammatory Skin Diseases.Immune Netw, 2022. 22(1): p. e7.
5 Silvestre JF et al. Carga no Mundo Real em Doentes com Dermatite Atópica Candidatos a Terapia Sistémica e que Atualmente Não Recebem Terapia Sistémica, Nenhum Tratamento, Terapia Tópica Isolada ou Terapia Sistémica: Resultados de um Estudo Multicêntrico de Mundo Real. EADV, Milão, 7-11 de setembro de 2022. Sessão oral FC02.02.
6 Megna, M., et al, Tratamento sistémico da dermatite atópica do adulto: uma revisão. Dermatol Ther (Heidelb), 2017. 7(1): p. 1-23.
7. Informação actualizada para os profissionais de saúde RINVOQ® (upadacitinib) em www.swissmedicinfo.ch
As referências podem ser solicitadas por profissionais em medinfo.ch@abbvie.com.
Autor: Dr. Corinne Peter
Breve informação técnica RINVOQ®.
Este artigo foi produzido com o apoio financeiro da AbbVie AG, Alte Steinhauserstrasse 14, Cham.
CH-RNQD230038_11/2023
Contribuição em linha desde 23.10.2023
Este artigo foi publicado em alemão
Post atualizado: 17.11.2023













