- Le traitement à long terme par upadacitinib (UPA, RINVOQ®) jusqu’à 5,5 ans ne montre aucun nouveau signal de sécurité [1].
- L’UPA présente un profil d’innocuité cohérent dans le traitement de la dermatite atopique (DA), de la polyarthrite rhumatoïde (PR), de l’arthrite psoriasique (PsA) et de la spondyloarthrite axiale (AS), bien que la fréquence des effets secondaires varie en raison de différences dans la population de patients et des comorbidités liées à la maladie[1].
L’UPA dans la dermatite atopique
La dermatite atopique (DA) est la maladie inflammatoire chronique de la peau la plus répandue dans le monde et représente un fardeau considérable pour la vie des patients et de leurs familles [2]. En outre, la DA est associée à diverses comorbidités allergiques, auto-immunes et cardiovasculaires [3]. Pour les patients atteints de DA modérée à sévère réfractaire aux traitements topiques, il existe des thérapies systémiques ciblées qui réduisent les poussées et atténuent également l’impact psychologique de la maladie [1, 4-6]. L’UPA est un inhibiteur oral et réversible de la Janus kinase (JAK) qui agit spécifiquement sur JAK1 et, dans une moindre mesure, sur JAK2, JAK3 ou TYK2. L’UPA est utilisé à la dose de 15 mg une fois par jour pour traiter la MA, la PR, la PsA et la SA [7].
L’UPA a montré une forte efficacité dans les 12 études menées dans la MA, la PR, la PsA et la SA. Cependant, une utilisation sûre est tout aussi cruciale pour un traitement [7]. Les données de l’étude ORAL- Surveillance, qui a comparé le tofacitinib, un inhibiteur des JAK, à un inhibiteur du facteur de nécrose tumorale (TNF) chez des patients âgés atteints de PR et présentant des facteurs de risque cardiovasculaire, soulignent la nécessité de mieux caractériser le profil de sécurité des inhibiteurs des JAK – notamment parce que la sécurité de chaque inhibiteur des JAK varie selon les groupes de patients atteints de maladies inflammatoires à médiation immunitaire (MIDI) [1]. Une nouvelle publication de Burmester et al. montre maintenant le profil de sécurité à long terme de l’UPA sur une période allant jusqu’à 5,5 ans pour différentes maladies rhumatismales et jusqu’à 2,75 ans pour la MA. Aucun nouveau signal de sécurité n’est apparu pendant cette période [1].
Traitement à long terme à l’UPA
Au total, la sécurité de l’UPA a été évaluée chez 6000 patients atteints de MA, de PR, de PsA et de SA avec plus de 15 000 patients-années (PY). Pour ce faire, les données de sécurité de 12 études de phase IIb/III ont été regroupées pour chaque maladie, toutes études confondues. Trois de ces études, avec un total de 2693 participants, ont été menées en AD. Cela correspond à 2035,8 PY.
Tableau 1 : Données démographiques de base et caractéristiques de l’UPA chez les patients atteints de la MA
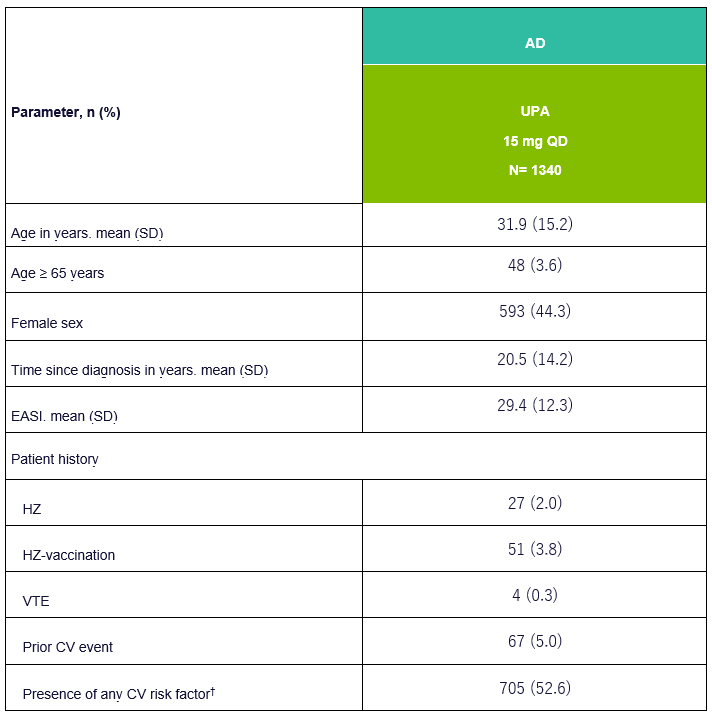
EASI, Eczema Area and Severity Index ; VTE, Venous Thromboembolism ; CV, Cardiovascular ; HZ, Herpes Zoster ; †CV Les facteurs de risque incluent les antécédents d’événements cardiovasculaires, l’hypertension, le diabète sucré, la consommation de tabac/nicotine, un taux de LDL-C élevé et un taux de HDL-C abaissé. Adapté de [1]
Pas de nouveaux signaux de sécurité sous UPA dans l’AD
Les infections graves sous UPA 15 mg sont survenues chez les AD à un taux de 2,5 événements pour 100 PY (2,5 E/100 PY) et n’ont que rarement entraîné l’arrêt du traitement. L’infection grave la plus fréquente dans toutes les populations couvertes était COVID-19, suivie par l ‘herpès zoster dans la population AD. Celui-ci était généralement léger ou modéré, sans atteinte du système nerveux central ou des organes internes, n’entraînait que rarement l’interruption du traitement et n’affectait généralement qu’un seul dermatome. En outre, aucun lien n’a été établi entre la durée du traitement et l’apparition du zona [1]. Un vaccin contre l’herpès zoster est disponible. Le vaccin doit être administré 4 semaines avant le traitement par un agent immunomodulateur actif tel que l’UPA [7]. D’autres infections opportunistes sous UPA 15 mg ont été répertoriées, avec 1,8 événement pour 100 UP, dont le principal a été l’eczéma herpétique. La tuberculose (TB) a été enregistrée séparément et une TB active a été notée à 0,03 U/100 PY chez les patients AD sous UPA. L’événement indésirable lié au traitement (TEAE, treatment-emergent adverse events) le plus fréquemment associé à l’UPA était une infection des voies respiratoires supérieures [1].
Lesévénements cardi ovasculaires majeurs (MACE) étaient les suivants Décès, infarctus du myocarde non fatal et apoplexie non fatale. Vous ont été rapportés chez des patients atteints de la MA, à un taux de 0,03/100 PY. Aucun lien n’a été établi entre la durée de la prise d’UPA et la survenue de MACE. En outre, la plupart des patients ayant subi un MACE présentaient au moins un facteur de risque cardiovasculaire [1].
Parmi les thromboembolies veineuses (TEV), les thromboses veineuses profondes et les embolies pulmonaires ont été enregistrées. Ils sont survenus à un taux de 0,04 U/100 PY, la plupart des patients présentant au moins un facteur de risque cardiovasculaire et/ou thromboembolique. Aucun lien n’a été établi entre la durée d’exposition à l’UPA et la survenue de TEV [1].
Des cas de malignité (hors cancer de la peau non mélanome, NMSC) ont été enregistrés sous UPA 15 mg à 0,2 U/100 PY. Aucun changement significatif de ce taux n’a été observé pendant toute la durée de la prise d’UPA. Les événements NMSC n’étaient généralement pas graves et n’ont pas entraîné l’arrêt du traitement. NMSC ont été rapportés dans la population UPA 15 mg à 0,3 E/100 PY [1].
Anomalies de laboratoire
Des effets indésirables liés à la dose, tels que l’anémie, la neutropénie, la lymphopénie, les troubles de la fonction hépatique et l’augmentation de la créatine phosphokinase (CPK), ont également été rapportés chez des patients atteints de MA sous UPA. La plupart des anomalies de laboratoire ont été considérées comme globalement légères et transitoires, et seules quelques-unes ont entraîné l’arrêt du traitement à l’étude [1].
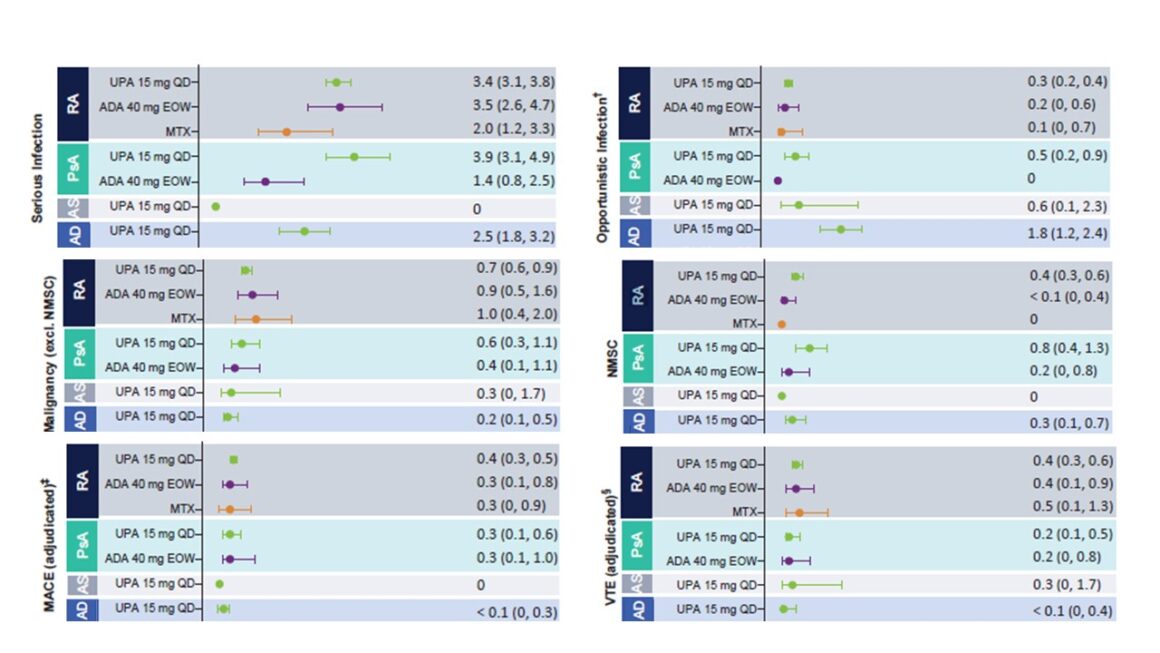
Figure 1 : Taux d’événements indésirables liés au traitement (TEAE) présentant un intérêt particulier, ajustés en fonction de l’exposition. Adapté de [1]
Cette analyse de sécurité ne révèle aucun risque de sécurité nouveau ou inattendu sous UPA par rapport aux rapports précédents. Un risque accru de zona et des taux élevés de CPK sont associés à l’inhibition des JAK et sont cohérents avec le profil de sécurité général des inhibiteurs de JAK. Les infections à herpès zoster étaient principalement non graves et limitées à un dermatome, tandis que les taux élevés de CPK étaient généralement asymptomatiques et transitoires. Bien que des événements de TEV aient été signalés chez des patients recevant de l’UPA, les taux correspondaient aux taux de fond pour chaque pathologie. [1].
Conclusion
En résumé, l’UPA a été généralement bien toléré. Le profil d’innocuité est comparable dans la MA, la PR, la PsA et la SA, mais la fréquence des effets indésirables varie en raison des différences dans la population de patients et des comorbidités liées à la maladie. De même, aucun nouveau signal de sécurité n’a été observé lors d’un traitement à long terme par UPA allant jusqu’à 5,5 ans ou 2,75 ans dans AD.
La publication complète de Burmester et al. est disponible ici.
JAK, Janus Kinase ; TYK, Tyrosine Kinase ; IMIDs, Immune-Mediated Inflammatory Diseases ; EASI, Eczema Area and Severity Index ; HZ, Herpes Zoster ; MACE, Major Adverse Cardiovascular Event ; NMSC, Non-Melanoma Skin Cancer ; UPA, Upadacitinib ; VTE, Thromboembolisme veineux ; TEAEs, Treatment-Emergent Adverse Events ; LDL-C, cholestérol à lipoprotéines de basse densité ; HDL-C, cholestérol à lipoprotéines de haute densité ; CPK, créatine phosphokinase.
Références :
1. Burmester, G.R., et al, Safety profile of upadacitinib over 15 000 patient-years across rheumatoid arthritis, psoriatic arthritis, ankylosing spondylitis and atopic dermatitis. RMD Open, 2023. 9(1).
2. Ali, F., J. Vyas, et A.Y. Finlay, Counting the Burden : Dermatite atopique et qualité de vie liée à la santé. Acta Derm Venereol, 2020. 100(12) : p. adv00161.
3. Langan, S.M., A.D. Irvine, and S. Weidinger, Atopic dermatitis. Lancet, 2020. 396(10247) : p. 345-360.
4. Song, A., S.E. Lee, and J.H. Kim, Immunopathology and Immunotherapy of Inflammatory Skin Diseases.Immune Netw, 2022. 22(1) : p. e7.
5. Silvestre JF et al. Real-World Burden in Patients With Atopic Dermatitis Who Are Candidates for Systemic Therapy and Currently Receiving No Systemic Therapy, No Treatment, Topical Therapy Alone, or Systemic Therapy : Results From a Real-World Multicountry Study. EADV, Milan, 7-11 septembre 2022. Session orale FC02.02.
6. Megna, M., et al, Systemic Treatment of Adult Atopic Dermatitis : A Review. Dermatol Ther (Heidelb), 2017. 7(1) : p. 1-23.
7. information professionnelle actuelle RINVOQ® (upadacitinib) sur www.swissmedicinfo.ch
Les références peuvent être demandées par les professionnels à medinfo.ch@abbvie.com.
Auteur : Dr. med. Corinne Peter
Information technique succincte RINVOQ
Cet article a été rédigé avec le soutien financier de AbbVie AG, Alte Steinhauserstrasse 14, Cham.
CH-RNQD230038_11/2023
Contribution en ligne depuis le 23/10/2023
Cet article a été publié en allemand
Contribution mise à jour : 17/11/2023












