A doença isquémica do coração é o resultado de um fluxo de sangue coronário inadequado. A medição directa do fluxo sanguíneo absoluto (mL/min) é possível, mas não encontrou o seu caminho para a rotina clínica na maioria dos laboratórios de cateterização. Recentemente, foi descrito um método de dinâmica dos fluidos computacional ( CFD ) para prever o fluxo que distingue entre o fluxo de entrada, o fluxo lateral e o fluxo de saída durante a angiografia. Um estudo recente avaliou agora um novo método que regionaliza o fluxo ao longo do comprimento da artéria.
A doença cardíaca isquémica (IHD) é a principal causa de morte a nível mundial e é o resultado de insuficiência coronária (Q), geralmente causada por doença oclusiva coronária. Inclui uma variedade de síndromes clínicas tais como isquemia sintomática (angina de peito), enfarte do miocárdio e insuficiência cardíaca. Os tratamentos intervencionais são eficazes na restauração da Q, mas só devem visar lesões que conduzam à isquemia. Contudo, para uso clínico de rotina no laboratório de cateterização cardíaca, não está disponível nenhuma técnica para medir directamente Q. Durante várias décadas, os cardiologistas confiaram em marcadores indirectos de substituição, tais como o tempo médio de trânsito derivado da termodiluição, a velocidade de fluxo derivado de Doppler e a reserva de fluxo fracionário derivado da pressão (FFR) [2-4] e, mais recentemente, o FFR “virtual” derivado da imagem angiográfica (vFFR) [5]. Todos estes métodos têm pontos fortes e fracos, mas nenhum mede Q “absoluto” em mL/min.
Foram desenvolvidos dois métodos para quantificar a Q: O primeiro, a termodiluição de infusão contínua (TCI), é o método mais estabelecido e validado e utiliza o cateter de infusão Rayflow™ [6,7]. O segundo, virtuQ™, deriva Q de uma simulação de CFD baseada em anatomia de angiografia 3D e medições de fio de pressão. Ambos os métodos também quantificam a resistência microvascular absoluta (Rmicro), fornecendo uma avaliação abrangente de toda a circulação coronária. Uma limitação do método CFD era que apenas o recipiente principal era tido em conta e o fluxo nos ramos laterais não era considerado [8]. Isto pode ser aceitável para o cálculo do vFFR, que apenas interroga os efeitos de uma lesão localizada, mas não para o cálculo do Q, que depende da lesão, dos ramos laterais e da estrutura do microvaso [9].
Um estudo recente descreveu um método de simulação de parede porosa utilizando leis morfométricas de escala estabelecidas e conhecimentos específicos de afilamento arterial para permitir a saída de sangue do vaso principal em proporção ao fluxo dos ramos laterais [9]. Uma limitação desta abordagem era que o fluxo dos ramos laterais era difusamente distribuído ao longo de todo o comprimento do navio principal. Esta abordagem não conseguiu, portanto, captar os efeitos hemodinâmicos de um grande volume de perda de fluxo regionalizado nos grandes ramos laterais arteriais. Um estudo recente descreve um novo método que tenta correlacionar “fugas” nos ramos laterais com áreas de bifurcações significativas, e portanto representa o padrão de fluxo comummente encontrado em artérias coronárias reais. O objectivo era validar este novo método utilizando medições do IRC e comparar os resultados com os do método homogéneo do CFD [1].
Recolha de dados clínicos
O FFR foi medido nas artérias de interesse utilizando tecnologia padrão (PressureWire™) e um desvio de sinal máximo tolerado de 2 mmHg [10], o cateter de infusão Rayflow™ e o sistema Coroventis™ [6,7] foram utilizados para quantificar Q (QCIT) e Rmicro (RmicroCIT). As medições de termodiluição foram feitas na artéria coronária proximal, enquanto que as medições de pressão sob hiperaemia induzida por sal foram feitas a 6 cm distal da ponta do cateter de infusão [7].
Simulação do fluxo sanguíneo coronário
Duas projecções angiográficas do vaso de interesse foram utilizadas para reconstruir a anatomia coronária, desmontadas em ≥30° e durante a diástole final. A selecção das imagens e a correcção do movimento da mesa entre as passagens de angiografia foram realizadas manualmente, enquanto que o seguimento da linha central e a detecção da borda da embarcação foram realizadas semi-automaticamente utilizando o gradiente de contraste para ambas as imagens, com correcção manual conforme necessário. Finalmente, foi criada automaticamente uma geometria 3D rígida, aximétrica, representando a anatomia do paciente. A entrada das artérias reconstruídas correspondia à localização da medição invasiva QCIT e Pa, enquanto que a saída correspondia à localização da Pd. As medições de pressão invasivas foram utilizadas para definir as condições-limite de entrada e saída. A simulação CFD foi realizada utilizando parâmetros sanguíneos padrão (densidade 1056 kg/m3; viscosidade 0,0035 Pa s), que modelam um fluxo constante e laminar de um fluido Newtoniano [11,12].
Simulação do fluxo do ramo lateral
No estudo actual, o fluxo nos ramos laterais foi simulado através da modelação de reconstruções arteriais com um limite de parede porosa. Isto permitiu uma perda de fluxo do lúmen do recipiente principal. O tamanho dos ramos laterais foi derivado do cone do navio principal usando a lei de Murray [13] que relaciona os diâmetros (D) do navio principal (PV) e os ramos laterais (DB) em torno de um ramo:
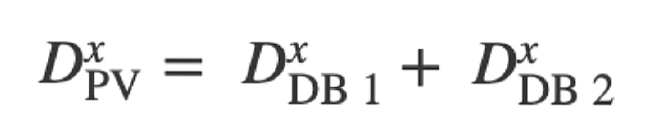
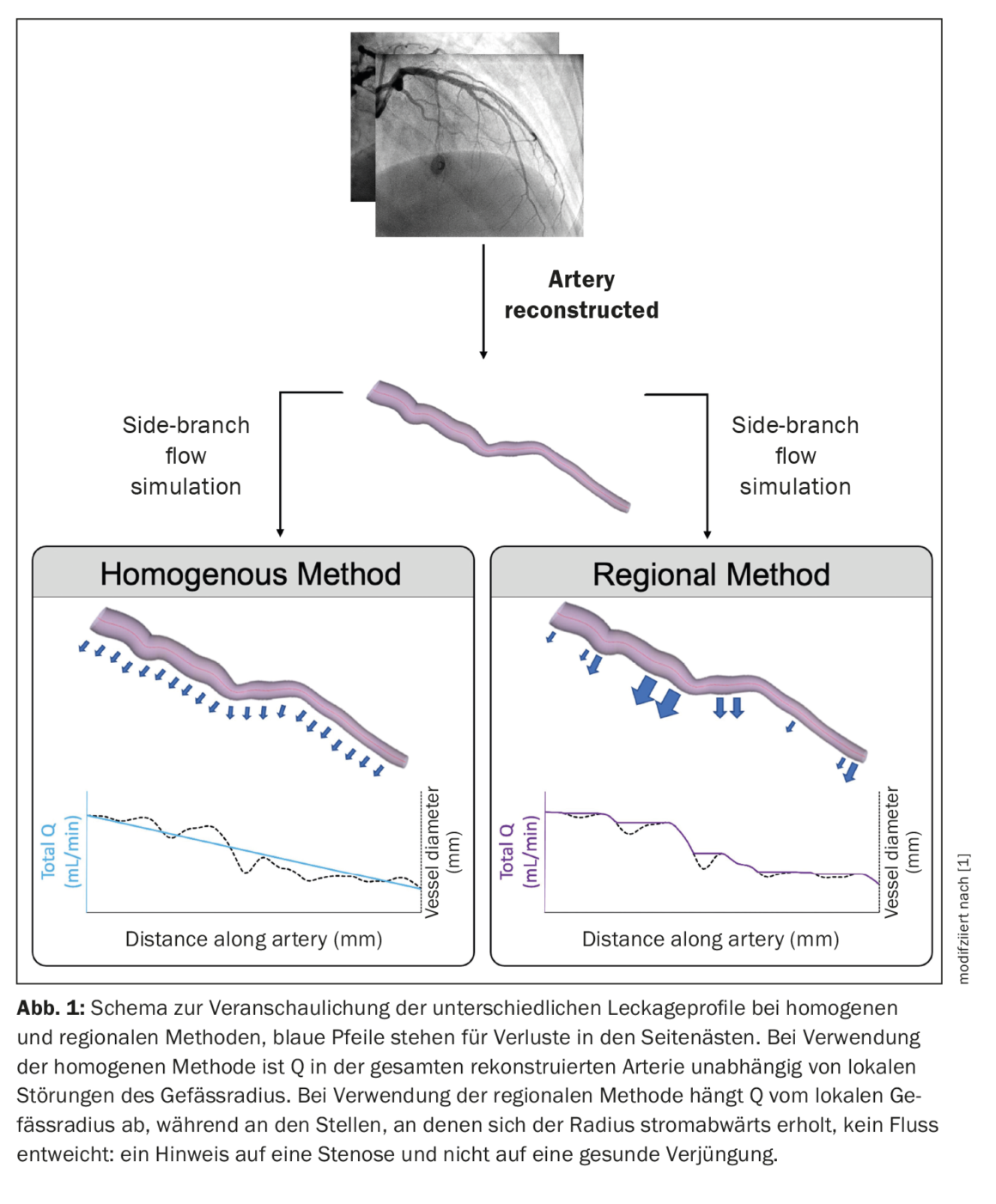
onde “x” representa uma constante cujo valor varia entre 2,0 e 3,0 [14–16]. A extensão do fluxo do ramo lateral dependia do valor utilizado para esta constante de proporcionalidade e do método utilizado para distribuir as perdas do ramo lateral (homogéneo vs. regional). O objectivo era comparar a precisão dos métodos homogéneos e regionais com as massas derivadas invasivamente. O método da parede homogénea porosa distribuiu as perdas do ramo lateral uniformemente ao longo de todo o comprimento do vaso reconstruído e não foi afectado pelo afunilamento local. No método da parede porosa regional, as perdas de fluxo lateral foram distribuídas proporcionalmente ao afunilamento local do recipiente saudável. Isto foi feito para melhor regionalizar o Q. Em vasos saudáveis, o rejuvenescimento regional ocorre em pontos de ramificação. Por conseguinte, este método deveria regionalizar com maior precisão o fluxo sanguíneo na artéria in vivo. Para distinguir o rejuvenescimento dos vasos saudáveis da redução do diâmetro causado pelas placas ateroscleróticas, foi utilizado um filtro de detecção de estenose que excluía fugas nas paredes porosas em secções com recuperação a jusante do diâmetro dos vasos (Fig. 1) [1].
Casos clínicos
Dos 48 casos originais, 27 casos de 20 pacientes forneceram conjuntos completos de dados fisiológicos. Sete pacientes (35%) eram do sexo masculino, a idade média era de 62 (±10) anos, e o índice médio de massa corporal (IMC) era de 25,2 (±3,6) kg/m2. Os 27 casos envolveram a artéria descendente anterior esquerda (DAE) (n=18), artéria circunflexa esquerda (Cx) (n=7) e artéria coronária direita (ACD) (n=2). O QCIT médio foi de 219 (±61) mL/min e o RmicroCIT médio foi de 360 [290–450] mmHg min/L. A maioria dos casos incluídos tinha uma doença epicárdica mínima, com um FFR médio de 0,87 (±0,08) e apenas três casos atingindo o limiar clínico de significância do FFR (≤0,80). A estenose percentual média determinada pelo cirurgião, QCA 2D e QCA 3D foi de 10% [0–25%], 16% [0–31%] e 15% [0–33%], respectivamente. Nenhum dos casos incluídos tinha doença epicárdica difusa. Utilizando um limiar de 460 mmHg min/L25-27, cinco (25%) pacientes tinham uma DVM clinicamente significativa avaliada pela RmicroCIT.
O método da parede homogénea porosa
O método de limitação de parede homogénea porosa deu um QCFD médio de 219 (±86) mL/min. Houve uma correlação estatisticamente significativa entre QCFD e QCIT (r=0,473, p=0,006), passando e regressão Bablok identificou diferenças constantes e proporcionais entre técnicas (coeficiente c -202, 95% CI -633 a -20; m coeficiente 2,03, 95% CI 1,15 a 4,07), o delta médio entre técnicas foi zero e os limites de concordância de 95% Bland-Altman foram de -168 a +168 mL/min. As diferenças proporcionais entre QCFD e QCIT caracterizavam-se por um aumento do enviesamento a taxas de fluxo mais elevadas, visualmente representadas pela análise Bland-Altman. Foi também observada uma correlação significativa entre RmicroCFD e RmicroCIT (r=0,647, p=0,0001), estavam presentes diferenças constantes e proporcionais (coeficiente c -400, 95% CI -950 a -90; coeficiente m 2,07, 95% CI 1,15 a 3,67), o delta médio entre técnicas era de +30 mmHg min/L e os limites de concordância de 95% Bland-Altman eram de -210 a +480 mmHg min/L.
O Método de Limite Regional da Parede Porosa
O método regional de limite de parede porosa deu um QCFD médio de 219 (±96) mL/min. A correlação entre QCFD e QCIT foi significativa (r=0,429, p=0,0127), passando e regressão Bablok identificou diferenças constantes e proporcionais entre técnicas (coeficiente c -220, 95% CI -687 a -16; m coeficiente 2,12, 95% CI 1,18 a 4,19), o delta médio entre técnicas foi zero e os limites de concordância de 95% Bland-Altman foram de -175 a +175 mL/min. O acordo entre QCFD e QCIT não foi melhor nem para as técnicas homogéneas nem para as técnicas regionais (t=0,0023, p=0,998). Foi também observada uma correlação significativa entre RmicroCFD e RmicroCIT (r=0,586, p=0,0006), estavam presentes diferenças constantes e proporcionais (coeficiente c -400, 95% CI -1030 a -60; coeficiente m 2,09, 95% CI 1,04 a 3,90), o delta médio entre técnicas foi de +37 mmHg min/L e os limites de concordância de 95% Bland-Altman foram de -220 a +540 mmHg min/L. O acordo entre a RmicroCFD e a RmicroCIT não foi melhor nem para os métodos homogéneos nem para os regionais (U=363, p=0,944). Com um limiar de 460 mmHg min/L, sete (35%) pacientes tinham MVD clinicamente significativos avaliados pela RmicroCFD. Utilizando a RmicroCIT como medida padrão de ouro, a sensibilidade, especificidade, valor preditivo positivo e valor preditivo negativo da técnica CFD foram 80%, 80%, 57% e 92%, respectivamente.
Determinantes do cumprimento
Certas características do paciente e do recipiente pareciam influenciar o acordo entre a CFD e as medições invasivas. Para resp. homogéneo métodos de fronteira de parede porosa regional, Q concordância correlacionada significativamente com a queda de pressão transversal (Pa-Pd) (r=0,449, p=0,0094; r=0,391, p=0,0217), FFR (r=-0,399, p=0,0196; r= -0,334, p=0,0441) e percentagem de estenose avaliada por 2D (r=0,355, p=0,0345; r=0,472, p=0,0065) e 3D QCA (r=0,369, p=0,0292; r=0,489, p=0,0048). Isto significou que, tanto para os métodos homogéneos como regionais, o acordo entre QCFD e QCIT melhorou para casos com maior carga de doença identificados por estudos de fio de pressão, QCA 2D e QCA 3D. Para o método regional, o acordo Q também correlacionou com a estenose avaliada visualmente (r=0,371, p=0,0282).
Para o método Rmicro, tanto o método homogéneo como o regional estão correlacionados com a queda de pressão transversal (r=0,359, p=0,0330; r=0,340, p=0,0415, respectivamente) e FFR (r=-0,368, p=0,0295; r=-0,364, p=0,0310, respectivamente), mas nenhum efeito foi observado para a avaliação da estenose. Isto significou, tanto para as técnicas homogéneas como regionais, que o acordo entre RmicroCFD e RmicroCIT melhorou nos casos com maior carga de doença avaliada por testes de fio de pressão, enquanto que a carga de doença avaliada por estenose percentual não foi associada ao acordo.
Variabilidade intra-operador
Para os métodos de confinamento de paredes porosas homogéneas e regionais, a variabilidade QCFD foi de 7,8% (±4,2%) e 5,6% (±2,7%), respectivamente. Para a RmicroCFD foi de 2,6% [4,6–6,1%] e 3,2% [1,9–10,2%] respectivamente. A variabilidade intra-observador não diferiu entre técnicas homogéneas e regionais tanto para QCFD (U=33, p=0,218) como para RmicroCFD (U=45, p=0,739).
Fluxo coronário na entrada, saída e ramos laterais regionalizáveis
No estudo retrospectivo, foi validado um método regionalizado de contorno de parede porosa para simular a arma lateral Q e os resultados comparados com os do método homogéneo original [15]. O principal objectivo era a regionalização do fluxo do braço lateral e do braço principal. Isto foi conseguido sem alterar significativamente o fluxo global no braço lateral em comparação com o método homogéneo. O novo método regionalizado correlacionado com as medições do IRC com um desvio de zero e um limite de concordância de 95% de ±175 mL/min. A concordância com medidas clínicas invasivas foi subóptima, o que pode ser devido à inclusão de múltiplos casos INOCA com estenose e gradiente de pressão mínimos.
Durante a angiografia e avaliação do fio de pressão, o fluxo coronário pode agora ser regionalizado e diferenciado na entrada, saída e ramos laterais. O efeito da doença epicárdica no acordo sugere que o modelo é mais adequado para casos com estenose perto dos ramos laterais.
Literatura:
- Taylor DJ MA, et al.: Validation of a novel numerical model to predict regionalized blood flow in the coronary arteries. EurHeartJ 2023.
https://doi.org/10.1093/ehjdh/ztac077 - Gould KL, Lipscomb K, Hamilton GW: Physiologic basis for assessing critical coronary stenosis. Instantaneous flow response and regional distribution during coronary hyperemia as measures of coronary flow reserve. Am J Cardiol 1974;33: 87–94.
- De Bruyne B, Paulus WJ, Vantrimpont PJ, et al.: Transstenotic coronary pressure gradient measurement in humans: in vitro and in vivo evaluation of a new pressure monitoring angioplasty guide wire. J Am Coll Cardiol 1993;22: 119–126.
- Fearon WF, Balsam LB, Farouque HM, et al.: Novel index for invasively assessing the coronary microcirculation. Circulation 2003;107: 3129–3132.
- Ghobrial M, Haley HA, Gosling R, et al.: The new role of diagnostic angiography in coronary physiological assessment. Heart 2021;107: 783–789.
- Aarnoudse W, Van’t Veer M, Pijls NH, et al.: Direct volumetric blood flow measurement in coronary arteries by thermodilution. J Am Coll Cardiol 2007;50: 2294–2304.
- van’t Veer M, Adjedj J, Wijnbergen I, et al.: Novel monorail infusion catheter for volumetric coronary blood flow measurement in humans: in vitro validation. EuroIntervention 2016;12: 701–707.
- Morris PD, Gosling R, Zwierzak I, et al.: A novel method for measuring absolute coronary blood flow & microvascular resistance in patients with ischaemic heart disease. Cardiovasc Res 2020;117: 1567–1577.
- Gosling RC, Sturdy J, Morris PD, et al.: Effect of side branch flow upon physiological indices in coronary artery disease. J Biomech 2020;103: 109698.
- Pijls NH, van Son JA, Kirkeeide RL, et al.: Experimental basis of determining maximum coronary, myocardial, and collateral blood flow by pressure measurements for assessing functional stenosis severity before and after percutaneous transluminal coronary angioplasty. Circulation 1993;87: 1354–1367.
- Morris PD: Computational fluid dynamics modelling of coronary artery disease. PhD thesis. University of Sheffield 2015. https://etheses.whiterose.ac.uk/11772/1/CFD Modelling of CAD Morris_
submitted.pdf - Brown AG, Shi Y, Marzo A, et al.: Accuracy vs. computational time: translating aortic simulations to the clinic. J Biomech 2012;45: 516–523.
- Murray CD: The physiological principle of minimum work: I. The vascular system and the cost of blood volume. Proc Natl Acad Sci USA 1926;12: 207.
- Huo Y, Kassab GS: Intraspecific scaling laws of vascular trees. J R Soc Interface 2012;9: 190–200.
- Kamiya A, Togawa T: Optimal branching structure of the vascular tree. Bull Math Biophys 1972;34: 431–438.
- Murray CD: The physiological principle of minimum work: I. The vascular system and the cost of blood volume. Proc Natl Acad Sci U S A 1926;12: 207–214.
CARDIOVASC 2023; 22(1): 32–34











