A diabetes tipo 1 é uma das doenças metabólicas mais comuns em crianças e adolescentes. O diagnóstico de diabetes tipo 1 é um fardo considerável para as pessoas afectadas e para as suas famílias – especialmente em crianças pequenas. Graças ao desenvolvimento de terapias de insulina e imunomoduladoras à base de medicamentos e aos crescentes avanços tecnológicos, estão disponíveis opções terapêuticas cada vez mais inovadoras para atingir os valores-alvo definidos internacionalmente. A terapia mais moderna atualmente disponível consiste na associação de um sistema de sensores, de um algoritmo de controlo e de uma bomba de insulina, o sistema AID (administração automática de insulina).
A diabetes tipo 1 é uma das doenças metabólicas mais comuns em crianças e adolescentes. Atualmente (2021), existem na Suíça 26 642 pessoas com diabetes tipo 1, com uma incidência de cerca de 20 novos casos por cada 100 000 crianças e adolescentes com menos de 16 anos de idade. A idade média aquando do diagnóstico foi de 8,8 anos (dados cortesia de Daniel Konrad, Sociedade Suíça de Endocrinologia e Diabetologia Pediátrica). Há anos que se observa um aumento da incidência na infância e na adolescência. Parte-se do princípio de que o número de casos duplicará de 20 em 20 anos. As crianças que adoecem são cada vez mais jovens, pelo que a carga patológica acumulada de glicose e o risco de doenças cardiovasculares secundárias são correspondentemente maiores. De acordo com as estimativas estatísticas, a perda de esperança de vida para a diabetes que se manifesta antes dos 10 anos de idade é de cerca de 17 anos, dependendo, evidentemente, do controlo metabólico [1,2].
Pode fazer o teste CME na nossa plataforma de aprendizagem depois de rever os materiais recomendados. Clique no botão seguinte:
Especialmente desde o estudo DCCT [3], reconheceu-se a importância de manter os níveis de glicose dentro de um intervalo-alvo definido, a fim de evitar complicações subsequentes. O diagnóstico da diabetes tipo 1 é, por isso, também um fardo considerável para as pessoas afectadas e para as suas famílias – especialmente na primeira infância. Graças ao desenvolvimento de terapias de insulina e imunomoduladoras à base de medicamentos e aos crescentes avanços tecnológicos, estão disponíveis opções terapêuticas cada vez mais inovadoras para atingir os valores-alvo definidos internacionalmente. A terapia mais moderna atualmente disponível consiste na associação de um sistema de sensores, de um algoritmo de controlo e de uma bomba de insulina, o sistema AID (administração automática de insulina) .
Desenvolvimento da tecnologia da diabetes
A terapêutica com bomba de insulina (CSII) tem sido utilizada por rotina na medicina de adultos desde a década de 1980. Nos anos 2000, estabeleceu-se cada vez mais como uma terapia padrão para crianças e adolescentes. O desenvolvimento posterior dos sensores de glucose permitiu sistemas de bomba de insulina assistidos por sensores, ou seja, o acoplamento do sensor e da bomba de insulina. [4,5] Inicialmente, era possível interromper o fornecimento de insulina em caso de hipoglicemia (LGS, Low Glucose Suspend) (PARADIGM VEO) e, mais tarde, uma interrupção preditiva e antecipada do fornecimento de insulina em caso de hipoglicemia iminente (PLGM, Predictive Low Glucose Management) (MiniMed 640G). Dependendo do sistema, o fornecimento de insulina é interrompido durante 5-120 minutos até que um valor-alvo de glicose definido seja novamente atingido em segurança. Nos últimos anos, os sistemas AID levaram a terapia com insulina para o nível seguinte de controlo automático.
Ao mesmo tempo, pessoas ambiciosas com diabetes de tipo 1 (“Looper Community”, “#WeAreNotWaiting”), que não queriam esperar por sistemas disponíveis no mercado, desenvolveram elas próprias algoritmos de código aberto e instruções de construção, associaram-nos a bombas de insulina convencionais e a sistemas CGM e converteram-nos em sistemas semi-automatizados. Estes sistemas de fonte aberta ou do-it-yourself (DIY) são sujeitos a um processo de melhoria contínua pelos utilizadores, conduzem a resultados bons a muito bons e promoveram o desenvolvimento de sistemas autorizados comercialmente [6,7]. No entanto, ao utilizar estes sistemas de bricolage, deve ter em conta que a responsabilidade do fabricante expira quando estes dispositivos médicos são utilizados para fins diferentes dos especificados pelo fabricante. Não estão sujeitos a um procedimento de autorização. Ao contrário dos medicamentos, que também podem ser utilizados fora da autorização (utilização não contemplada na rotulagem) com a indicação adequada e o consentimento dos pais, esta opção não está disponível para os dispositivos médicos apenas por razões legais.
Devido aos dados convincentes e à experiência consistentemente positiva em todos os grupos etários, os sistemas AID são recomendados nas Directrizes de Consenso da ISPAD [8,9] e também nas directrizes S3 da Sociedade Alemã de Diabetes [10] em todos os grupos etários.
AID – Dosagem automática de insulina
Os sistemas AID são constituídos por três componentes: Um sensor de glucose, um algoritmo de cálculo e uma bomba de insulina. O algoritmo de cálculo é integrado na bomba de insulina, numa aplicação para smartphone ou num dispositivo portátil separado e acoplado ao sistema de sensores. O algoritmo de cálculo controla a administração de insulina basal adaptativa.
Os sistemas AID atualmente disponíveis no mercado baseiam-se em diferentes algoritmos de cálculo que provêm originalmente da tecnologia de controlo industrial. O princípio básico é que os valores de glicose são medidos e o algoritmo determina a diferença entre o valor atual e um valor-alvo definido, utilizando-o para calcular a alteração na variável manipulada a fornecer. A variável de controlo, a insulina, é libertada e o ciclo recomeça. Existem três algoritmos de cálculo principais diferentes que podem ser utilizados [11].
| Critérios de seleção para uma AID |
| – Restrição de idade |
| – Quantidade de insulina/peso corporal |
| – Controlo: aplicação, bomba, dispositivo separado |
| – Mangueira sim/não? |
| – Preferência de sensor |
| – Problemas de pele |
| – Facilidade de utilização |
| – Carregamento automático de dados |
PID (Proporcional-Integral-Derivativo)
Este algoritmo é relativamente simples, sem a simulação complexa de uma curva de glicose. Funciona da mesma forma que um controlador de temperatura na tecnologia de aquecimento, que tenta manter a temperatura ambiente constante num valor-alvo definido. Requer apenas a definição de alguns parâmetros, como a duração da ação da insulina e os rácios de IA, mas só pode compensar as fortes flutuações da glicose de forma limitada (MiniMed 780G).
MPC (Controlo Preditivo de Modelos)
Esta baseia-se num modelo de referência que tenta melhorar iterativamente as variáveis do processo. A evolução atual dos valores é comparada com a referência. Este valor é utilizado para calcular a dimensão da alteração da variável manipulada para regressar ao modelo de referência. A qualidade das variáveis do processo é crucial (CamAPS FX, myLife; Control IQ, Tandem; OmniPod 5, Insulet; DBLG1, Diabeloop).
Lógica difusa
Trata-se de um modelo matemático de incerteza que é utilizado, por exemplo, em sistemas inteligentes de controlo de semáforos e que adapta a duração da fase do semáforo ao volume de tráfego. Consegue lidar com a imprecisão das decisões humanas e faz ajustes de acordo com o princípio “se-então”. Para tal, o algoritmo necessita de muitos cenários possíveis, uma vez que só pode funcionar em cenários conhecidos [12].
O desafio para todos os algoritmos é a existência de muitos factores de influência desconhecidos. Durante a noite, podem ser atingidos níveis normais de glucose no intervalo alvo, com um pequeno intervalo de flutuação. Em contrapartida, o decorrer do dia está sujeito a muitos factores de influência variáveis, como as diferentes refeições, as flutuações do stress psicológico ou a atividade física espontânea. A principal diferença entre os sistemas AID reside nos parâmetros que podem ser ativamente alterados pelo utilizador e os que são predefinidos pelo sistema. Este é também um fator decisivo nos conselhos dados sobre a seleção do sistema.
| Valores-alvo para o controlo metabólico |
| – HbA1c <7% (53 mmol/mol) |
| – Tempo no intervalo (TiR) 70-180 mg/dl (3,9-10 mmol/l): >70% |
| – Tempo abaixo do intervalo (TbR) 54-70 mg/dl (3,0-3,9 mmol/l): <4% |
| – Tempo abaixo do intervalo (TbR) <54 mg/dl (3,0 mmol/l): <1% |
| Futuro: Tight in Tight Range (TiTR) 70-140 mg/dl (3,9-7,8 mmol/l): >50% [22] |
Os sistemas AID atualmente disponíveis são sistemas “AID híbridos” com um fornecimento de insulina adaptável, basal e independente da alimentação. Os bólus de insulina prandial e os bólus de correção raramente necessários têm ainda de ser introduzidos manualmente, daí a designação “AID híbrido”.
O desenvolvimento técnico destes sistemas está a progredir rapidamente, pelo que se podem esperar novos sistemas, em média, de 18 em 18 meses. Os sistemas autorizados na Europa são apresentados no quadro 1. O mylife Ypsopump com a aplicação mylife CamAPS FX, o Tandem t:slim X2 com Control IQ e o MiniMed 780G da Medtronic são sistemas AID para crianças e adolescentes que podem ser prescritos na Suíça. Atualmente, só existe um sistema disponível, especialmente para as famílias com crianças pequenas, para as quais é particularmente difícil conseguir um controlo metabólico próximo do normal. Na Alemanha, o OmniPod 5 também pode ser prescrito para crianças a partir dos 2 anos de idade desde o outono de 2023.
Que sistema AID para quem?
A decisão a favor de um sistema AID é individual. Nem todos os sistemas se adaptam a todas as pessoas. Vários factores desempenham um papel na decisão. Em primeiro lugar, deve ter em conta as restrições de idade. Para crianças <6 anos, apenas um sistema AID (CamAPS FX a partir de 1 ano) está atualmente disponível na Suíça [13]. Na Alemanha, o OmniPod 5 (a partir de dois anos) é um segundo sistema disponível para crianças <6 anos. A partir dos seis anos, o t:slim X2 Control IQ é outra opção e, a partir dos sete anos, o MiniMed 780G [14,15]. Para além do limite de idade, o peso corporal ou a quantidade mínima de insulina também podem desempenhar um papel na decisão. É importante considerar se o controlo deve ser feito através de uma aplicação para smartphone, da bomba de insulina ou de uma unidade de controlo separada. Outro fator é a facilidade de utilização, a aplicação principalmente através de ícones (CamAPS FX) para barreiras linguísticas ou refeições fixas (CamAPS FX) para discalculia pode ser útil. Se o OmniPod 5 estiver disponível, a questão de uma bomba de insulina com ou sem tubo é frequentemente central [16]. Ao tomar uma decisão, deve ter em conta a preferência por um sistema de sensores ao qual a bomba de insulina possa ser acoplada. Se tiver um problema de pele devido à intolerância a determinadas composições de gesso ou de caixa, isso pode limitar as opções de seleção. Um último fator decisivo a favor ou contra um sistema AID pode ser o software. Cada sistema AID pode ser lido diretamente através de software; até à data, não existe um software compatível com todos os sistemas, ou seja, cada instituição de controlo deve poder adquirir e pagar diferentes sistemas de software.
Para simplificar o processo de decisão, seria desejável que as três componentes do sistema AID fossem livremente combináveis. A Food and Drug Administration (FDA) dos EUA estabeleceu o objetivo de alcançar esta interoperabilidade e definiu objectivos e normas para sensores e bombas de insulina. Na Europa, o objetivo da interoperabilidade com o Regulamento Dispositivos Médicos, que entrou em vigor em maio de 2021, ainda não é previsível [17]. Desde novembro de 2022, o “MyLife CamAPS FX” é, pelo menos, um sistema AID que pode ser utilizado com dois sensores de glicose diferentes. Prevê-se também que o “t:slim X2 Control IQ” seja compatível com dois sistemas de sensores diferentes (Dexcom G6 e G7) no início de 2024.
Destino à vista – com a AID
Em geral, o início precoce da terapêutica com bomba de insulina nos primeiros seis meses após o diagnóstico é superior à utilização mais tardia, dois a três anos após a manifestação da diabetes. A comparação de mais de 8332 doentes de 311 centros de diabetes na Alemanha, Suíça, Áustria e Luxemburgo mostra que a utilização precoce de uma bomba de insulina em crianças e adolescentes levou a um melhor controlo metabólico, a uma hipoglicemia menos grave e a melhores níveis de pressão arterial e de colesterol [18]. A eficácia e a segurança dos sistemas AID foram já amplamente avaliadas. Em comparação com todas as outras formas de terapia, os valores-alvo recomendados internacionalmente são mais fáceis de alcançar com os sistemas AID. O objetivo é atingir valores de HbA1c <7% (53 mmol/mol), tempo no intervalo (TiR) >70% (aprox. 16 horas por dia), tempo abaixo do intervalo (TbR) <4% (<1 hora por dia). São descritos valores médios de glicose mais baixos, menor variabilidade na progressão da glicose, melhor qualidade do sono e menor tempo despendido na gestão da diabetes [19–21].
Em resumo, os sistemas AID, independentemente do sistema utilizado com o algoritmo, conduzem a resultados terapêuticos significativamente melhores. Isto significa, por sua vez, que estão a ser discutidos objectivos terapêuticos ou valores-alvo mais restritos, como 50% de Time in Tight Range (TiTR 70-140 mg/dl ou 3,9-7,8 mmol/l) [23,24], que já podem ser aplicados e alcançados na Suécia, por exemplo. Em geral, os utilizadores que já atingem um TiR elevado no início da terapia AID obtêm os melhores resultados. Por outro lado, aqueles que inicialmente têm um controlo metabólico demasiado elevado são os que mais beneficiam em termos percentuais [25].
Como funciona um sistema AID?
Ajuda e correção
Todos os sistemas AID podem corrigir as excursões de glicose aumentando a administração de insulina. Dependendo do sistema, a correção automática é efectuada através de bólus de correção automática (t:slim X2 Control IQ), modulação da taxa basal adaptativa (MiniMed 780G, OmniPod 5, CamAPS FX) e/ou microbolos adicionais (MiniMed 780G, OmniPod 5) (Fig. 1). Se, por exemplo, a correção for efectuada através de microbolos adicionais ou bolos de correção automáticos, a taxa basal previamente regulada é subsequentemente reduzida de novo, de modo a que a insulina basal e o bolus de correção não possam ser claramente diferenciados. Isto significa que o pressuposto de longa data de uma relação basal/bolus de 50:50 ou 60:40 deve ser abandonado. Em última análise, não importa se a insulina recebida é basal ou em bolus.
Gestão das refeições com AID
Em todos os sistemas disponíveis no mercado, a insulina à hora das refeições tem de ser administrada manualmente. O anúncio da refeição deve ser introduzido diretamente na bomba de insulina (MiniMed 780G, t:slim X2 Control IQ), numa unidade de controlo (OmniPod 5) ou através de uma aplicação para smartphone (CamAPS FX). Para além de introduzir os hidratos de carbono em gramas exactas, em alguns sistemas podem ser predefinidas refeições semi-quantitativas ou podem ser utilizados factores de cálculo (CamAPS FX). Embora o cálculo dos hidratos de carbono continue a desempenhar um papel importante, está a tornar-se menos importante, uma vez que os objectivos internacionais também podem ser alcançados com quantidades fixas e personalizadas de hidratos de carbono [26]. Os desvios de quantidade de 10-20% podem, normalmente, ser facilmente compensados pelo sistema. A insulina em bolus para as refeições é calculada utilizando o rácio insulina/carbohidratos (ICR = Insulin Carb Ratio). Isto define quantos gramas de hidratos de carbono são cobertos por uma unidade de insulina (U). É importante formar os utilizadores em conformidade, uma vez que não é fácil repensar a forma como os cálculos KE ou BE têm sido efectuados durante anos e existe um elevado potencial de erro. Continua a ser necessária uma revisão regular do ICR e, nalguns casos, é também necessária formação de acompanhamento.
A taxa basal deve também ser regularmente ajustada às necessidades actuais. No sistema “Control IQ”, isto é necessário para a implementação da terapia AID, em todos os outros sistemas é necessário como backup.
A excursão de glucose pós-prandial não deve exceder 60 mg/dl (3,3 mmol/l) do valor de base pré-prandial 2-3 horas após a refeição (Fig. 2 ). As quantidades de hidratos de carbono de 60-80 g podem normalmente ser bem cobertas. Com quantidades muito grandes de hidratos de carbono, pode ser definido um bólus máximo, se necessário, para proteger contra uma administração excessiva de insulina e hipoglicemia consecutiva.
A insulina tende a ser menos necessária nas grandes refeições. Para além do cálculo das quantidades de hidratos de carbono, era útil, com as bombas de insulina convencionais, calcular as unidades de gordura-proteína (FPE) para refeições ricas em gordura e proteínas, de modo a utilizar eficazmente funções como o “bolus duplo” ou o “bolus retardado”. Alguns sistemas AID oferecem também a possibilidade de responder explicitamente a refeições que contenham gorduras e proteínas, por exemplo, introduzindo um “bolus duplo” ou “bolus retardado” (t:slim X2 Control IQ) ou alterando a reatividade à glicose introduzindo refeições de absorção lenta (CamAPS FX). Outros sistemas reagem da mesma forma que uma correção, modulando a taxa basal ou emitindo auto-correcções adicionais.
Para além da introdução quase exacta de hidratos de carbono, o momento do intervalo de alimentação em bolus iniciado manualmente continua a desempenhar um papel importante. O bólus de refeição deve ser administrado pelo menos 10, de preferência 20 minutos antes da refeição. Se a administração for atrasada, a administração atual de insulina é aumentada pelo algoritmo devido ao aumento do nível de glicose. Um bólus iniciado demasiado tarde durante ou após a refeição não é incluído no cálculo, uma vez que conduziria ao empilhamento de insulina e, provavelmente, a hipoglicemias consecutivas (Fig. 3). Como regra geral, recomenda-se que: Se se esqueceu de administrar um bólus de refeição atempadamente, metade do bólus de refeição deve ser administrado 30-60 minutos após a refeição, ou seja, antes de o algoritmo tentar compensar toda a refeição. Se tiverem passado mais de 60 minutos após a refeição, o utilizador pode administrar um bolus de correção recomendado pelo sistema. Em geral, a hora do dia (especialmente ao pequeno-almoço), o valor atual de glicose, a tendência da glicose e a composição da refeição devem ser tidos em conta para administrar o bólus de refeição atempadamente.
AID e atividade física
A adaptação da terapia ao desporto é um grande desafio, independentemente da forma de terapia. Devem ser tidos em conta numerosos factores de influência, como a hora do dia, a intensidade, o tipo e a duração do desporto, o nível de aptidão física individual, a atividade física habitual ou novas formas de exercício, o ciclo menstrual, mas também o valor e a tendência actuais da glicose. Mesmo que todos os factores mencionados sejam tidos em conta e que o desporto seja praticado de forma razoavelmente normalizada, a curva da glicose varia sempre. Não só o desporto, mas também a gestão da atividade física na vida quotidiana que não é deliberadamente definida como desporto, como ir de bicicleta para a escola, correr para o autocarro ou brincar no infantário ou durante as férias escolares, representa frequentemente um desafio individual diário entre a hipo e a hiperglicemia. Os sistemas AID podem ajudar a manter os níveis de glicose estáveis antes, durante e após a atividade física e a reduzir a hipoglicemia mesmo até 24 horas após o exercício.
Enquanto que sem AID, a gestão do desporto é conseguida através da redução da percentagem de insulina basal e/ou insulina prandial, os sistemas AID funcionam através do aumento do valor-alvo da glicose e da sensibilidade à insulina. O modo desportivo “CamAPS FX” “Ease off”, por exemplo, funciona com estes dois parafusos de ajuste. Pode ser configurado com um máximo de 24 horas de antecedência. A insulina em bolus mantém-se inalterada. No “modo de atividade”, o “Control IQ” aumenta o intervalo alvo para 140-160 mg/dl (7,8-8,9 mmol/l) e a sensibilidade à insulina. Com o sistema “MiniMed 780G”, o objetivo temporário pode ser aumentado para 150 mg/dl (8,3 mmol/l). As autocorrecções não são emitidas para o aumento temporário do valor-alvo. Ao utilizar o OmniPod 5 no modo de desporto, o valor-alvo da glicose também é aumentado para 150 mg/dl (8,3 mmol/l) e o fornecimento automático de insulina também é reduzido durante um período de 1-24 horas [27].
Em todos os sistemas, o modo de desporto ou de atividade deve, idealmente, ser definido pelo menos 1 a 2 horas antes do início da atividade física, especialmente do exercício aeróbico. Durante uma sessão de treino muito extenuante ou longa, por exemplo, num dia de competição, o modo desportivo pode permanecer ativado até 24 horas para reduzir a hipoglicemia causada pelo efeito de reabastecimento de glicogénio do músculo. Durante as sessões de treino anaeróbico e também de treino aeróbico intensivo mais curto, pode tentar-se deixar inicialmente o sistema AID em “modo normal”, uma vez que as hormonas contrainsulinas adrenalina, noradrenalina e cortisol conduzem inicialmente a um aumento da glicose, que pode exigir insulina correctiva. Idealmente, o valor da glucose deve situar-se entre 125 e 180 mg/dl (6,9-10 mmol/l) antes do início e após o fim do treino [28]. Se estiver planeado um treino curto e intensivo, um valor de glicose mais baixo é mais adequado para o início, enquanto um valor de glicose mais elevado é mais adequado para um treino mais longo e moderado. Os sistemas AID facilitam a gestão do desporto e do exercício, mas também atingem os seus limites quando se trata de uma atividade espontânea, muito intensa ou prolongada e o modo desportivo não é definido a tempo.
Personalização da terapia com AID
Devido à utilização predominante de sistemas CGM, o “Perfil Glicémico Ambulatório” (PGA) já substituiu o ajuste exclusivo da terapêutica através de protocolos de HbA1c e glicemia. Para além do valor de HbA1c, a análise de TiR, TbR, GMI, valores médios de glicose, amplitude de variação e também a duração do sensor são já padrão nas consultas de diabetologia. Com os sistemas AID, os dados contínuos em tempo real estão disponíveis na nuvem. Apenas o “t:slim Control IQ” continua a exigir que os dados do sistema sejam carregados ativamente. Para além dos parâmetros estatísticos do AGP, o comportamento individual dos utilizadores pode ser analisado com precisão, como a entrega atempada de um bolus de refeição ou a utilização de diferentes modos. Teoricamente, é possível um ajuste individualizado dos parâmetros em qualquer altura. Isto também abre novas possibilidades de cuidados individualizados e de qualidade garantida no domínio da telemedicina.
AID – um sucesso garantido?
AID e as coisas estão a correr bem? Não é assim tão simples, um sistema AID não é um sucesso garantido. Quanto mais jovem for a criança, maior será o esforço necessário para atingir os objectivos metabólicos. No caso de crianças pequenas, a responsabilidade pela terapia cabe aos seus cuidadores. As crianças pequenas ainda não estão preparadas para a escola. Consegue compreender e entender parcialmente alguns aspectos da sua terapia, mas não consegue ler ou fazer contas. A preparação para a escola começa na idade da escola primária. Só quando atingem a idade escolar, normalmente quando passam para o ensino secundário, é que as crianças são capazes de reconhecer e efetuar cálculos simples que são necessários para a decisão de administrar insulina. As exigências e os desafios que os pais têm de enfrentar até esta altura são correspondentemente elevados [29].
Independentemente da idade, é importante que as expectativas do sistema AID correspondente sejam tidas em conta. Antes de se tomar uma decisão a favor de um sistema ou de outro, devem ser demonstrados os sistemas disponíveis e os correspondentes sistemas aprovados e explicadas as suas vantagens e desvantagens. Uma vez selecionado o sistema, é essencial uma formação qualificada e adequada à idade. O sucesso terapêutico sustentável só pode ser alcançado se o sistema de AID for compreendido e se as exigências que impõe puderem ser satisfeitas de forma adequada e em conformidade com a situação [30,31]. Se as funções do sistema não forem adequadamente comunicadas e as necessidades e expectativas não forem satisfeitas, isso pode levar à interrupção prematura da terapia [32].
AID e stress mental
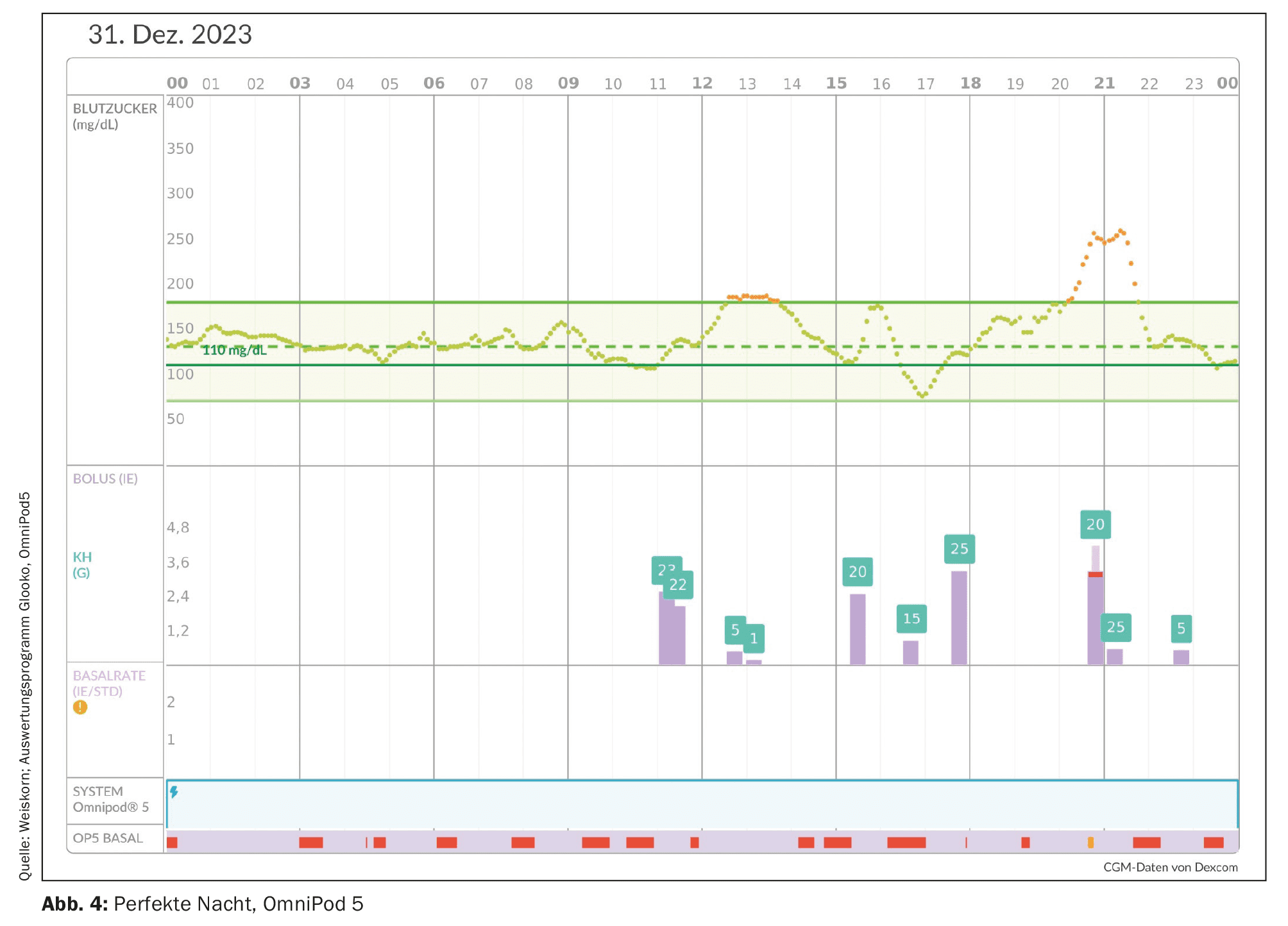
Um argumento a favor de um sistema AID é frequentemente a redução do stress psicológico e a melhoria da qualidade de vida. Isto é particularmente verdade para os pais que sofreram perturbações do sono noturno devido aos inúmeros alarmes noturnos de hipoglicemia iminente e de medições da glicemia. Com os sistemas AID, é possível obter bons valores de glucose com apenas uma pequena margem de flutuação, especialmente durante a noite. [33] A hipoglicemia nocturna e os alarmes são reduzidos e a qualidade do sono melhora significativamente (Fig. 4). Uma noite de sono repousante está associada a uma psique mais estável e pode reduzir as tendências para a depressão. Também é descrita uma redução da “hipoansiedade” [34].
Para as pessoas que têm dificuldade em tolerar os desvios da glicose para cima ou para baixo e que tendem a fazer correcções precipitadas, um sistema AID que assuma a correção de forma independente pode aliviar e reduzir o stress. No entanto, este mesmo ponto forte dos sistemas, a dosagem automática de insulina, pode também ter o efeito contrário. Se os utilizadores não confiarem no sistema, tiverem medo de perder o controlo ou de deixar a terapia a cargo do algoritmo, os objectivos da terapia não são alcançados e as expectativas são goradas.
Resumo e perspectivas
Na diabetologia pediátrica, os sensores de glicose e as bombas de insulina são a terapia padrão. O acoplamento de ambos os componentes e a combinação com um algoritmo para formar um sistema AID está a ser cada vez mais utilizado em todo o mundo. Os objectivos da terapia podem ser alcançados mais facilmente e os aspectos psicossociais podem ser melhorados. Para obter um sucesso terapêutico duradouro, a escolha de um sistema deve ser feita individualmente, tendo em conta todas as restrições de autorização, em conjunto com a família e a equipa de cuidados da diabetes. Um pré-requisito para uma utilização rentável é uma formação estruturada e adequada à idade, na qual se ensina a funcionalidade do sistema e a forma de o utilizar.
Os sistemas AID estão atualmente a ser objeto de um desenvolvimento contínuo, que culminará no sistema de “circuito totalmente fechado”. Para atingir este objetivo, são certamente necessários sistemas bi-hormonais, que são objeto de investigação atual, mas que ainda não estão disponíveis comercialmente.
O rápido desenvolvimento e crescimento dos sistemas comerciais de AID representa um grande desafio para as equipas de diabetes, no sentido de garantir cuidados de qualidade. Devem ser criadas estruturas que permitam o aconselhamento, a formação e a comunicação urgentes das funções pormenorizadas do sistema.
Em conclusão, todos os sistemas aprovados na Europa são seguros e eficazes e podem conduzir a um melhor controlo glicémico. Isto reflecte-se não só num TiR mais elevado, mas também em valores mais baixos de HbA1c e, em última análise, conduz a um menor risco de doenças secundárias associadas à diabetes e a uma redução dos encargos para as crianças e adolescentes com diabetes tipo 1 e respectivas famílias.
Mensagens para levar para casa
- Na diabetologia pediátrica, os sensores de glicose e as bombas de insulina são a terapia padrão. O acoplamento de ambos os componentes e a combinação com um algoritmo para formar um sistema AID está a ser cada vez mais utilizado em todo o mundo.
- Os objectivos da terapia podem ser alcançados mais facilmente e os aspectos psicossociais podem ser melhorados.
- Para obter um sucesso terapêutico duradouro, a escolha do sistema deve ser feita individualmente, em conjunto com a família e a equipa de tratamento da diabetes.
- Um pré-requisito para uma utilização rentável é uma formação estruturada e adequada à idade, na qual se ensina a funcionalidade do sistema e a forma de o utilizar. As crianças de tenra idade ainda não estão preparadas para a escola, pelo que a responsabilidade pela terapia cabe às pessoas que cuidam delas.
Conflitos de interesse
- Dr. Jantje Weiskorn, especialista em pediatria e medicina do adolescente, diabetologia; obesiologista. Interesses financeiros: Honorários de palestras: Amryt Pharma
- Dr. Felix Reschke, especialista em pediatria e medicina do adolescente, diabetologia e endocrinologia, medicina paliativa, aconselhamento genético especializado; interesses financeiros: Honorários de palestras: Kyowa Kirin
- Dra. Thekla von dem Berge, especialista em pediatria e medicina do adolescente, diabetologia; Interesses financeiros: Honorários de palestras: Medtronic, Ypsomed, Novo Nordisk, VitalAire, Ascensia e Sanofi
- Dra. Mareike Niemeyer, especialista em pediatria e medicina do adolescente, diabetologia; Interesses financeiros: Nenhum
- PD Dr. Torben Biester, especialista em pediatria e medicina do adolescente, diabetologia, medicina de emergência, aconselhamento genético especializado; interesses financeiros: Honorários de palestras: AstraZeneca, Insulet, Lilly, Medtronic, NovoNordisk, Roche, Sanofi, Ypsomed. – Conselho Consultivo: Ascensia, Medtronic, Insulet, Sanofi, Ypsomed
Literatura:
- Rawshani A, et al.: Excess mortality and cardiovascular disease in young adults with type 1 diabetes in relation to age at onset: a nationwide, register-based cohort study. Lancet 2018; 392: 477–486; doi: 10.1016/S0140-6736(18)31506-X.
- Arffman M, et al.: Long-term and recent trends in survival and life expectancy for people with type 1 diabetes in Finland. Diabetes Research and Clinical Practice 2023; 198: 110580.
- Diabetes Control and Complications Trial Research Group, N. D., Genuth S, et al.: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 30(14): 977–986.
- Forlenza GP, et al.: Predictive low-glucose suspend reduces hypoglycemia in adults, adolescents and children with type 1 diabetes in an at-home randomized cross-over study: results of the PROLOG Trial. Diabetes Care 2018; 41(10): 2155–2161.
- Biester T, et al.: «Let the Algorithm Do the Work»: Reduction of hypoglycemia using sensor-augmented pump therapy with predictive insulin suspension (smardguard) in pediatric type 1 diabetes patients. Diabetes Technol Ther 2017; 19(03): 173–182.
- Drew L, et al.: DIY «bionic pancreas» is changing diabetes care – what’s next? Nature 2023; 620: 940–941.
- Burnside MJ, et al.: Open-Source Automated Insulin Delivery in Type 1 Diabetes. N Engl J Med 2022; 397(10): 869–881.
- Sherr JL, Schoelwer M, Dos Santos TJ, et al: Diretrizes de Consenso da Prática Clínica ISPAD 2022: Tecnologias de diabetes: administração de insulina.
Pediatr Diabetes 2022; 23(8): 1406-1431; doi: 10.1111/pedi.13421. - Sundberg F, de Beaufort C, Krogvold L, et al.: ISPAD Clinical Practice Consensus Guidelines 2022: Managing diabetes in preschoolers. Pediatr Diabetes 2022; 23(8): 1496–1511; doi: 10.1111/pedi.13427.
- S3-Leitlinie Diagnostik, Therapie und Verlaufskontrolle des Diabetes mellitus im Kindes- und Jugendalter (https://register.awmf.org/de/leitlinien/detail/057-016).
- Biester T, Reschke R, et al.: Moderne Insulintherapie durch interaktive Systeme bei Kindern mit Diabetes mellitus Typ 1. Internistische praxis 2023; 66/4.
- Digital Corner AID-Systeme in der Praxis – Status quo und Potenzial der Diabetes Technologie.
- Tauschmann M, et al.: Closed-loop insulin delivery in suboptimally controlled type 1 diabetes: a multicenter, 12-week randomized trial. Lancet 2018; 392: 1321-1329; doi: 10.1016/S0140-6736(18)31947-0.
- Bergenstal RM, et al.: A comparison of two hybrid closed-loop systems in adolescents and young adults with type 1 diabetes (FLAIR): a multicenter, randomized, crossover trial. Lancet 2021; 397: 208-219; doi: 10.1016/S0140-6736(20)32514-9.
- Collyns OJ, et al.: Improved Glycemic Outcomes With Medtronic MiniMed Advanced Hybrid Closed-Loop Delivery: Results From a Randomized Crossover Trial Comparing Automated Insulin Delivery With Predictive Low Glucose Suspend in People With Type 1 Diabetes. Diabetes Care 2021; 44(4): 969-975; doi: 10.2337/dc20-225.
- Sherr JL, et al.: Safety and Performance of the Omnipod Hybrid Closed-Loop System in Adults, Adolescents, and Children with Type 1 Diabetes Over 5 Days under Free-Living Conditions. Diabetes Technol Ther 2020; 22(3): 174-184.
https://health.ec.europa.eu/system/files/2020-07/md_generic_ fs_en_0.pdf.- Kamrath C, et al.: Early versus delayed insulin pump therapy in children with newly diagnosed type 1 diabetes: results from the multicenter, prospective diabetes follow-up DPV registry. The Lancet Child & Adolescent Health 2021; 5(1): 17–25.
- Pease A, et al.: Time in Range for Multiple Technologies in Type 1 Diabetes: A Systematic Review and Network Metaanalysis. Diabetes care 2020; 43: 1967–1975.
- Jiao X, et al.: Better TIR, HbA1c, and less hypoglycemia in closed-loop insulin system in patients with type 1 diabetes: a meta-analysis. BMJ Open Diabetes Res Care 2022; 10(2).
- Beck RW, et al.: A Meta-Analysis of Randomized Trial Outcomes for the t:slim X2 Insulin Pump with Control_IQ Technology in Youth and Adults from Age 2 to 72. Diabetes Technol Ther 2023.
- Battelino T, Alexander CM, et al.: Continuous glucose monitoring and metrics for clinical trials: an international consensus statement. Lancet Diabetes Endocrinol 2022; doi: 10.1016/S2213-8587(22)00319-9.
- Passanisi S, et al.: Aiming for the Best Glycemic Control Beyond Time in Range: Time in Tight Range as a new CGM Metric in Children and Adolescents with Type 1 Diabetes using Different Treatment Modalities. Diabetes Technol Ther 2023; doi: 10.1089/dia.2023.0373.
- Beck RW, et al.: A Comparison of Continuous Glucose Monitoring-Measured Time-in-Range 70–180 mg/dl Versus Time-in Tight-Range 70–149 mg/dl. Diabetes Technol Ther 2023; doi: 10.1089/dia.2023.0380.
- Schoelwer MJ, et al.: Predictors of Time-in-Range (70-180 mg/dl) Achievend Using a Closed-Loop Control System. Diabetes Technol Ther 2021; doi: 10.1089/dia20200646.
- Petrovski G, Campbell J, et al: Anúncio de refeição simplificado versus contagem precisa de carboidratos em adolescentes com diabetes tipo 1 usando o sistema de circuito fechado híbrido avançado MiniMed 780G: um ensaio controlado randomizado comparando o controle da glicose. Diabetes Care 2023; 46(3): 544-550; doi: 10.2337/dc22-1692.
- Riddel MC, et al.: Exercise in adults with type 1 diabetes mellitus. Nature Reviews Endocrinology 2023; 19(2): 98–111.
- Moser O, et al.: Glucose management for exercise using continuous glucose monitoring (CGM) and intermittently scanned CGM (isCGM) systems in type 1 diabetes: position statement of the European Association for the Study of Diabetes (EASD) and of the International Society for Pediatric and Adolescent Diabetes (ISPAD) endorsed by JDRF and supported by the American Diabetes Association (ADA). Diabetologie 2020; 63(12): 2501–2520; doi: 10.1007/s00125-020-05263-9.
- Dehn-Hindenberg A, et al.: Long-term Occupational Consequences for Families of Children With Type 1 Diabetes: Mothers Take the Burden. Diabetes Care 2021; 44(12): 2656–2663.
- Messer LH, et al.: A Clinical Guide to Advanced Diabetes Devices and Closed-Loop Systems Using the CARES Paradigm. Diabetes Technol Ther 2019; 21(8): 462–469; doi: 10.1089/dia.2019.0105.
- Berget C, et al.: A Clinical Training Program for Hybrid Closed Loop Therapy in a Pediatric Diabetes Clinic. J Diabetes Sci Technol 2020; 14(2): 290–296; doi: 10.1177/1932296819835183.
- Lal RA, et al.: One Year Clinical Experience of the First Commercial Hybrid Closed-Loop System. Diabetes Care 2019; 42(12): 2190–2196.
- Bisio A, et al.: Sleep and diabetes-specific psycho-behavioral outcomes of a new automated insulin delivery system in young children with type 1 diabetes and their parents. Pediatr Diabetes 2021; 22: 495–502.
- Amigó J, et al.: Switching from treatment with sensor augmented pump to hybrid closed loop system in type 1 diabetes: Impact on glycemic control and neurophysiological testes in the real world. Diabetes Research and Clinical Practice 2023; 201: 110730.
HAUSARZT PRAXIS 2024; 19(5): 7–15