Los nuevos anticoagulantes orales (NOAK) se han convertido desde hace tiempo en parte de la práctica clínica diaria en la profilaxis del ictus por fibrilación auricular. Debido a su uso más sencillo, seguro y eficaz, se espera que sustituyan a la terapia con antagonistas de la vitamina K (AVK) en la mayoría de los pacientes. Sin embargo, como ocurre con cualquier terapia, hay algunos aspectos prácticos importantes que deben tenerse en cuenta para un uso correcto y seguro. El uso no selectivo de las sustancias debe evitarse en cualquier caso.
Los grandes estudios de registro de los nuevos anticoagulantes orales (NOAK) para la profilaxis del tromboembolismo en la fibrilación auricular – RE-LY (dabigatrán) [1], ROCKET-AF (rivaroxabán) [2], ARISTOTLE (apixabán) [3] y ENGAGE-TIMI 48 (edoxabán) [4] – han demostrado, que estas sustancias no sólo son al menos equivalentes, si no superiores, a los antagonistas de la vitamina K (AVK) en términos de prevención del ictus, sino que también reducen significativamente el riesgo de hemorragias graves y/o intracraneales. [5–7]. Sin embargo, uno de los mayores errores es considerar estas sustancias indiscriminadamente como medicamentos de “talla única” y utilizarlas de forma acrítica y poco selectiva. Este artículo resume diez aspectos importantes en la aplicación diaria (basándose en trabajos anteriores y complementándolos [5–9]).
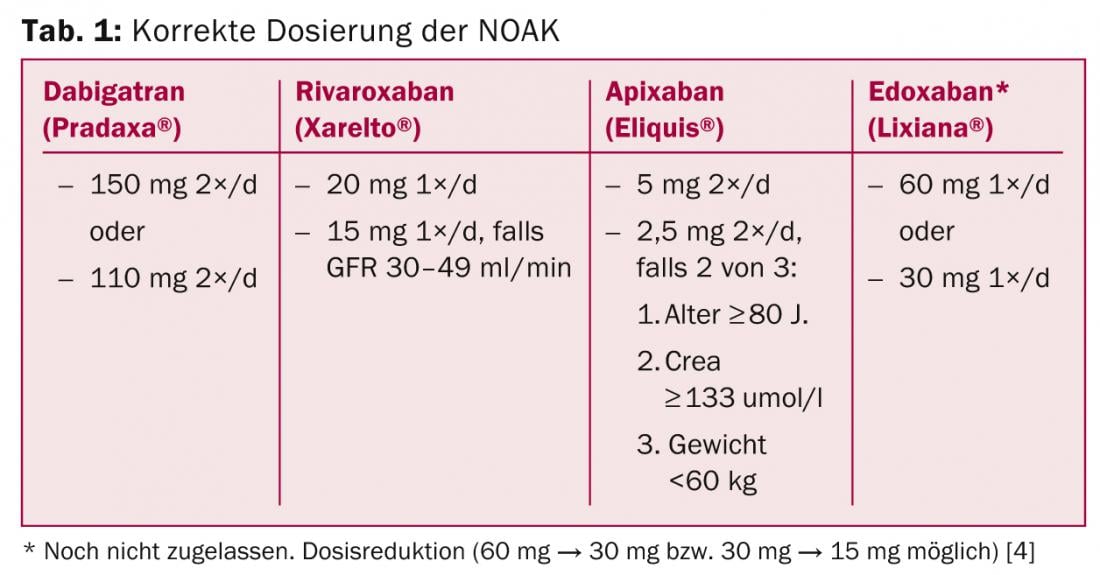
Pregunta 1: ¿Cuál es la dosis correcta?
La tabla 1 resume la dosis correcta de NOAK. Las desviaciones de esto son usos “fuera de etiqueta” y deben evitarse ya que no hay datos para ello (por ejemplo, prescribir 10 mg de rivaroxaban en pacientes con FVC y “alto riesgo de hemorragia”). La terapia inicial es mucho más fácil que con los AVK, ya que el efecto completo se produce al cabo de dos o tres horas, sin necesidad de puentear con heparina o NMH.
Pregunta 2: ¿Qué debo hacer si olvido una dosis?
El cumplimiento/adherencia a la medicación es fundamental con los NOAK y no debe perderse ninguna oportunidad para recordárselo al paciente. No obstante, los errores de dosificación se producen de forma natural en la práctica clínica diaria. Basándose en extrapolaciones farmacocinéticas, se recomienda que la dosis olvidada se tome hasta seis horas (para dosificación 2×/d, es decir, apixaban/dabigatran) o hasta doce horas (para dosificación 1×/d, es decir, rivaroxaban) después de la dosis programada [10]. Si el error no se advierte hasta después de esta ventana de tiempo, debe omitirse la dosis y continuar con la siguiente dosis programada.
Pregunta 3: ¿Qué hacer en caso de doble ingesta accidental?
Para los NOAK tomados 2×/d, en caso de doble dosis accidental, debe saltarse la siguiente dosis programada y reanudar el ciclo regular con la dosis después de la siguiente [10]. Con una dosificación de 1×/d, debe continuarse el ciclo normal, ya que después de 24 horas, incluso con una doble dosificación accidental, una gran parte de la sustancia ya se ha eliminado de nuevo.
Pregunta 4: ¿Qué ocurre si el paciente no está seguro de la ingesta?
No es infrecuente que en la vida cotidiana surjan situaciones en las que el paciente no esté seguro de si ya ha tomado su medicación o no. Para los NOAK tomados 2×/d, se recomienda no tomar otra dosis (para evitar la sobredosis, ya que la siguiente dosis se toma en 12 horas de todos modos). Con la ingesta de 1×/d, por otra parte, se recomienda tomar la dosis potencialmente olvidada más tarde, ya que la siguiente ingesta no tendrá lugar hasta dentro de 24 horas, lo que de otro modo daría lugar a un periodo más largo sin protección relevante [10].
Pregunta 5: ¿Cómo se utilizan los NOAK en la insuficiencia renal?
Los pacientes con insuficiencia renal representan una población de pacientes difícil, ya que tanto las complicaciones tromboembólicas como las hemorrágicas son más frecuentes [11, 12]. En la insuficiencia renal grave y la fibrilación auricular, los NOAK prácticamente no se han estudiado y, por tanto, no deben utilizarse (aunque también en este caso estén parcialmente aprobados) [13]. El problema es encontrar una buena alternativa, ya que los AVK también están formalmente contraindicados en caso de deterioro grave de la función renal. De hecho, se ha demostrado que el beneficio de los AVK disminuye con el deterioro creciente de la función renal [14]. No obstante, los AVK parecen ser actualmente la mejor opción para los pacientes con fibrilación auricular e insuficiencia renal grave, teniendo en cuenta las advertencias mencionadas anteriormente. Aquí, un ajuste óptimo del INR es más crucial que nunca.
La dosis de apixaban (50% de aclaramiento renal de la sustancia absorbida) y rivaroxaban (37% de aclaramiento renal) se reduce en función renal moderadamente deteriorada (GFR 50 – 30 ml/min). (Tab. 1). Ambos agentes han demostrado ser eficaces y seguros en este grupo de pacientes (en comparación con los AVK), demostrando el apixabán en particular un perfil de seguridad muy bueno en comparación con los AVK [11, 15]. Especialmente en presencia de otros factores de riesgo de hemorragia (como edad ≥ 80 años, puntuación HAS-BLED ≥ 3), se recomienda reducir la dosis de dabigatrán (aclaramiento renal del 80%) a 2 × 110 mg/d a partir de un FG <50 ml/min [13]. En principio, debe considerarse bien el uso de dabigatrán en pacientes con un FG <40 ml/min, ya que la experiencia ha demostrado que en estos pacientes puede producirse rápidamente un mayor deterioro de la función renal con la correspondiente acumulación de la sustancia, por ejemplo en el contexto de enfermedades intercurrentes, medicación conjunta (¡AINE!) o deshidratación.
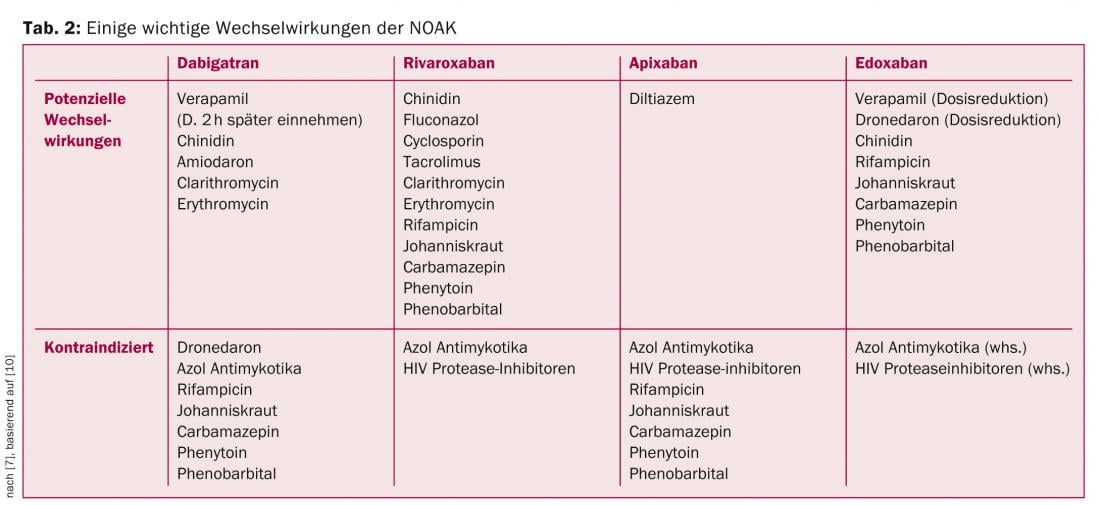
Pregunta 6: ¿Existen interacciones con otros medicamentos?
Aunque los NACO tienen un potencial mucho menor de interacciones medicamentosas que los AVK, existen algunas interacciones importantes que deben tenerse en cuenta. En la tabla 2 se resumen algunas de las interacciones más importantes, basadas en las recomendaciones de la EHRA [10].
Pregunta 7: ¿Cuál es el procedimiento en caso de hemorragia bajo los NOAK?
Las complicaciones hemorrágicas, especialmente las intracraneales y las que ponen en peligro la vida, se producen con mucha menos frecuencia con los NOAK que con los AVK.
Se están desarrollando antídotos específicos de acción rápida para los NOAK; sin embargo, lo más probable es que pasen varios años antes de que se introduzcan en la práctica clínica. En consecuencia, deben utilizarse procoagulantes no asépticos como el PCC, el aPCC o el FVIIa recombinante para una antagonización rápida. Esta situación no es totalmente distinta a la de los AVK, ya que también en este caso la antagonización “específica” por medio de la vitamina K es cualquier cosa menos rápidamente eficaz en la situación de urgencia. En principio, antagonizar la anticoagulación -ya sea mediante AVK o NOAK- no está exento de riesgos, ya que induce un estado procoagulante. Así pues, una normalización de los parámetros de coagulación no se correlaciona necesariamente con un mejor resultado clínico, especialmente tras una hemorragia intracraneal [16–18]. Las recomendaciones de la EHRA, que se basan principalmente en datos preclínicos y extrapolaciones farmacocinéticas, tienen en cuenta este hecho (Fig. 1) [10]. En consecuencia, el uso de procoagulantes sólo se recomienda en casos de hemorragia grave y potencialmente mortal, mientras que las medidas generales se utilizan principalmente en casos de hemorragia leve y moderada.
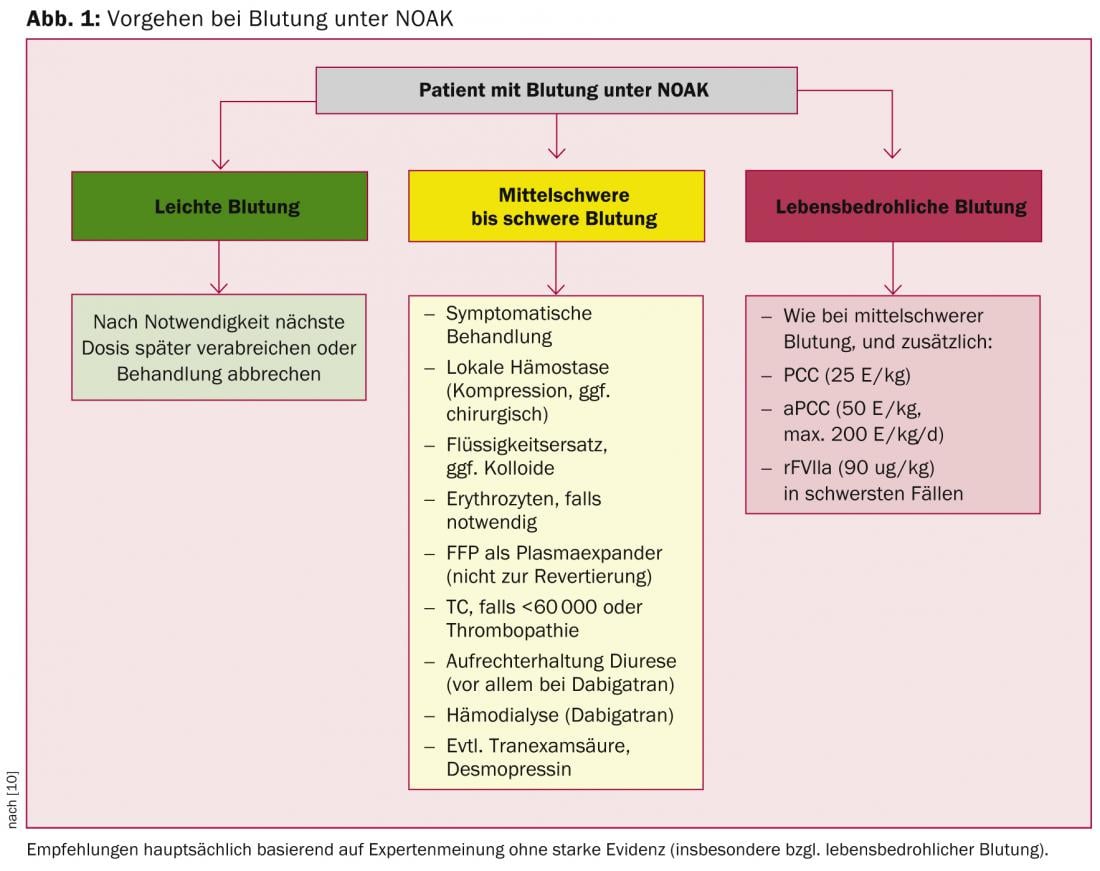
Pregunta 8: ¿Cuál es el mejor procedimiento para la “triple anticoagulación”?
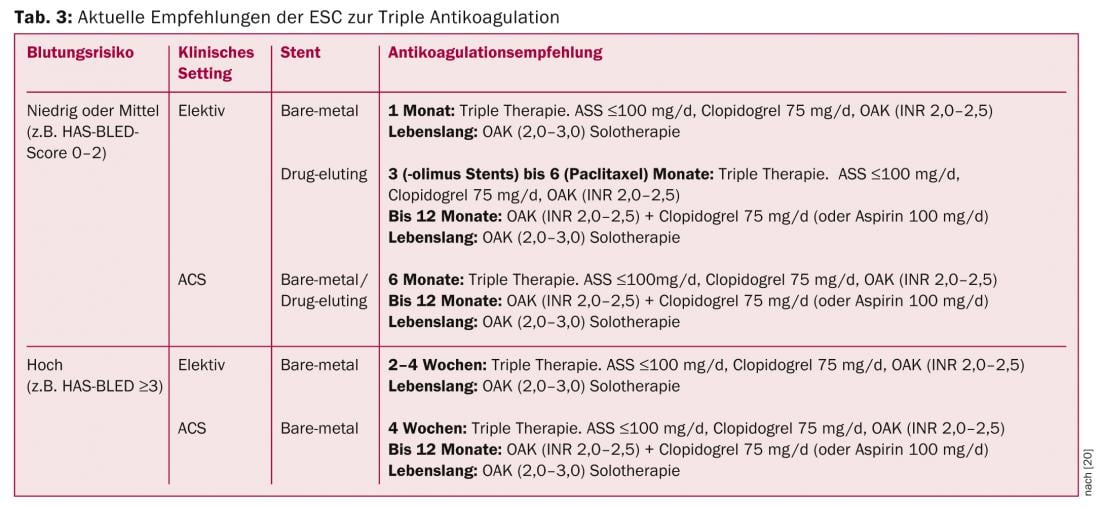
Los pacientes con fibrilación auricular que requieren formalmente un tratamiento antiagregante plaquetario dual (la llamada “triple anticoagulación”) además de anticoagulación plasmática (NOAK/VKA) debido a un SCA y/o a la implantación de un stent tienen un riesgo mucho mayor de sufrir hemorragias graves [19]. Actualmente, aparte de unos pocos pacientes del estudio RE-LY, no existen datos sobre el uso de NOAK en combinación con aspirina y clopidogrel. Del mismo modo, no se dispone de datos sobre la combinación de NOAK con los antagonistas de los receptores ADP de nueva generación prasugrel y ticagrelor. Por lo tanto, en la actualidad debe desaconsejarse la combinación de estas sustancias. Se espera que las recomendaciones se sigan ajustando a medida que surjan nuevos datos, tanto sobre los stents de última generación como sobre la combinación de NOAK y los nuevos antiagregantes plaquetarios. En la actualidad, sin embargo, el enfoque propuesto en las directrices de la ESC con AAS, clopidogrel y AVK parece ser la mejor alternativa (Tabla 3) [20]. En el estudio WOEST, publicado recientemente, se demostró que la combinación de clopidogrel y AVK es superior a la “triple anticoagulación” clásica, tanto en términos de episodios hemorrágicos como de criterios de valoración isquémicos [21]. En la vida cotidiana, la duración de la “triple anticoagulación” recomendada inicialmente en las directrices de la ESC ya se reduce considerablemente, dependiendo del entorno clínico.
Pregunta 9: ¿Pueden utilizarse los NOAK en cardioversión?
Los mejores datos sobre la cardioversión con NOAKs están disponibles para el dabigatrán (del estudio RE-LY): Este último fue igual de eficaz que el AVK en términos de ictus y hemorragias [22]. Para el rivaroxabán y el apixabán, las cifras de pacientes publicadas hasta ahora son menores, pero apuntan en la misma dirección. ¡El factor decisivo en la vida cotidiana es el cumplimiento! Si se puede garantizar que el paciente ha tomado el NOAK con regularidad durante las tres (preferiblemente cuatro o cinco) semanas anteriores, la cardioversión bajo NOAK parece ser factible con seguridad [10]. De lo contrario, debe excluirse un trombo mediante ETE. Los estudios y registros en curso proporcionarán más datos sobre el procedimiento óptimo.
Pregunta 10: ¿Cómo funciona la gestión perioperativa?
Debido a la farmacocinética de los NOAK, no es necesario realizar puentes perioperatorios (algo que también se practica cada vez menos con los AVK). La recomendación de suspender el NOAK se basa en el riesgo de hemorragia del procedimiento, así como en la función renal (mayor influencia con dabigatrán; Tab. 4).
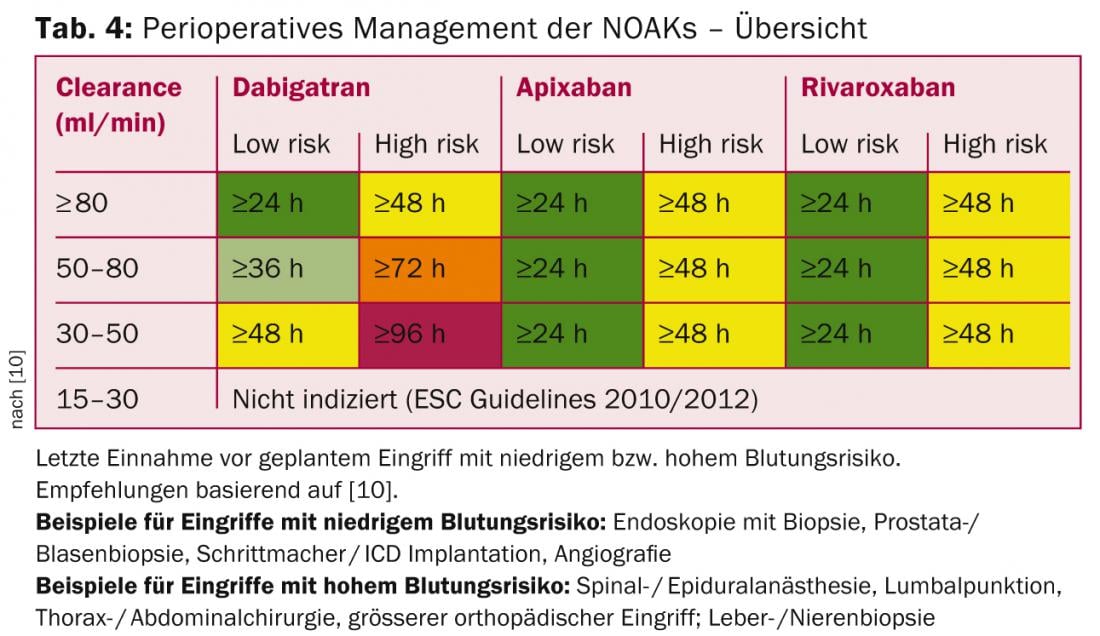
En el caso de procedimientos con un riesgo de hemorragia muy bajo (intervenciones dentales, cataratas, glaucoma, endoscopia sin intervención), el procedimiento puede realizarse normalmente en el nivel valle del NOAK (es decir, antes de la siguiente dosis prevista), tomándose la siguiente dosis seis horas más tarde (si la hemostasia es buena) [10].
Tras el procedimiento, el NOAK puede reiniciarse al cabo de seis u ocho horas en caso de hemostasia directa o completa. En el caso de procedimientos importantes en los que aún exista riesgo de hemorragia, puede ser necesario esperar de dos a tres días antes de reiniciarlos. En estas situaciones, debe iniciarse la heparina no fraccionada o de bajo peso molecular a una dosis profiláctica entre seis y ocho horas después de la intervención. Tras una hemostasia segura, se pasa al NOAK con la dosis completa.
Resumen
Debido a los convincentes resultados de los estudios y a la facilidad de uso, los NOAK se han convertido desde hace tiempo en parte de la práctica clínica diaria en la profilaxis del ictus por fibrilación auricular. No se dispone de datos de ensayos aleatorios para muchas de las recomendaciones prácticas mencionadas. Sin embargo, ocurren en la vida cotidiana, por lo que se necesitan recomendaciones sobre la mejor manera de afrontar estas situaciones, basadas en la opinión de expertos como la detallada Guía práctica de la EHRA [10]. Para un estudio más detallado, consulte ésta y otras publicaciones adicionales [6, 7, 10].
PD Jan Steffel, MD
Declaraciones de conflicto de intereses: PD El Dr. Jan Steffel ha recibido honorarios por consultoría y/o conferencias de AstraZeneca, Bayer HealthCare, Boehringer Ingelheim, Bristol-Myers Squibb, Daiichi Sankyo, Pfizer y Roche.
Literatura:
- Connolly SJ, et al: Dabigatrán frente a warfarina en pacientes con fibrilación auricular. N Engl J Med 2009; 361: 1139-1151.
- Patel MR, et al: Rivaroxaban frente a warfarina en la fibrilación auricular no valvular. N Engl J Med 2011; 365: 883-891.
- Granger CB, et al: Apixaban frente a warfarina en pacientes con fibrilación auricular. N Engl J Med 2011; 365: 981-992.
- Giugliano RP, et al: Edoxaban frente a warfarina en pacientes con fibrilación auricular. N Engl J Med 2013.
- Steffel J, Braunwald E: Nuevos anticoagulantes orales: enfoque en la prevención del ictus y el tratamiento de la tromboembolia venosa. Eur Heart J 2011; 32: 1968-1976.
- Steffel J, Brunckhorst C: Profilaxis del ictus en la fibrilación auricular. Bremen: UniMed; 2012.
- Steffel J, et al: Prevención del ictus en la fibrilación auricular. Bremen: UniMed; 2014 (en prensa).
- Steffel J: Nuevos anticoagulantes: prevención y tratamiento de acontecimientos tromboembólicos. Leading Opinions Cardiología + Medicina Vascular 2011; 2: 14-19.
- Steffel J: Los nuevos anticoagulantes – aspectos prácticos en la aplicación. Leading Opinions Cardiología + Medicina Vascular 2012; 2: 10-14.
- Heidbuchel H, et al: Guía práctica de la Asociación Europea del Ritmo Cardiaco sobre el uso de nuevos anticoagulantes orales en pacientes con fibrilación auricular no valvular. Europace 2013; 15: 625-651.
- Steffel J, Hindricks G: Apixaban en la insuficiencia renal: navegación exitosa entre la escila y la Caribdis. Eur Heart J 2012; 33: 2766-2768.
- Steffel J: Nuevos anticoagulantes orales en función renal alterada y diálisis. Leading Opinions Nefrología 2013; 2: 73-75.
- Camm AJ, et al: 2012 focused update of the esc guidelines for the management of atrial fibrillation: Una actualización de las directrices del esc de 2010 para el tratamiento de la fibrilación auricular. Desarrollado con la contribución especial de la asociación europea del ritmo cardiaco. Europace 2012.
- Marinigh R, Lane DA, Lip GY: Insuficiencia renal grave y prevención del ictus en la fibrilación auricular: Implicaciones para la tromboprofilaxis y el riesgo de hemorragia. J Am Coll Cardiol 2011; 57: 1339-1348.
- Hohnloser SH, et al.: Eficacia del apixaban en comparación con la warfarina en relación con la función renal en pacientes con fibrilación auricular: Conclusiones del ensayo aristotle. Eur Heart J 2012.
- Dowlatshahi D, et al: Mal pronóstico en la hemorragia intracraneal asociada a warfarina a pesar de la reversión de la anticoagulación. Ictus 2012; 43: 1812-1817.
- Lee SB, et al: Progresión de la hemorragia intracerebral asociada a la warfarina tras la normalización del inr con ffp. Neurología 2006; 67: 1272-1274.
- Kuwashiro T, et al: Efecto del concentrado de complejo de protrombina sobre el agrandamiento del hematoma y el resultado clínico en pacientes con hemorragia intracerebral asociada a anticoagulantes. Cerebrovasc Dis 2011; 31: 170-176.
- Sourgounis A, et al: Stents coronarios y anticoagulación crónica. Circulation 2009; 119: 1682-1688.
- Camm AJ, et al: Guidelines for the management of atrial fibrillation: The task force for the management of atrial fibrillation of the european society of cardiology (esc). Europace 2010; 12: 1360-1420.
- Dewilde WJ, et al: Uso de clopidogrel con o sin aspirina en pacientes que reciben tratamiento anticoagulante oral y se someten a una intervención coronaria percutánea: Un ensayo abierto, aleatorizado y controlado. Lancet 2013; 381: 1107-1115.
- Nagarakanti R, et al: Dabigatrán frente a warfarina en pacientes con fibrilación auricular: Un análisis de pacientes sometidos a cardioversión. Circulation 2011; 123: 131-136.
CARDIOVASC 2014; 13(2): 12-16
PRÁCTICA GP 2014; 9(6): 32-37