El herpes zóster es una enfermedad gravosa y potencialmente peligrosa, pero ahora se puede prevenir de forma eficaz y sencilla mediante la vacunación. La vacuna recombinante y adyuvada contra el zóster proporciona una profilaxis eficaz para los pacientes. Por ello, la atención sanitaria preventiva de los pacientes es una prioridad absoluta para los médicos. para los pacientes en lo alto de la lista de prioridades.
A menudo descartada como una enfermedad infantil inofensiva, la varicela se asocia con frecuencia y regularidad a infecciones bacterianas secundarias. También se conocen las eflorescencias hemorrágicas graves, a veces mortales, y la afectación de órganos en la inmunodeficiencia. Ya en la infancia, existe un riesgo de reactivación endógena del VVZ (herpes zóster), normalmente cuando un niño contrae la varicela en los primeros meses de vida. Sin embargo, la varicela no es una enfermedad exclusiva de la infancia. Los que no se infectan en la infancia lo harán tarde o temprano en la edad adulta, con consecuencias desagradables. Esto se debe a que una enfermedad en la edad adulta suele ser más grave y suele ir acompañada de complicaciones. Especialmente durante el embarazo, debe evitarse contraer la varicela, ya que puede dañar al feto y, en el peor de los casos, provocar un mortinato.
Patogénesis
La infección inicial por el virus de la varicela-zóster conduce, por una parte, a la inmunidad frente a la reinfección por exposición exógena y, por otra, a la protección frente a la reactivación endógena. Es de suponer que se produzca un cierto refuerzo del sistema inmunitario en caso de nuevo contacto con el virus o en caso de herpes zóster propiamente dicho. Sin embargo, este refuerzo natural no es muy eficaz, por lo que se observan cada vez más reactivaciones a medida que aumenta la edad (Fig. 1 ) [1].

La razón de la aparición del herpes zóster es la persistencia del virus de la varicela zóster. Se supone que tras la curación de las lesiones de la erupción original, en la que los virus se propagan por vía hematógena y están entonces presentes al máximo en cientos de eflorescencias en la piel, vuelven a migrar a lo largo de los nervios sensoriales hasta la médula espinal, donde habitan en el asta posterior en una fase de latencia y permanecen de por vida. Si la inmunidad disminuye entonces, por ejemplo debido a la medicación, la inmunosupresión o el envejecimiento natural del sistema inmunitario, el virus regresa a la piel a lo largo de estos nervios y da lugar al clásico cuadro de medio lado del herpes zóster.
Presentación clínica del herpes zóster
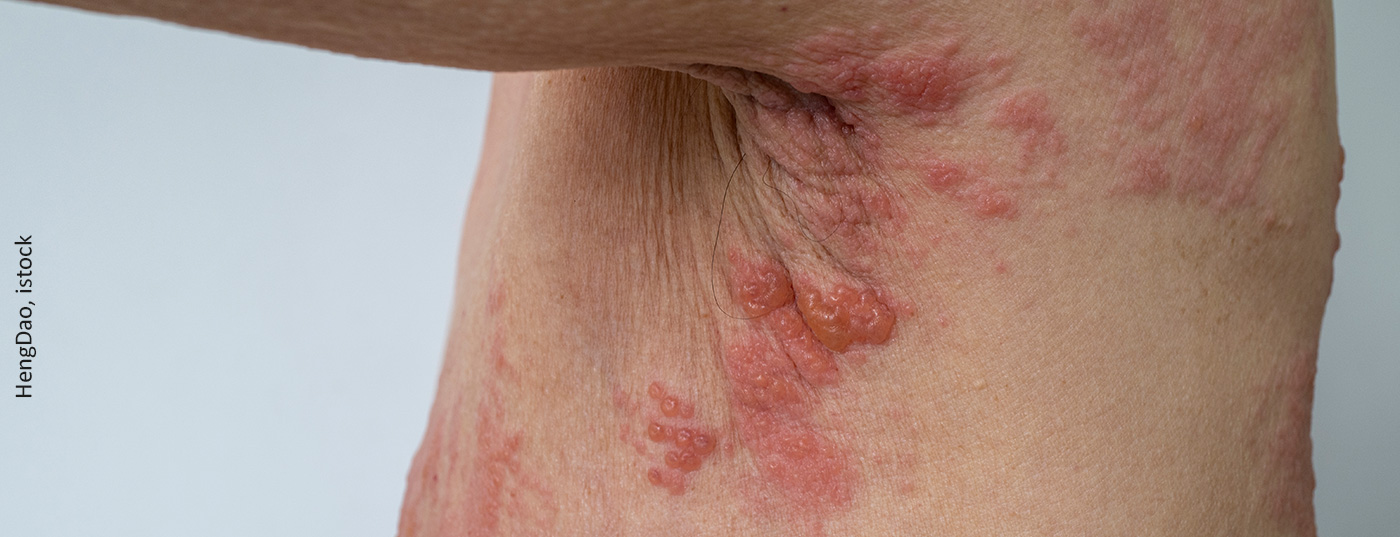
El cuadro clínico del herpes zóster se manifiesta en eflorescencias dolorosas, agrupadas en el dermatoma respectivo que experimenta la reactivación. El herpes zóster también es temido por su neuralgia postherpética. La probabilidad de vivir con dolor intenso durante semanas o meses tras superar la enfermedad está correlacionada con la edad. Si la enfermedad se diagnostica a los 30 años, afecta al 7% de los pacientes, a los 50 al 12% y a los 70 al 18%. También se temen complicaciones oftalmológicas en la cara, sobre todo en la sección superior del trigémino, donde se ve afectado el ojo. Éstas pueden provocar cicatrices en la córnea y dañar la visión [2].
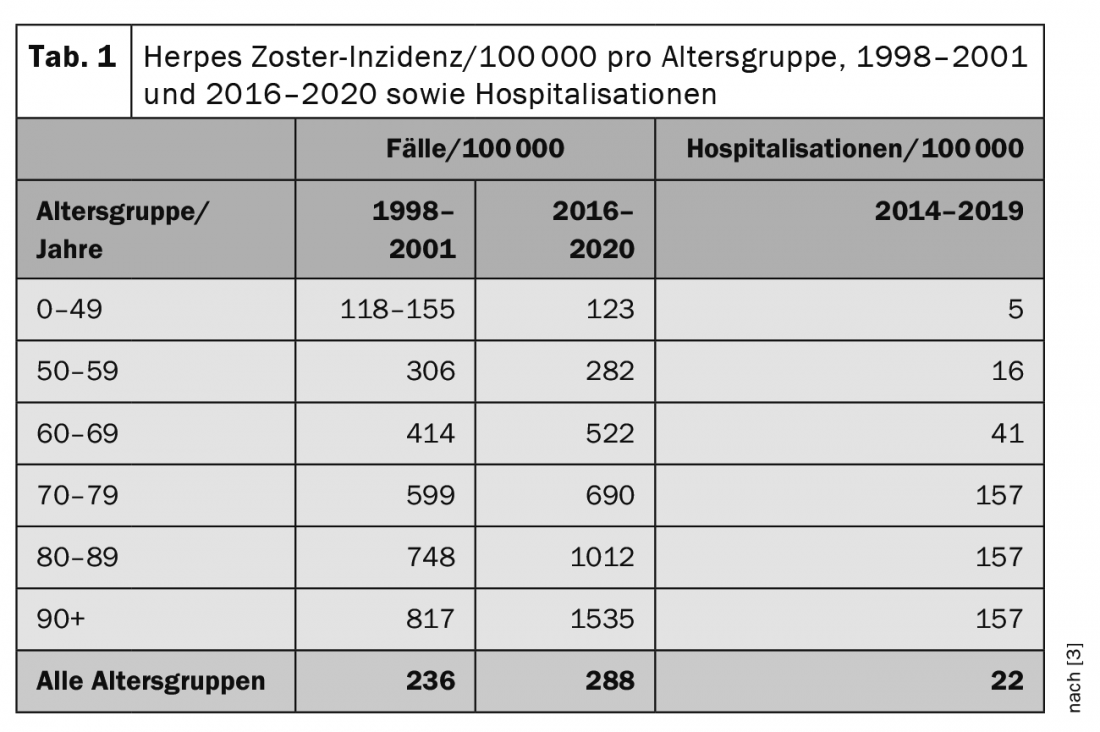
Epidemiología
En Suiza, el sistema suizo de vigilancia Sentinella estimó la incidencia anual de visitas al médico de cabecera debidas al herpes zóster en los cuatro años comprendidos entre 1998 y 2001. Los resultados mostraron una media estable de unos 17.000 casos al año. En el grupo de edad de 60 a 69 años, se registraron aproximadamente 2700 casos al año, en el grupo de 70 a 79 años aproximadamente 3000 casos al año y en el grupo de 80 años y más aproximadamente 2200 casos al año. Desde 2016, se ha vuelto a notificar herpes zóster en el sistema de vigilancia Sentinella. (Tab. 1) [3] muestra las incidencias anuales extrapoladas para los dos periodos de encuesta (valores medios) por grupo de edad. A lo largo de la vida, el riesgo de contraer herpes zóster es acumulativo. Se calcula que alrededor del 10-20% de todas las personas enferman al menos una vez a lo largo de su vida. Además, en los últimos 10-20 años se observa un aumento significativo del número de casos de herpes zóster, sobre todo en personas mayores. La razón de ello es probablemente que en los últimos años se han introducido en este grupo de edad una serie de opciones de tratamiento de naturaleza medicinal (“biológicos”). Aunque permiten un tratamiento más eficaz de, por ejemplo, el lupus eritematoso sistémico (LES) o la artritis reumatoide (AR), como efecto secundario pueden provocar una inmunodeficiencia parcial y aumentar así el riesgo de herpes zóster. Por lo tanto, el riesgo de tener que ser hospitalizado debido a un curso grave de herpes zóster también se correlaciona con la edad. Cada año se registran en Suiza unos 30.000 nuevos casos de herpes zóster [3,4].
Prevención de la vacunación – “La reina de la medicina
Ya en 2018, la Oficina Federal de Salud Pública (FOPH) y la Comisión Federal para Cuestiones de Inmunización (EKIF) recomendaron por primera vez la vacunación contra el herpes zóster con una vacuna viva atenuada entonces novedosa (Zostavax®) para los dos grupos de personas siguientes: Personas inmunocompetentes de 65 a 79 años y personas inmunocomprometidas de 50 a 79 años, siempre que no estén aún inmunocomprometidas o sólo ligeramente inmunocomprometidas en el momento de la vacunación. La vacuna se administra independientemente de si la persona ya ha padecido varicela y/o herpes zóster. Esta vacuna viva contiene 14 veces más virus de la varicela zóster que Varivax® y, por lo tanto, está tan altamente concentrada que refuerza la inmunidad primaria natural de la persona vacunada. El esquema de vacunación recomendado corresponde a una dosis (0,65 ml s.c.) y está indicado para la prevención del herpes zóster y de la neuralgia postherpética (NPH) causada por el herpes zóster [5].
Vacuna viva Zostavax
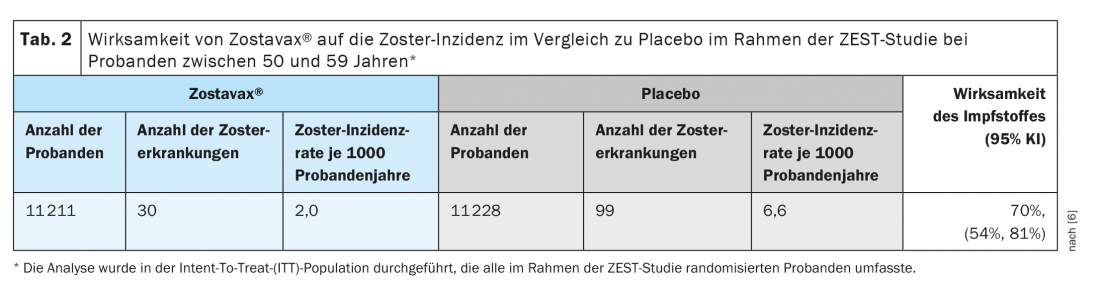
La eficacia clínica protectora de la vacuna viva se ha demostrado en dos grandes ensayos clínicos aleatorizados controlados con placebo en los que los sujetos recibieron la vacuna por vía subcutánea. El ensayo ZEST fue un ensayo clínico doble ciego controlado con placebo en el que 22.439 sujetos de entre 50 y 59 años fueron asignados aleatoriamente a recibir una dosis única de la vacuna o placebo y fueron seguidos durante una mediana de 1,3 años (de 0 a 2 años) para detectar el desarrollo de zoster. La determinación final de los casos de zoster se realizó mediante la reacción en cadena de la polimerasa (PCR) (86%) o mediante un panel de evaluación clínica (14%). Zostavax® provocó una disminución significativa de los casos de zoster con una eficacia del 70% en comparación con el placebo (Tab. 2 ) [6].
El ensayo SP también fue un ensayo clínico doble ciego controlado con placebo en el que 38 546 sujetos de 60 años o más fueron asignados aleatoriamente a recibir una dosis única de la vacuna o placebo y fueron seguidos durante una mediana de 3,1 años (de 31 días a 4,9 años) para detectar el desarrollo de zoster. En el estudio SP, aunque el zoster disminuyó en casi todos los dermatomas, también lo hizo la eficacia de la vacuna. Ésta era del orden del 50-60% para las personas de 60-69 años o incluso muy inferior al 50% a partir de los 70 años (Tabla 3) [6].

Vacuna muerta Shingrix
Recientemente, se ha introducido en Suiza un nuevo desarrollo de la vacuna contra el herpes zóster, que se administra internacionalmente desde hace algún tiempo. Se trata de la vacuna inactivada Shingrix®, que contiene 50 µg de glicoproteína E (antígeno gE) del virus de la varicela-zóster + adyuvante AS01B. El adyuvante AS01B está compuesto por el extracto vegetal Quillaja saponaria Molina, fracción 21 (QS-21) (50 µg) y 3-O-desacil-4′-monofosforil lípido A (MPL) de Salmonella minnesota (50 µg). El esquema de vacunación recomendado corresponde a dos dosis (0,5 ml i.m.) a intervalos de dos meses y está indicado para la prevención del herpes zóster a partir de los 18 años.
Como ocurre con todas las infecciones víricas, la inmunidad humana se dirige contra los componentes de la superficie del virus de la varicela-zóster que presentan las células inmunodominantes tras la infección. La glicoproteína E es una proteína similar al proceso espinoso en la superficie del virus de la varicela-zóster y es el principal objetivo de la respuesta inmunitaria tanto humoral como celular contra el virus [7].
En un estudio de búsqueda de dosis, los sujetos recibieron 25, 50 ó 100 µg adyuvados de una vacuna candidata contra el herpes zóster que contenía la glicoproteína E (gE) del virus de la varicela zóster con o sin el sistema adyuvante AS01B. La frecuencia de células T CD4+ específicas de gE fue >3 veces mayor tras dos dosis de todas las formulaciones de gE/AS01B que tras una dosis de 100 µg de gE/AS01B o dos dosis de 100 µg de gE/salina. Las frecuencias fueron comparables tras dos dosis de 25, 50 ó 100 µg de gE/AS01B. Las concentraciones séricas de anticuerpos anti-GE fueron comparables y superiores a las de los otros grupos tras dos dosis de 50 ó 100 µg de gE/AS01B. Las respuestas inmunitarias duraron al menos 36 meses. La reactividad de todas las formulaciones gE/AS01B fue similar pero superior a la de gE/sal. Los resultados mostraron que las tres formulaciones de gE/AS01B eran inmunogénicas y bien toleradas por adultos de ≥60 años. Además, dos vacunaciones con gE/AS01B indujeron respuestas inmunitarias superiores a una y la dosis de gE afectó a la respuesta inmunitaria humoral pero no a la celular [8].
Eficacia y tolerabilidad
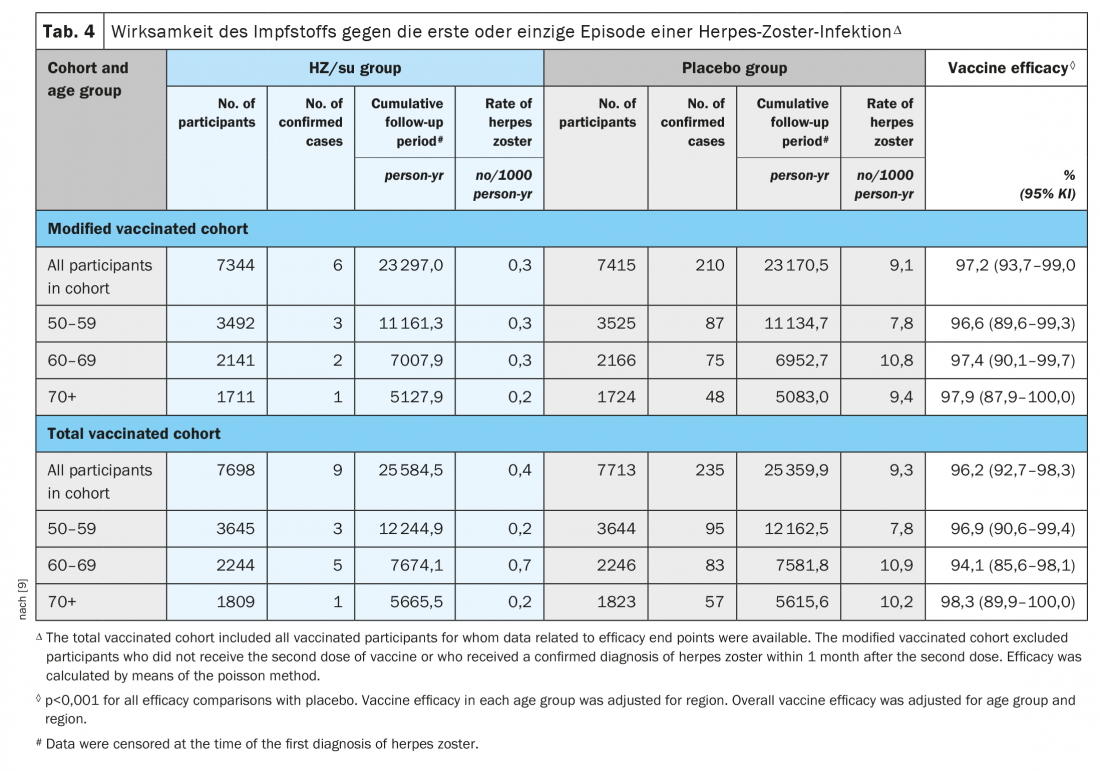
El estudio ZOE-50, realizado en un total de 15.411 adultos de 50 años o más, demostró que la vacuna de la subunidad del herpes zóster (HZ/su) que contiene la glicoproteína E recombinante del virus de la varicela zóster y el sistema adyuvante AS01B se asoció con un 97,2% (intervalo de confianza del 95%, 93,7 a 99,0; p<0,001) menos de riesgo de herpes zóster que el placebo. La eficacia de la vacuna se situó entre el 96,6% y el 97,9% para todos los grupos de edad (Tab. 4) [9].
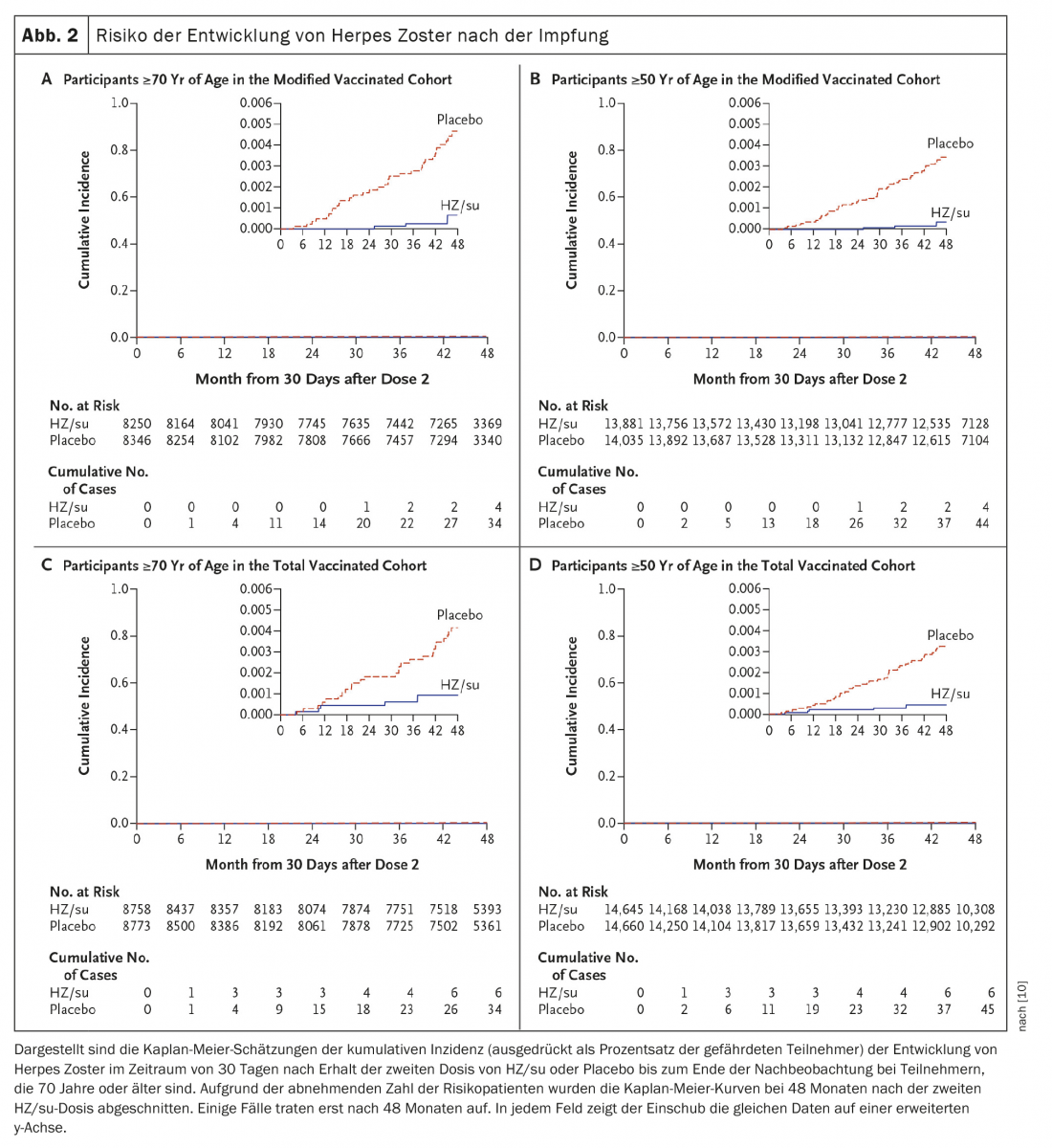
Un segundo estudio se realizó simultáneamente en los mismos lugares e investigó la seguridad y eficacia del HZ/su en adultos de 70 años o más (ZOE-70). En ZOE-70, 13 900 participantes evaluables (edad media 75,6 años) recibieron HZ/su (6950 participantes) o placebo (6950 participantes). Durante una mediana de seguimiento de 3,7 años, se produjo herpes zóster en 23 receptores de HZ/su y en 223 receptores de placebo (0,9 frente a 9,2 por 1000 personas-año). La eficacia de la vacuna contra el herpes zóster fue del 89,8% (intervalo de confianza del 95%, 84,2 a 93,7; p<0,001) y fue similar en los participantes de 70 a 79 años (90,0%) y en los de 80 años o más (89,1%). En los análisis agrupados de los datos de los participantes de 70 años o más en ZOE-50 y ZOE-70 (16 596 participantes), la eficacia de la vacuna contra el herpes zóster fue del 91,3% (IC del 95%, 86,8 a 94,5; p<0,001) y la eficacia de la vacuna contra la neuralgia postherpética 88,8% (IC 95%, 68,7 a 97,1; p<0,001) (Fig. 2) [10].
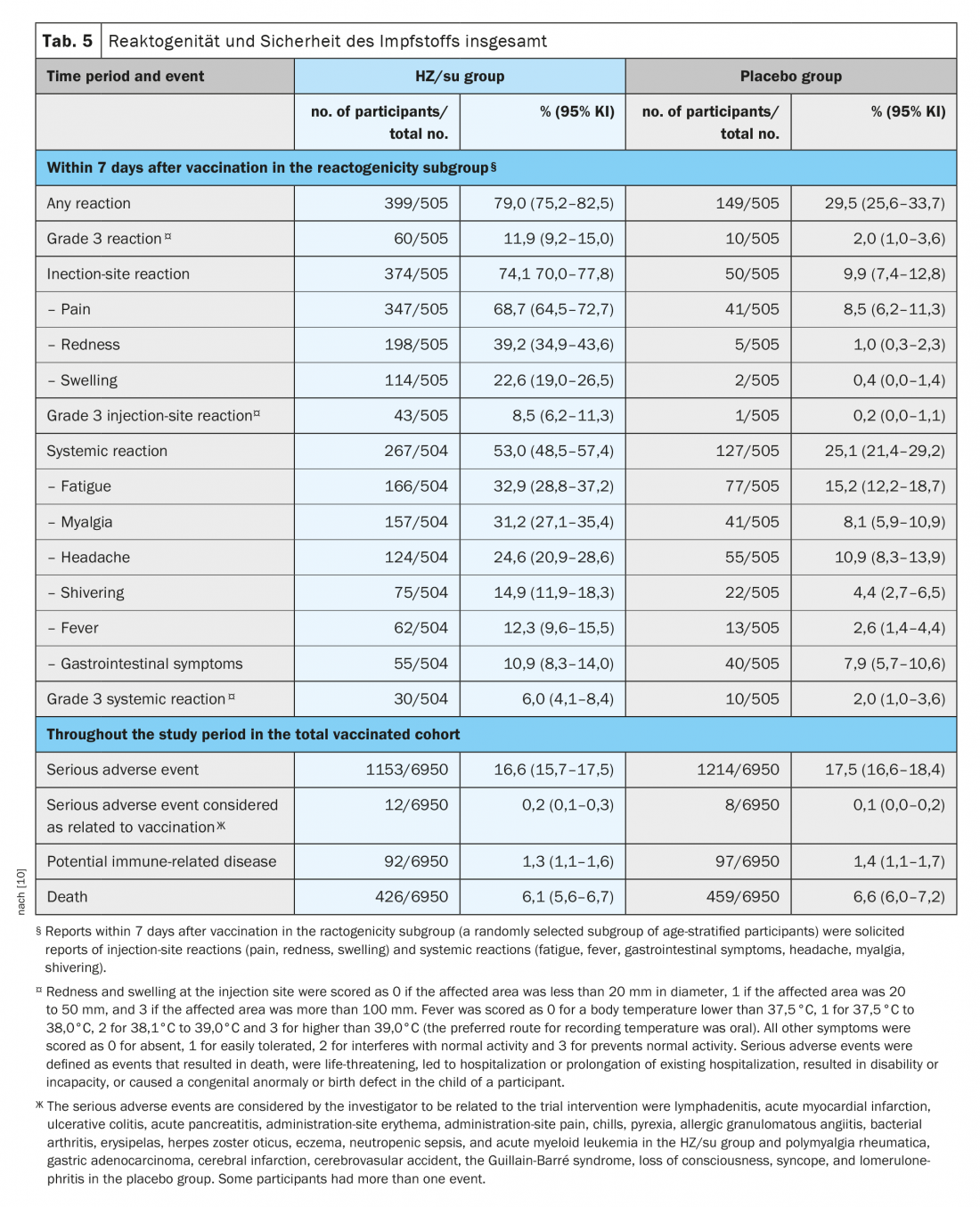
En el estudio ZOE-70, un total de 1025 participantes (7,4%) fueron asignados aleatoriamente al subgrupo de reactogenicidad (512 receptores de HZ/su y 513 receptores de placebo). En este subgrupo, las notificaciones solicitadas de reacciones se produjeron en los siete días siguientes a cada vacunación en el 79,0% de los receptores de HZ/su y en el 29,5% de los receptores de placebo (tabla 5) [10]. Mientras que se produjeron reacciones en el lugar de la inyección en el 74,1% de los receptores de HZ/su y en el 9,9% de los receptores de placebo; la mayoría de las reacciones fueron de intensidad leve a moderada. Se notificaron reacciones de grado 3 en el lugar de la inyección en el 8,5% de los receptores de HZ/su y en el 0,2% de los receptores de placebo. Se produjeron reacciones sistémicas en el 53,0% de los receptores de HZ/su y en el 25,1% de los receptores de placebo (se notificaron reacciones de grado 3 en el 6,0% y el 2,0%, respectivamente). En el grupo de HZ/su, la reacción más común en el lugar de la inyección fue el dolor (en el 68,7% de los receptores de HZ/su) y la reacción sistémica más común fue la fatiga (en el 32,9%). Las reacciones fueron transitorias, con una duración media de dos a tres días para las reacciones en el lugar de la inyección, de uno a dos días para las reacciones sistémicas y de uno a dos días para las reacciones de grado 3. La frecuencia global y la gravedad de las reacciones desencadenadas no aumentaron significativamente después de la segunda dosis. [10].
Nueva recomendación de vacunación contra el herpes zóster
Basándose en estos resultados, claramente positivos en comparación con la vacuna viva, la FOPH y la EKIF recomiendan la vacunación contra el herpes zóster con la vacuna de subunidades adyuvada Shingrix® a partir de 2021. Esto se aplica tanto a las personas sanas mayores de 65 años como a los pacientes con inmunodeficiencia mayores de 50 años o con inmunodeficiencia grave mayores de 18 años. Las recomendaciones anteriores de noviembre de 2017 para la vacuna viva Zostavax® sólo se aplican ahora a las personas de 65 a 79 años sin inmunodeficiencia, que prefieren Zostavax® a Shingrix® [3].
Shingrix® se recomienda como vacunación suplementaria para todas las personas inmunocompetentes de ≥65 años, independientemente de sus antecedentes individuales de varicela y herpes zóster. Los médicos están obligados a informar a sus pacientes sobre esta opción de vacunación. Además, Shingrix® se recomienda para todos los pacientes de edad ≥50 años con inmunodeficiencia actual o futura (especialmente celular) asociada a un mayor riesgo de herpes zóster. Esto afecta, por ejemplo, a las personas seropositivas o a los pacientes antes, durante o después de una terapia oncológica activa. En estos pacientes, lo ideal sería administrar la primera dosis ≥2 semanas antes del inicio de la quimioterapia. La segunda dosis con un intervalo mínimo de uno a dos meses después de la primera dosis o lo antes posible después durante o después de la quimioterapia. También se ven afectados los pacientes con enfermedad renal terminal o en diálisis, en tratamiento con productos biológicos, azatioprina, dosis bajas de metotrexato o dosis bajas de corticosteroides de mantenimiento, y los pacientes con otras enfermedades subyacentes que deterioran la inmunidad (especialmente la inmunidad celular). Esto incluye también, por ejemplo, a los pacientes con artritis reumatoide, asma grave/COPD, diabetes mellitus tipo 1 insuficientemente controlada y otras enfermedades autoinmunes. En estas personas, se recomiendan dos dosis de Shingrix® con un intervalo mínimo de dos meses.
Además, Shingrix® está recomendado para pacientes de edad ≥18 años que padezcan actualmente inmunodeficiencia grave o que estén recibiendo tratamiento inmunosupresor o vayan a recibirlo en un futuro próximo. En este caso, lo ideal sería administrar la primera dosis ≥4 semanas antes de un inicio supuesto, previsto o planificado de inmunosupresión grave. La segunda dosis con un intervalo mínimo de uno a dos meses después de la primera dosis o tan pronto como sea posible en un momento posterior médicamente favorable durante o después de la terapia. Entre ellos se encuentran, por ejemplo, los pacientes con neoplasias hematológicas, los receptores de células madre hematopoyéticas y de trasplantes de órganos, las personas que están siendo tratadas con inhibidores de JAK o con inmunosupresión intensiva (por ejemplo, combinaciones de inmunosupresores, dosis altas de corticosteroides) debido a una enfermedad inmunomediada como la artritis reumatoide o la enfermedad inflamatoria intestinal, y las personas seropositivas al VIH con <200 linfocitos T CD4 +/l o <5% de porcentaje de linfocitos.
En mujeres embarazadas o en periodo de lactancia, debe realizarse una cuidadosa evaluación individual de riesgos y beneficios. No se recomienda la serología VZV (prueba de anticuerpos) antes de la vacunación con Shingrix®. Ni Shingrix® ni Zostavax® deben utilizarse para prevenir la infección inicial por el VVZ (varicela).
Recomendaciones para la vacuna viva Zostavax
La vacuna viva Zostavax® actualmente disponible está contraindicada en personas con inmunodeficiencia y no debe utilizarse en personas que reciban terapias inmunosupresoras en un futuro próximo. Zostavax® sigue siendo una opción para las personas inmunocompetentes de 65 a 79 años que prefieran Zostavax® a Shingrix®. Zostavax® no es reembolsado por el OKP.
Mensajes para llevarse a casa
- El herpes zóster es una enfermedad gravosa y potencialmente peligrosa, pero ahora se puede prevenir de forma eficaz y sencilla mediante la vacunación.
- La vacuna recombinante adyuvada contra el zóster proporciona una profilaxis eficaz para los pacientes.
- Por lo tanto, una de las tareas de los profesionales médicos es situar la atención sanitaria preventiva de los pacientes en un lugar destacado de la lista de prioridades.
Literatura:
- Arvin A: La inmunidad y el virus de la varicela-zoster. N Engl J Med 2005; doi: 10.1056/NEJMp058091.
- Eidgenössische Kommission für Impffragen (EKIF): Evaluación de las vacunas y la vacunación contra el herpes zóster (ZOSTAVAX® y SHINGRIX®), 2021.
- Oficina Federal de Salud Pública FOPH: Boletín FOPH 47/2021, edición del 27 de noviembre de 2021.
- Bundesamt für Gesundheit = Oficina federal de salud pública. Vacunación contra el herpes zóster: no incluida en el calendario de vacunación suizo. Boletín BAG – OFSP 2010(6): 97.
- Oficina Federal de Salud Pública, Comisión Federal para Cuestiones de Inmunización (EKIF): Schweizerischer Impfplan 2018. Directrices y recomendaciones. Berna: Oficina Federal de Salud Pública, 2018.
- Información especializada Zostavax®, disponible en: www.ema.europa.eu/en/documents/product-information/zostavax-epar-product-information_de.pdf.
- Zerboni L, et al: Mecanismos moleculares de la patogénesis del virus de la varicela zóster. Nat Rev Microbiol 2014; doi: 10.1038/nrmicro3215.
- Chlibek R, et al: Safety and immunogenicity of three different formulations of an adjuvanted varicella-zoster virus subunit candidate vaccine in older adults: A phase II, randomized, controlled study. Vaccine 2014; doi: 10.1016/j.vaccine.2014.01.019.
- Lal H, et al: Eficacia de una vacuna adyuvada contra la subunidad del herpes zóster en adultos mayores. N Engl J Med 2015; doi: 10.1056/NEJMoa1501184.
- Cunningham AL, et al: Eficacia de la vacuna contra la subunidad del herpes zóster en adultos de 70 años o más. N Engl J Med 2016; doi: 10.1056/NEJMoa1603800.
PRÁCTICA GP 2022; 17(10): 6-12