La resistencia a las sustancias antibióticas está aumentando en todo el mundo. Esto conduce a una pérdida gradual de eficacia de muchos antibióticos y dificulta el tratamiento de muchas infecciones. La resistencia a los antibióticos β-lactámicos en las bacterias Gram-negativas suele estar asociada a la producción de β-lactamasas. Algunos de los esfuerzos para superar este mecanismo común de resistencia han tenido éxito. Además de las sustancias que ya han sido aprobadas, actualmente se están investigando varias sustancias activas en ensayos clínicos.
El aumento de la resistencia a los antibióticos de los patógenos bacterianos es un problema importante. Esto afecta tanto a los pacientes hospitalizados como a los ambulatorios, sobre todo porque alrededor del 80% de los antibióticos se prescriben en el ámbito ambulatorio [1,2]. Las estrategias para combatir la resistencia a los antibióticos pueden aplicarse como parte de los programas de administración de antibióticos o de forma independiente. La Sociedad Suiza de Enfermedades Infecciosas publica directrices sobre diversos tipos de infecciones y se han puesto en marcha numerosos proyectos sobre el tema de la resistencia a los antibióticos (recuadro) [3]. “Las más difíciles de tratar siguen siendo las bacterias Gram negativas multirresistentes, porque sólo existen unas pocas opciones buenas para ello”, explicó la Dra. Sarah Tschudin Sutter, de la Clínica de Infectología e Higiene Hospitalaria del Hospital Universitario de Basilea [4]. El Acinetobacter baumannii resistente a los carbapenemes , la Pseudomonas aeruginosa resistente a los carbapenemes y los patógenos resistentes a las cefalosporinas de tercera generación han sido clasificados por la OMS como “patógenos de primera fila” en la lista de prioridades para el desarrollo de nuevos antibióticos.
|
El Centro Suizo para la Resistencia a los Antibióticos (ANRESIS ), un sistema nacional de vigilancia y unidad de investigación sobre la resistencia a los antibióticos y su uso, ofrece, entre otras cosas, una visualización interactiva de los últimos datos sobre resistencia en [15]. El Departamento de Interior y el Departamento de Asuntos Económicos, Educación e Investigación son los responsables de aplicar la estrategia nacional de resistencia a los antibióticos (StAR) [17]. La StAR persigue el objetivo de preservar a largo plazo la eficacia de los antibióticos para los seres humanos y los animales. Entre otras cosas, también se hacen recomendaciones específicas sobre medidas higiénicas para mejorar la higiene de las cocinas con el fin de evitar la transmisión de bacterias resistentes a los antibióticos a través de los alimentos de origen vegetal o animal. Esto está en consonancia con el enfoque “Una sola salud” de la Organización Mundial de la Salud (OMS) para combatir las bacterias resistentes a los antibióticos [18]. El Centro Europeo para el Control de Enfermedades (ECDC ) ofrece un “ATLAS de vigilancia de enfermedades infecciosas” en su página web. Esta herramienta permite estudiar la resistencia a los antibióticos en diferentes países para numerosos patógenos bacterianos importantes [16]. Se está investigando en todo el mundo en numerosos proyectos de estudio sobre los temas de los mecanismos de resistencia y el desarrollo de nuevos antibióticos. |
Los mecanismos de resistencia más importantes y las necesidades no cubiertas
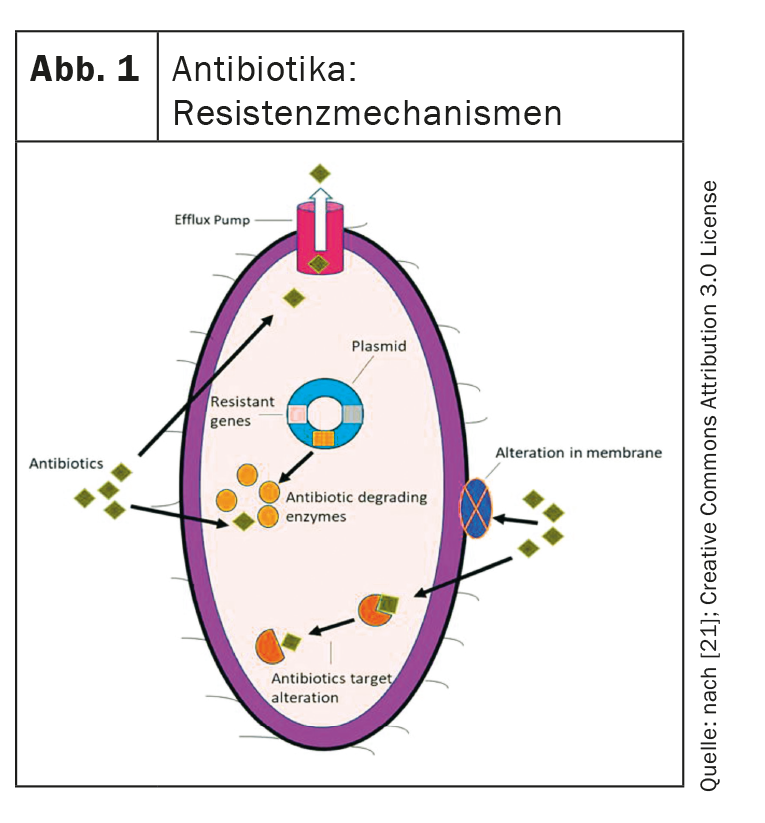
Estos son los cuatro mecanismos de resistencia más importantes que pueden desarrollar las bacterias y que los nuevos antibióticos deben superar (Fig. 1) [4,21,22]:
- Pérdida de porinas: Las mutaciones en los genes de las porinas provocan su pérdida y, por tanto, una menor permeabilidad de la membrana celular bacteriana. Esto dificulta la absorción de los antibióticos.
- Bombas de eflujo: Las bombas de eflujo también son un factor importante. Estos transportan antibióticos al extracelular y pueden ser regulados al alza.
- Modificación de la diana: El lugar de unión de los antibióticos puede modificarse de tal forma que éstos ya no puedan ejercer su efecto.
- Enzimas hidrolizantes: Pueden descomponer enzimáticamente los antibióticos.
La mayoría de las sustancias antibióticas disponibles en la actualidad son sustancias producidas por los propios hongos y bacterias; entre ellas sólo hay unas pocas producidas sintéticamente. En los últimos 10-15 años, apenas han aparecido nuevos antibióticos en el mercado. En el contexto del desarrollo de la resistencia a los antibióticos, existe una necesidad urgente de desarrollar nuevos agentes antibióticos [5].
Resistencia a las β-lactamasas: un problema mundial
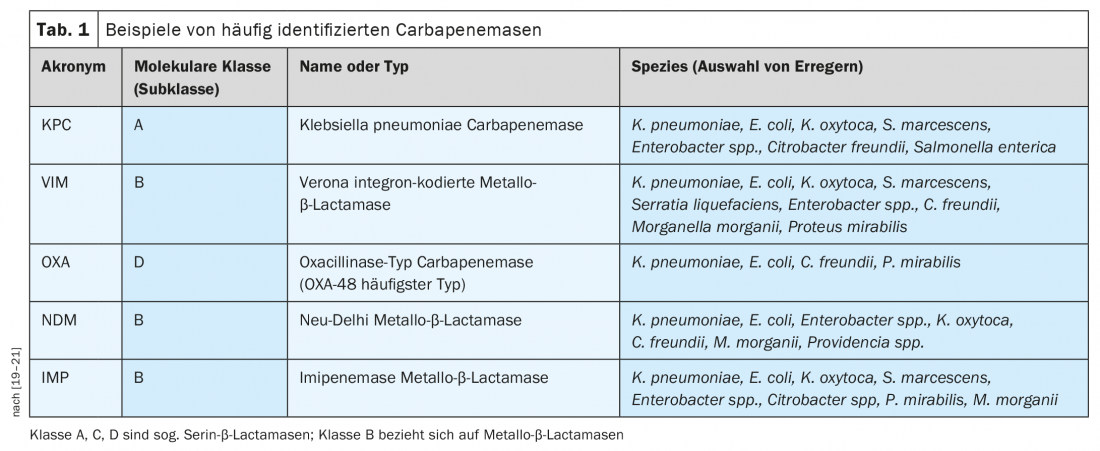
La Organización Mundial de la Salud (OMS) ha emitido una declaración sobre la priorización del desarrollo de antibióticos [6]. Esto demuestra que existe una gran necesidad, en particular, de antibióticos con eficacia en patógenos Gram negativos para combatir la resistencia a los carbapenemas [6]. La resistencia a los antibióticos β-lactámicos en las bacterias Gram-negativas suele estar asociada a la producción de β-lactamasas, incluidas las β-lactamasas de espectro extendido ( ESBL) y las carbapenemasas (Tab. 1), que pertenecen a diferentes clases moleculares [7]. Las carbapenemasas son enzimas bacterianas cuyo desarrollo de resistencia a los antibióticos supone una amenaza actual o potencial para la salud pública [8]. El grupo de los ESBL es homogéneo, es decir, tienen los mismos sustratos, lo que supone una ventaja en términos de tratamiento. Por el contrario, las carbapenemasas son un grupo muy heterogéneo de enzimas con diferentes propiedades químicas y diferentes sustratos. “En consecuencia, apenas es posible encontrar sustancias que sean eficaces para todas las diferentes clases de carbapenemasas”, afirmó el ponente [4]. Las diversas carbapenemasas están muy extendidas en todo el mundo, incluida Europa. En particular, la Pseudomonas aeruginosa resistente a los carbapenemes (CRPA) y la Acinetobacter baumannii resistente a los carbapenemes (CRAB) pueden expresar diferentes mecanismos de resistencia simultáneamente.
¿Cuáles son las estrategias de solución?
Muchas de las sustancias que han salido al mercado en los últimos años son modificaciones de antibióticos ya disponibles o combinaciones de β-lactámicos con inhibidores de la β-lactamasa. Desgraciadamente, no existe una nueva clase de antibióticos, afirma el Prof. Tschudin Sutter. En cuanto a los β-lactámicos, el cefiderocol – una cefalosporina con un nuevo mecanismo de acción que fue aprobada por la Agencia Europea del Medicamento (EMA) en 2020 para el tratamiento de infecciones causadas por patógenos Gram-negativos aerobios en adultos. [9]. El cefiderocol es estructuralmente una cefalosporina a la que se ha acoplado una cadena lateral con estructura de catecol. Las cadenas laterales de la molécula aumentan la estabilidad frente a las β-lactamasas. La denominada cefiderocol, una cefalosporina siderófora, se caracteriza por su capacidad para fijar el hierro trivalente. Las bacterias Gram negativas aerobias necesitan hierro y disponen de un sistema de transporte activo de sideróforos cargados de hierro para satisfacer sus necesidades. El cefiderocol lo utiliza para atravesar la membrana celular externa y destruir la célula interrumpiendo la síntesis de la pared celular [10]. El cefiderocol tiene una gran estabilidad hidrolítica frente a casi todas las β-lactamasas, incluidas las betalactamasas de espectro extendido (BLEE), las enzimas AmpC y las serina y metalocarbapenemasas.
También se dispone de resultados prometedores para el antibiótico oral tebipenem. En un estudio de fase III publicado en el New England Journal of Medicine, se descubrió que el tebipenem (oral) no era inferior al ertapenem (i.v.) para el tratamiento de infecciones complicadas del tracto urinario y mostraba un perfil de efectos secundarios comparable [11].
También se necesitan nuevas opciones de tratamiento que puedan superar la resistencia contra el patógeno gramnegativo Pseudomonas aeruginosa. Los mecanismos más comunes de resistencia a los antibióticos β-lactámicos en P. aeruginosa son el aumento de la expresión de β-lactamasas intrínsecas, la adquisición de nuevas β-lactamasas, el aumento del eflujo de la bomba de eflujo y la pérdida o disminución de la expresión de porinas en la membrana celular, lo que reduce o impide la captación de antibióticos [12]. Entre otras cosas, los pacientes con fibrosis quística necesitan antibióticos eficaces contra las infecciones crónicas por P. aeruginosa. La levofloxacina inhalada mostró una tendencia a mejorar la función pulmonar y un mayor intervalo de tiempo hasta la exacerbación en esta población de pacientes en comparación con la tobramicina [13].
La delafloxacina es también una quinolona y fue aprobada en Suiza en 2020 como antibiótico de reserva para el tratamiento de las infecciones bacterianas agudas de la piel y de las estructuras cutáneas (ABSSSI) [14]. Sus efectos se basan en la inhibición de la topoisomerasa IV bacteriana y de la ADN girasa. La fluoroquinolona tiene propiedades bactericidas contra bacterias grampositivas y gramnegativas y también es eficaz contra gérmenes problemáticos como Klebsiella pneumoniae, MRSA, Pseudomonas aeruginosa. La delafloxacina tiene un carácter aniónico a pH neutro y se encuentra principalmente en forma no cargada a pH ligeramente ácido, lo que la diferencia de otras fluoroquinolonas, que están presentes como cationes a pH ácido y principalmente como zwitteriones a valores superiores y cuya actividad disminuye en el medio ácido. [23].
Congreso: medArt
Literatura:
- Weber R, Chmiel C: Infektiologie – Therapieempfehlungen, Aktualisiert am: 12/2021, www.medix.ch/media/gl_infektiologie_therapieempfehlungen_06.2021_23.6.21_mh_1.pdf, (última consulta: 31/08/2022).
- FOPH: ¿Cómo se prescriben hoy los antibióticos en Suiza? www.bag.admin.ch/bag/de/home/krankheiten/infektionskrankheiten-bekaempfen/antibiotikaresistenzen/wie-werden-heute-in-der-schweiz-antibiotika-verschrieben.html, (última consulta: 31.08.2022)
- Sociedad Suiza de Infectología, www.ssi.guidelines.ch, (última consulta: 31.08.2022)
- “Nuevos antibióticos”, Prof. Dra. med. Sarah Tschudin Sutter, medArt 20.-24.06.2022
- BAG: Condiciones marco en el campo de los antibióticos, www.bag.admin.ch/bag/de/home/strategie-und-politik/nationale-gesundheitsstrategien/strategie-antibiotikaresistenzen-schweiz/rahmenbedingungen-im-bereich-der-antibiotika.html, (última consulta: 31.08.2022)
- Tacconelli E, et al: Discovery, research, and develop ment of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet Infect Dis 2018; 18: 318-327.
- Bush K, Bradford PA: Interacción entre las β-lactamasas y los nuevos inhibidores de β-lactamasas. Nat Rev Microbiol 2019; 17(5): 295-306.
- BAG: Enterobacterias productoras de carbapenemasas (CPE), www.bag.admin.ch/bag/de/home/krankheiten/krankheiten-im-ueberblick/antibiotikaresistente-bakterien.html, (última consulta: 31.08.2022)
- Información sobre medicamentos, www.ema.europa.eu/en/documents/product-information/fetcroja-epar-product-information_de.pdf, (última consulta: 31.08.2022)
- Rössler A: “Cefiderocol: Nuevo antibiótico para vencer la resistencia”, Pharmazeutische Zeitung, 19.01.2021
- Eckburg PB, et al: Hidrobromuro de tebipenem pivoxil oral en infecciones complicadas del tracto urinario. N Engl J Med 2022; 386(14): 1327-1338.
- Poole K: Pseudomonas aeruginosa: Resistencia al máximo. Front Microbiol 2011(2): 1-13.
- Elborn JS, et al: Ensayo de fase 3, abierto y aleatorizado para evaluar la seguridad y eficacia de la solución de inhalación de levofloxacino (APT-1026) frente a la solución de inhalación de tobramicina en pacientes estables con fibrosis quística. J Cyst Fibros 2015; 14(4): 507-514.
- Información sobre medicamentos, www.swissmedicinfo.ch/default.aspx, (última consulta: 31.08.2022)
- ANRESIS, www.anresis.ch/de, (última consulta: 31.08.2022)
- Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC), www.ecdc.europa.eu/en/surveillance-and-disease-data, (última consulta: 31.08.2022)
- Estrategia Resistencia a los Antibióticos Suiza (StAR), https://www.blv.admin.ch/blv/de/home/das-blv/strategien/nationale-strategie-antibiotikaresistenzen.html, (última consulta: 31.08.2022)
- Walsh TR: Un enfoque de una sola salud para la resistencia antimicrobiana. Nat Microbiol. 2018; 3: 854-855.
- Magiorakos AP, et al: Medidas y herramientas de prevención y control de infecciones para la prevención de la entrada de resistentes al carbapenem. Antimicrob Resist Infect Control 2017; 6: 113. https://dx.doi.org/10.1186/s13756-017-0259-z.
- Tzouvelekis LS, et al: Carbapenemasas en Klebsiella Pneumoniae y otras Enterobacteriaceae: Una crisis en evolución de dimensiones globales. Clin Microbiol Rev 2012; 25(4): 682-707. https://dx.doi.org/10.1128/CMR.05035-11.
- Swissnoso, www.swissnoso.ch/fileadmin/swissnoso/Dokumente/5_Forschung_und_Entwicklung/8_Swissnoso_Publikationen/211115_StAR_Teil_II_DE_MDRO-non-outbreak_FINAL.pdf, (última consulta: 31.08.2022)
PRÁCTICA GP 2022; 17(9): 20-21