El hecho de que los inhibidores de la IL17 se caractericen por un rápido inicio de acción se ha demostrado empíricamente en varias ocasiones y también se refleja en un estudio actual de tipo “cabeza a cabeza”. De cara al futuro, hay novedades interesantes en fase de desarrollo, como el nuevo anticuerpo Bimekizumab, que se dirige a las subunidades IL-17A e IL-17F y ha mostrado resultados prometedores en ensayos recientes.
Los primeros biológicos aprobados para el tratamiento de la psoriasis fueron los inhibidores del TNF-alfa adalimumab, etanercept e infliximab. Aunque esto ya supuso una mejora considerable en las opciones de tratamiento, la mayoría de los pacientes no consiguieron liberarse por completo de los síntomas. Mientras tanto, sin embargo, se han producido enormes avances en este sentido.
anti-IL17: rápido inicio de acción como marca registrada
Al inhibidor de la IL12/23 ustekinumab le siguieron los dos inhibidores de la IL17A secukinumab e ixekinumab, así como el antagonista del receptor de la IL17 brodalumab (actualmente no aprobado en Suiza) [1]. El bloqueo de la IL17 demostró ser muy eficaz y permitió optimizar las tasas de respuesta. La última generación de biológicos altamente eficaces también incluye los inhibidores de la IL23 guselkumab, tildrakizumab y risankizumab. Existen algunas diferencias entre las clases de sustancias. “La terapia anti-IL17 funciona rápido, muy rápido”, subraya el Prof. Dr. med. Diamant Thaci, Instituto y Centro de Excelencia de la Universidad de Lübeck [2]. Esto ya se puso de manifiesto en el ensayo CLEAR publicado en 2015, en el que el inhibidor de la IL17A secukinumab mostró una respuesta PASI75 temprana, en la semana 4 tras el inicio [3]. Tras 16 semanas de tratamiento, secukinumab demostró ser superior al inhibidor de la IL12/23 ustekinumab en términos de respuesta PASI90 (79% frente a 57,6%; p<0,0001) y consiguió una mejora mayor y más sostenida del estado de la piel en la semana 52.
El hallazgo de un rápido inicio de acción se ha repetido desde entonces varias veces, y los datos de un estudio cara a cara publicado en 2020 lo confirman una vez más. El ensayo IXORA es un estudio aleatorizado a doble ciego que incluyó a pacientes con psoriasis en placas de moderada a grave (PASI ≥12, sPGA ≥3 y ≥10% de superficie corporal afectada) [4]. El criterio de valoración primario fue el PASI100 a las 12 semanas y los criterios de valoración secundarios incluyeron otras puntuaciones PASI y sPGA. De los 1027 pacientes incluidos en el estudio, 520 recibieron ixekizumab y 507 guselkumab. El 41% de los pacientes tratados con ixekizumab alcanzaron un PASI100 tras 12 semanas, frente a sólo el 25% con guselkumab. En conjunto, el ixekizumab demostró ser superior al guselkumab. El inicio de la acción fue más rápido y más pacientes consiguieron una piel sin apariencia, y los perfiles de seguridad fueron comparables. Estos resultados subrayan la rápida respuesta, pero no se pronuncian sobre el efecto a largo plazo, que es objeto de otros estudios.

Lugar de secukinumab en el tratamiento de la APs
En las actuales recomendaciones de tratamiento de la EULAR, los inhibidores del TNF-alfa y los inhibidores de la IL17 se mencionan como biológicos equivalentes de primera línea tras el fracaso de los DMARD convencionales [5]. Esta evaluación se basa en los resultados del estudio comparativo EXCEED sobre la terapia de primera línea para la artritis psoriásica. El estudio multicéntrico de fase IIIb doble ciego incluyó a 853 pacientes adultos con artritis psoriásica activa. 426 pacientes recibieron 300 mg de secukinumab por vía subcutánea al inicio del estudio, en las semanas 1, 2, 3 y 4, y después cada 4 semanas hasta la semana 48. Se administró adalimumab por vía subcutánea cada 2 semanas a 427 pacientes. Con secukinumab, el 67% y con adalimumab el 62% de los participantes en el estudio lograron ACR20 tras 52 semanas [6]. El perfil de seguridad de secukinumab y adalimumab coincidía en gran medida con las señales de seguridad conocidas anteriormente. Las características individuales de los pacientes (por ejemplo, las comorbilidades) se sugieren como criterios de decisión sobre el uso de secukinumab o adalimumab tras el fracaso de un csDMARDS.
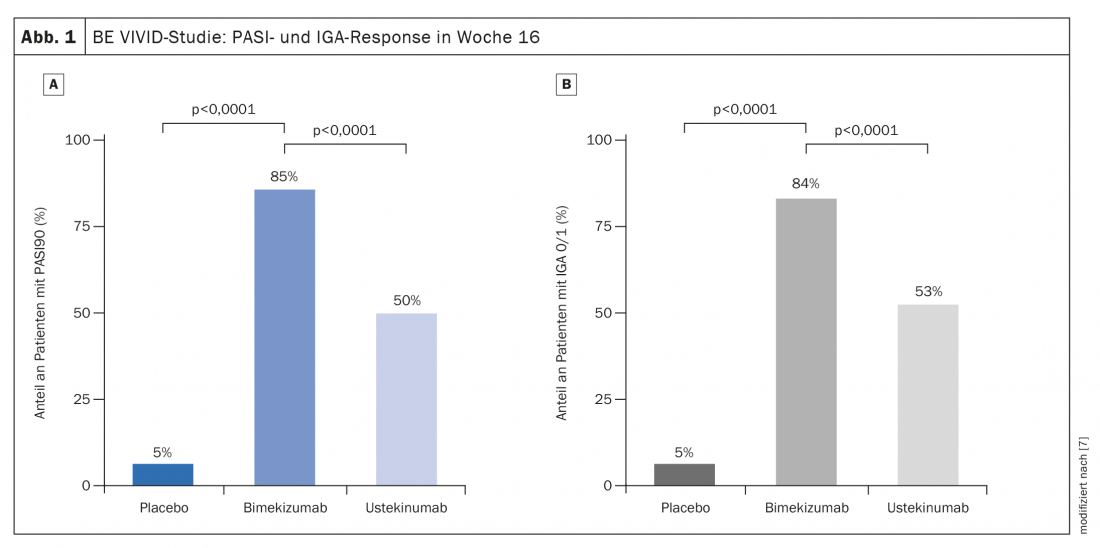
Perspectivas: resultados prometedores del bloqueo de IL-17A/F
En un estudio comparativo publicado en 2021, se demostró que el inhibidor anti-IL17A/F bimekizumab tenía un inicio de acción muy rápido y poca pérdida de eficacia durante el transcurso del estudio. El bimekizumab lo consiguió con respecto al PASI75 en 4 semanas, algo que sólo logró el ustekinumab al cabo de 4 meses, resumió el Prof. Thaci. El estudio multicéntrico comparativo aleatorizado, doble ciego, activo y controlado con placebo BE VIVID incluyó a 567 adultos [7]. 321 participantes en el estudio recibieron bimekizumab 320 mg cada 4 semanas y 163 sujetos fueron tratados con ustekinumab 45 mg o 90 mg (ajustado al peso) cada 12 semanas, 83 pacientes recibieron placebo cada 4 semanas. En la semana 16 después del inicio, el 85% de los pacientes del brazo de bimekizumab alcanzaron PASI90, frente al 50% del brazo de ustekinumab (diferencia de riesgo 35 [95%-KI 27–43]; p<0,0001) (Fig. 1A). En el grupo placebo, esta proporción fue del 5% (diferencia de riesgo 80 [95%-KI 74–86]; p<0,0001). Aproximadamente el 84% de los pacientes tratados con bimekizumab tenían una puntuación IGA de 0 o 1 en comparación con el 53% tratados con ustekinumab (diferencia de riesgo 30 [95%-KI 22–39]; p<0,0001) y el 5% tratados con placebo (diferencia de riesgo 79 [95%-KI 73-85] p<0,0001) (Fig. 1B). El bimekizumab también logró una respuesta más rápida. En la semana 4, tras una dosis única, se observó una puntuación PASI75 en el 77% de los pacientes del grupo de bimekizumab, en comparación con sólo el 15% de los de ustekinumab (OR 18,2; IC 95%: 11-30,1; p<0,0001). También fue destacable que los valores PASI90 no sólo fueron significativamente mejores después de 4 meses, sino que apenas hubo pérdida de eficacia con el bimekizumab en el curso posterior del estudio. Esto apunta a un potencial prometedor para la terapia anti-IL17 a largo plazo, dijo el ponente.
Congreso: Conferencia DDG 2021
Literatura:
- Sawyer LM, et al: Evaluación de la eficacia relativa de los tratamientos dirigidos con interleucina-17 e interleucina-23 para la psoriasis en placas de moderada a grave: revisión sistemática y metaanálisis en red de la respuesta PASI. PLoS One 2019; 14(8): 1-31.
- Thaci D: Biológicos a través de los tiempos – enfoques terapéuticos ayer, hoy y mañana. Prof. Dr. med. Diamant Thaci, S09: Inflamaciones de las vías: Dermatitis atópica y psoriasis como enfermedades sistémicas, Conferencia DDG 2021, 17.04.2021.
- Thaci D, et al: Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate to severe plaque psoriasis: CLEAR, a randomised controlled trial. JAAD 2015; 73(3): 400-409.
- Blauvelt A, et al: Grupo de estudio IXORA-R. Comparación directa de ixekizumab frente a guselkumab en pacientes con psoriasis en placas de moderada a grave: eficacia, seguridad y velocidad de respuesta a las 12 semanas de un ensayo aleatorizado y doble ciego. Br J Dermatol 2020; 182(6): 1348-1358.
- Gossec L, et al: Recomendaciones EULAR para el tratamiento de la artritis psoriásica con terapias farmacológicas: actualización de 2019. Ann Rheum Dis 2020; 79(6): 700-712.
- McInnes IB, et al: Secukinumab frente a adalimumab para el tratamiento de la artritis psoriásica activa (EXCEED): un ensayo de fase 3b, doble ciego, de grupos paralelos, aleatorizado y controlado de forma activa. The Lancet 2020; 395(10235): 1496-1505.
- Reich K, et al: Bimekizumab frente a ustekinumab para el tratamiento de la psoriasis en placas de moderada a grave (BE VIVID): eficacia y seguridad de un ensayo de fase 3 de 52 semanas, multicéntrico, doble ciego, con comparador activo y controlado con placebo. Lancet 2021; 397(10273): 487-498.
- NCT03440736, https://clinicaltrials.gov/ct2/show/NCT03440736
DERMATOLOGIE PRAXIS 2021; 31(3): 20-22 (publicado el 1.6.21, antes de impresión).